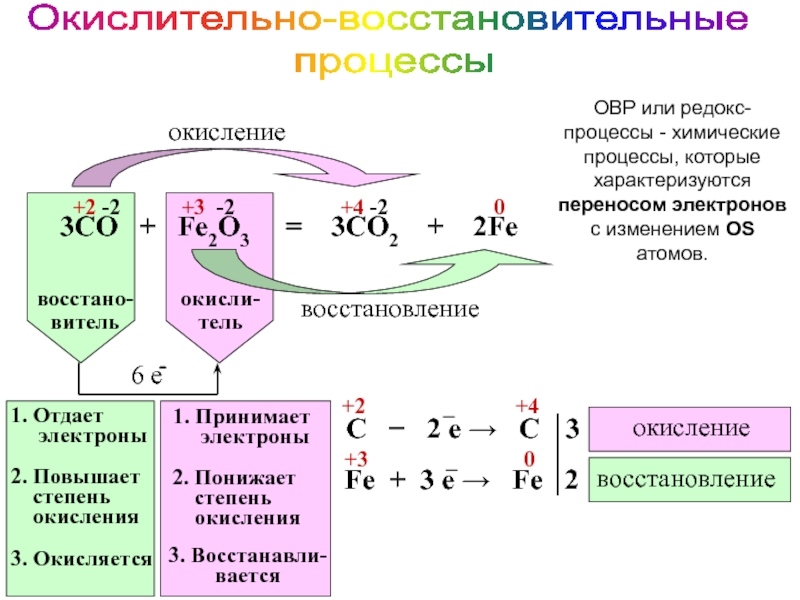
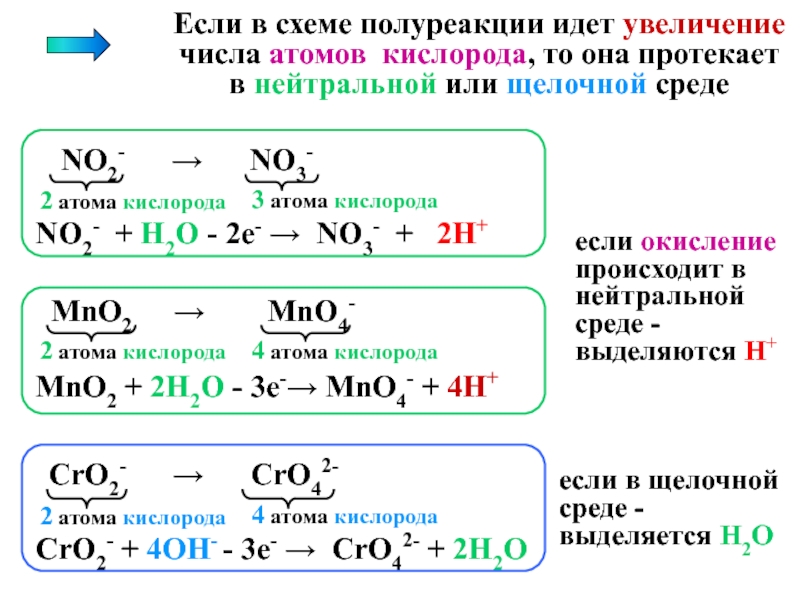
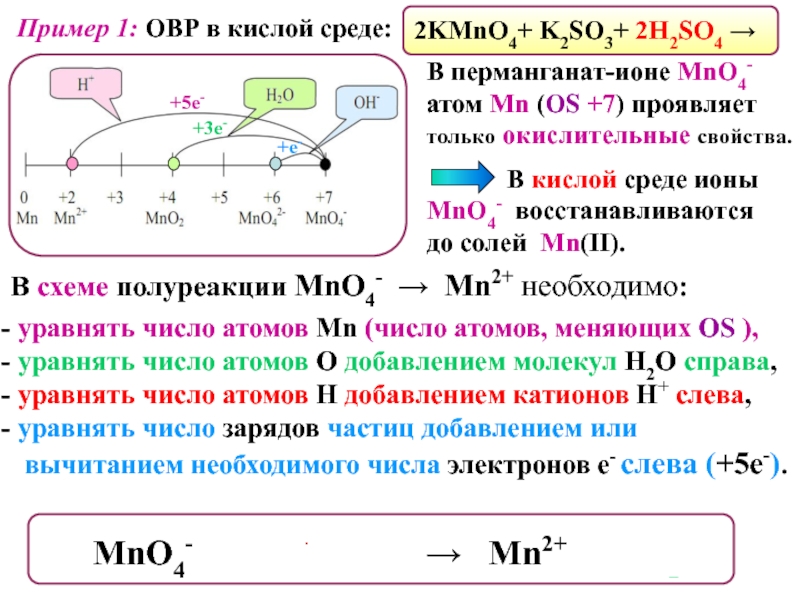
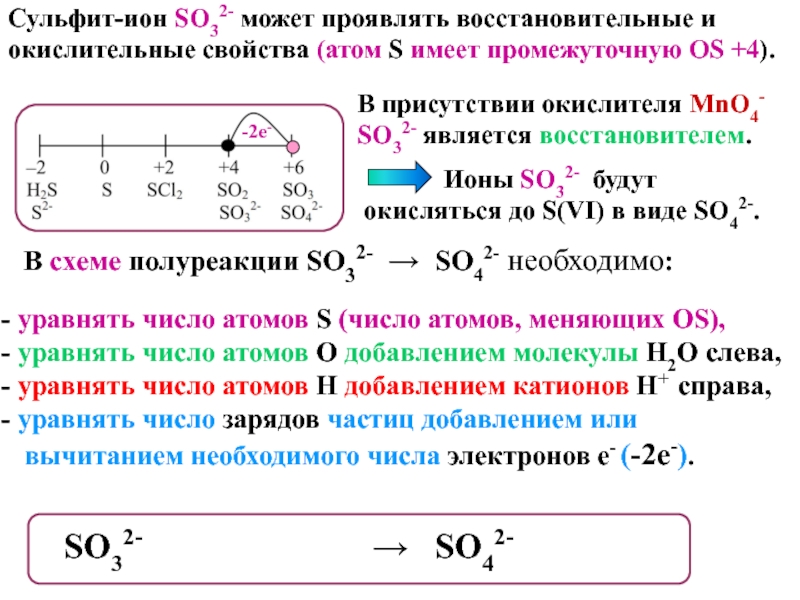
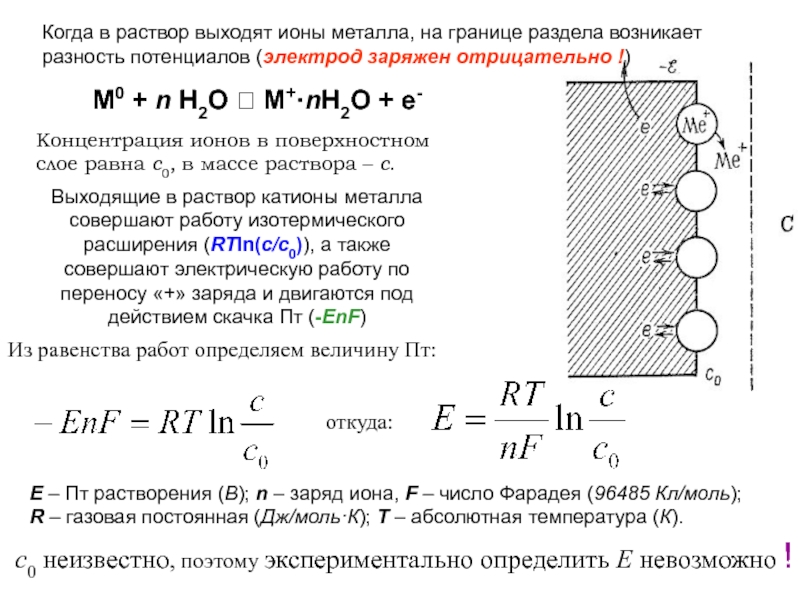
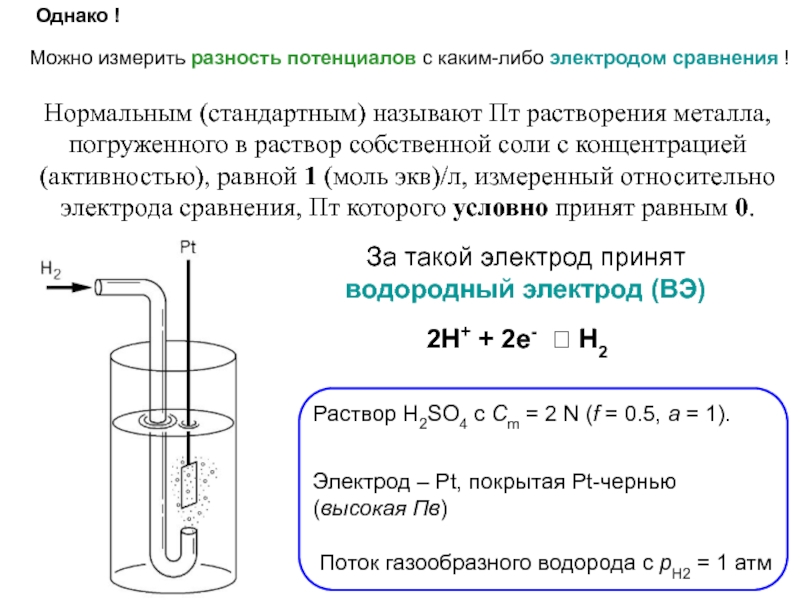
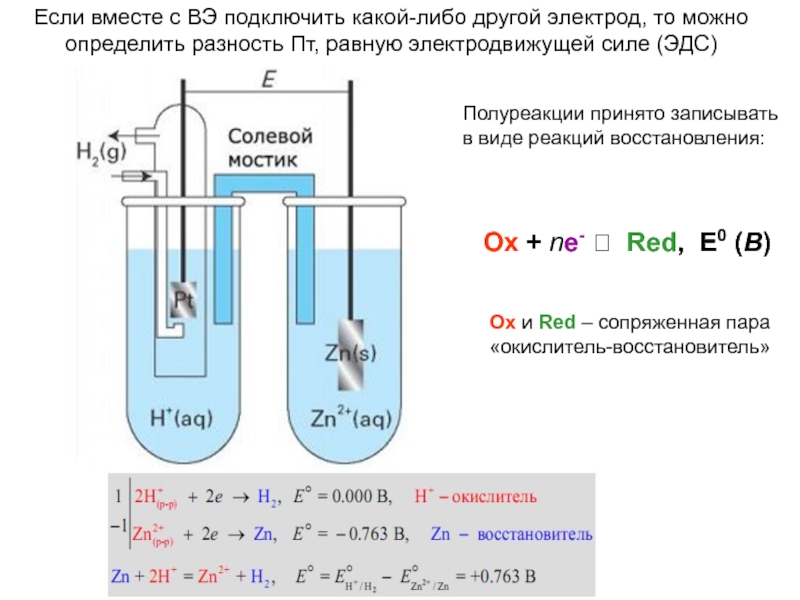
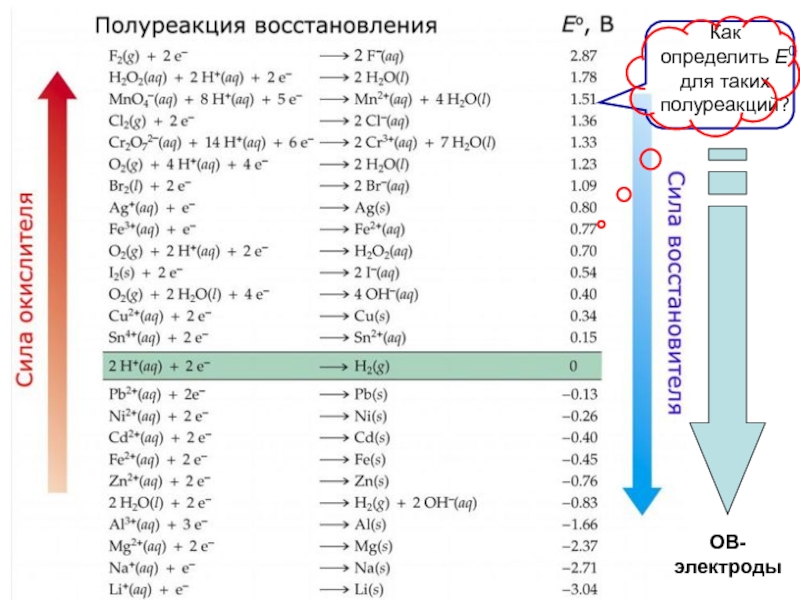
это условный заряд, который приписывается его атому в предположении, что
вещество состоит из ионов (положительным считается заряд менее ЭО-элемента).В простых веществах каждый из атомов имеет нулевую OS.
В случае соединений с полярными связями значение OS рассчитывается
на основании принципа электронейтральности.
OS элемента в его соединениях:
водорода (+1), исключение: гидриды (-1);
кислорода - (-2), исключение: фториды (OF2, O2F2) и соединения со связью О-О - пероксиды (H2O2), надпероксиды (NaO2), озониды (KO3) и т.п.
Пример: значение OS хлора в HClO4, HCl, серы в Na2S4O6 и азота в NH3
равны соответственно (+7), (-1), (+5/2) и (-3).