Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
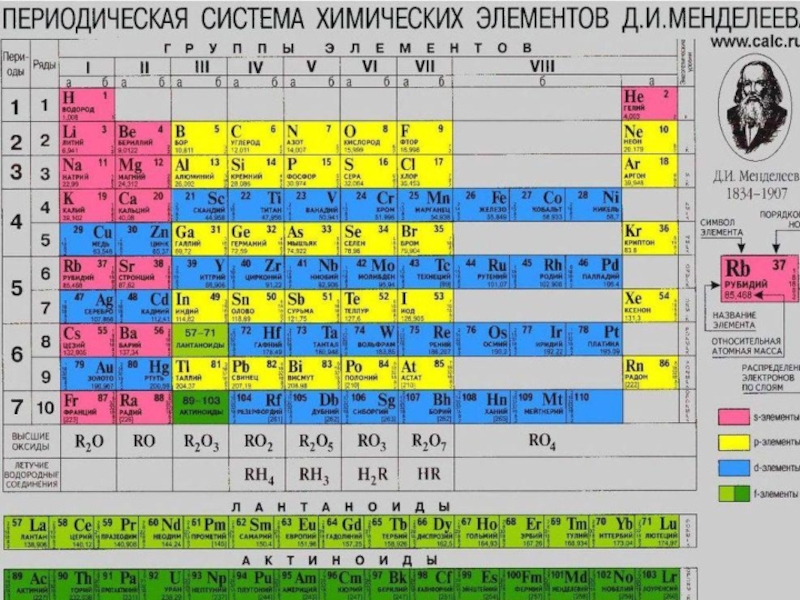
ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И.МЕНДЕЛЕЕВА
Содержание
- 1. ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И.МЕНДЕЛЕЕВА
- 2. Модель строения атома Дж. ТомсонаВ 1904 г.
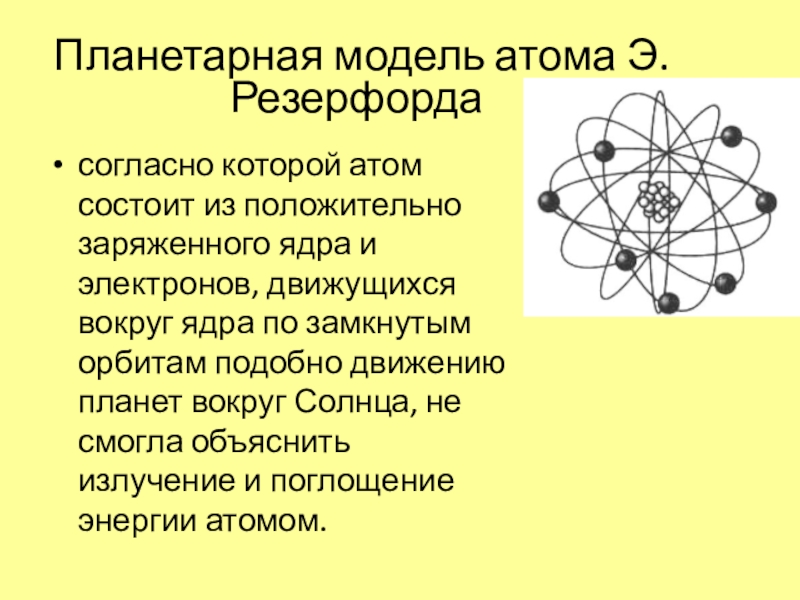
- 3. Планетарная модель атома Э. Резерфорда согласно которой
- 4. Слайд 4
- 5. Свойства простых тел, а также формы и
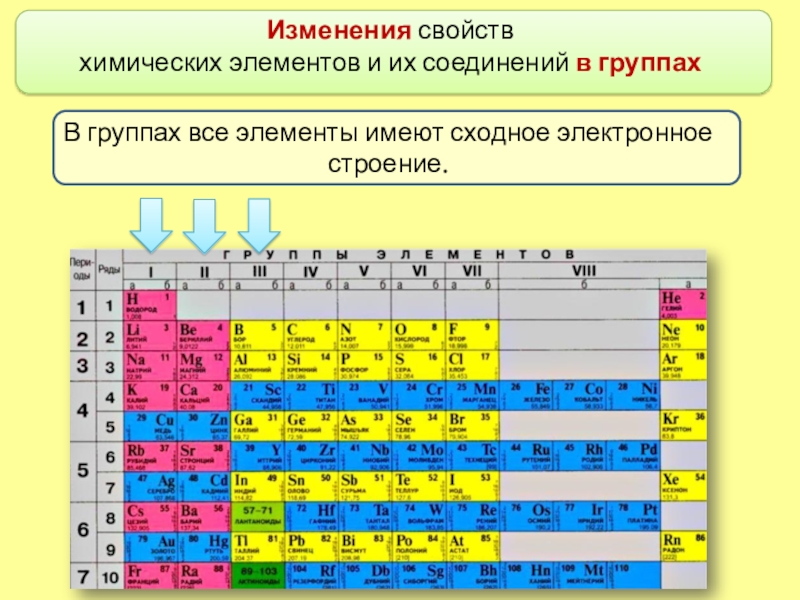
- 6. Изменения свойств химических элементов и их соединений в группахВ группах все элементы имеют сходное электронное строение.
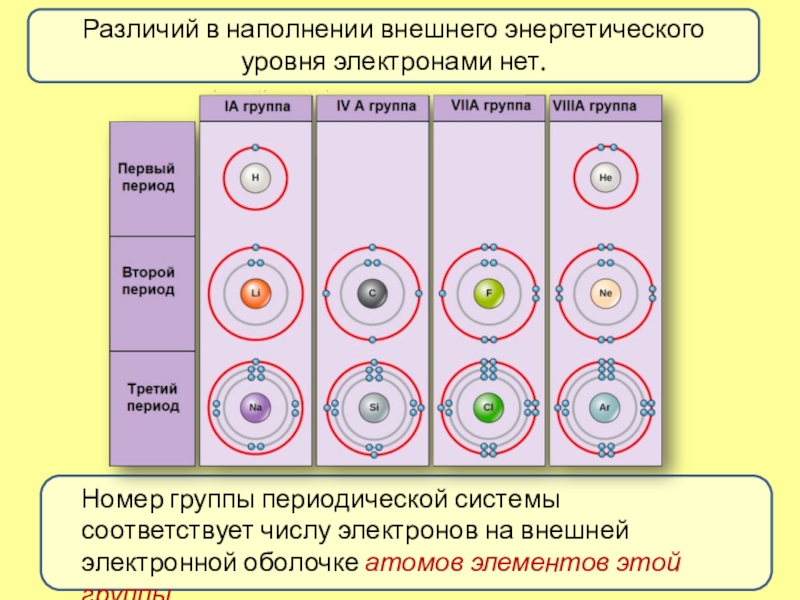
- 7. Различий в наполнении внешнего энергетического уровня электронами
- 8. Меняется размер атома - сверху вниз в группе радиусы
- 9. в группе сверху вниз:усиливаются основные свойства их соединенийвнешние электроны
- 10. Изменения свойств химических элементов и их соединений в периодах
- 11. Номер периода (горизонтального ряда периодической таблицы) совпадает с номером высшей занятой электронной орбитали.
- 12. в периоде слева направо другая картина:усиливаются кислотные
- 13. Слайд 13
- 14. С увеличением заряда ядра атомов наблюдается постепенное
- 15. Zn Cr Al Sn Pb Mn Fe
- 16. В ряду Li → Ве → В
- 17. 2. Усиление металлических свойств элементов представлено в
- 18. 3. Электронную конфигурацию 1s(2)2s(2)2р(6)3s(2)Зр(6)4S(0) имеет ионА Ca(0)Б Al(3+)В Cs(+)Г K(+)
- 19. 4. В каком ряду кислотность соединений возрастаетА
- 20. 5. Как изменяются кислотные свойства оксидов хрома
- 21. 6. Даны элементы: F, O, N, Cl.
- 22. 7. Наиболее выражены металлические свойства у:А фософраБ азотаВ рубидияГ водорода
- 23. 8. Только амфотерные оксиды указаны в ряду:А
- 24. 9. Выберите правильное утверждение: А - в
- 25. 10. Соединения элемента с порядковым номером 20А
- 26. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И.МЕНДЕЛЕЕВА В СВЕТЕ
УЧЕНИЯ О СТРОЕНИИ АТОМА
Слайд 2Модель строения атома Дж. Томсона
В 1904 г. в работе «О
структуре атома» Дж.Томсон дал описание своей модели, получившей образное название
модели «пудинга с изюмом».Согласно этой модели атом подобен сферическому пудингу (или булочке с изюмом) с положительным зарядом. Внутрь сферы (пудинга) вкраплены отрицательно заряженные «изюмины» — электроны.
Электроны совершают колебательные движения, благодаря которым атом излучает электромагнитную энергию. В целом атом электронейтрален
Слайд 3Планетарная модель атома Э. Резерфорда
согласно которой атом состоит из
положительно заряженного ядра и электронов, движущихся вокруг ядра по замкнутым
орбитам подобно движению планет вокруг Солнца, не смогла объяснить излучение и поглощение энергии атомом.Слайд 5Свойства простых тел, а также формы и свойства соединений элементов
находятся в периодической зависимости от величин атомных весов элементов (от
их относительных атомных масс).Слайд 6Изменения свойств
химических элементов и их соединений в группах
В группах все элементы
имеют сходное электронное строение.
Слайд 7Различий в наполнении внешнего энергетического уровня электронами нет.
Номер группы периодической
системы соответствует числу электронов на внешней электронной оболочке атомов элементов
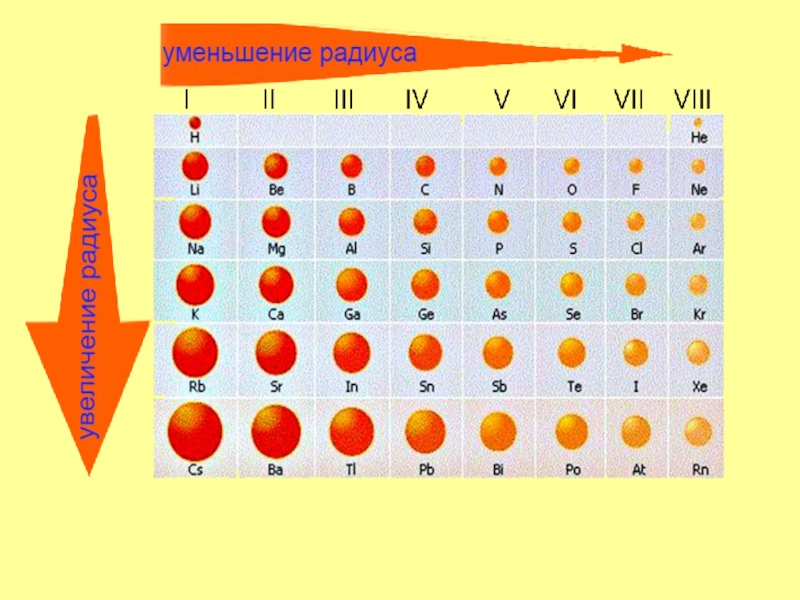
этой группыСлайд 8Меняется размер атома - сверху вниз в группе радиусы атомов увеличиваются!
Периодический закон Д.
И. Менделеева:
«свойства химических элементов; а также формы и свойства
образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов»это означает:
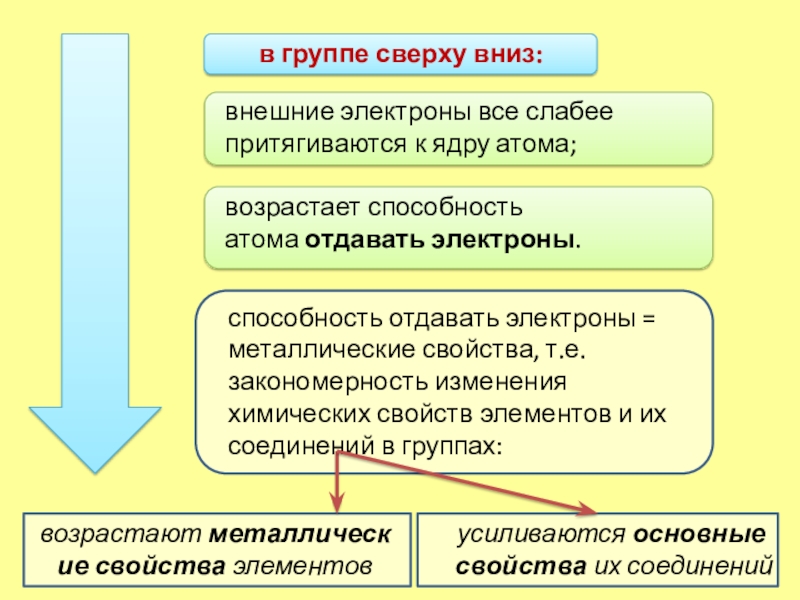
Слайд 9в группе сверху вниз:
усиливаются основные свойства их соединений
внешние электроны все слабее притягиваются
к ядру атома;
возрастает способность атома отдавать электроны.
способность отдавать электроны = металлические
свойства, т.е.закономерность изменения химических свойств элементов и их соединений в группах:
возрастают металлические свойства элементов
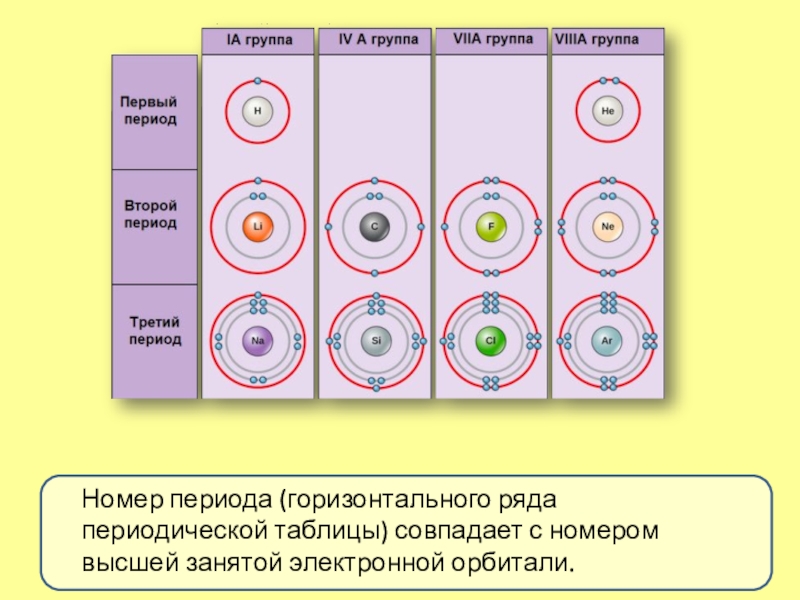
Слайд 11Номер периода (горизонтального ряда периодической таблицы) совпадает с номером высшей
занятой электронной орбитали.
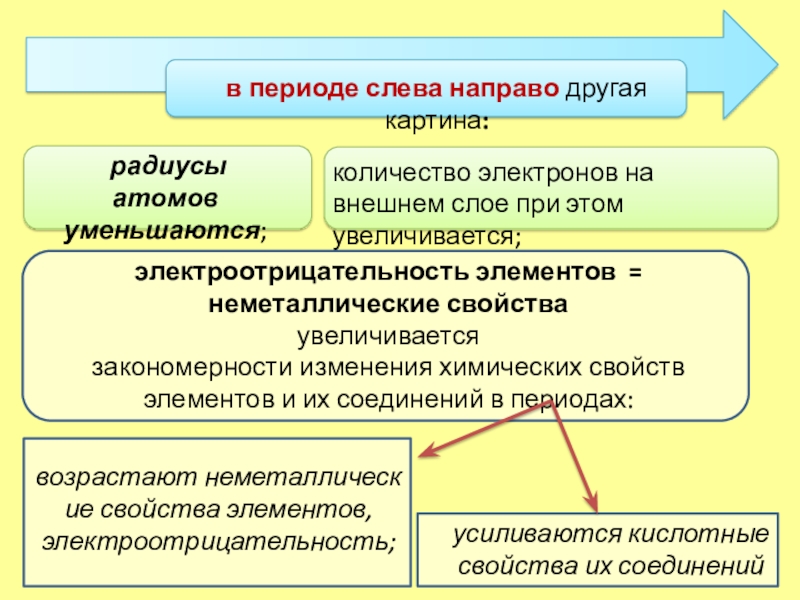
Слайд 12в периоде слева направо другая картина:
усиливаются кислотные свойства их соединений
радиусы
атомов
уменьшаются;
количество электронов на внешнем слое при этом увеличивается;
электроотрицательность элементов
= неметаллические свойства
увеличивается
закономерности изменения химических свойств элементов и их соединений в периодах:
возрастают неметаллические свойства элементов, электроотрицательность;
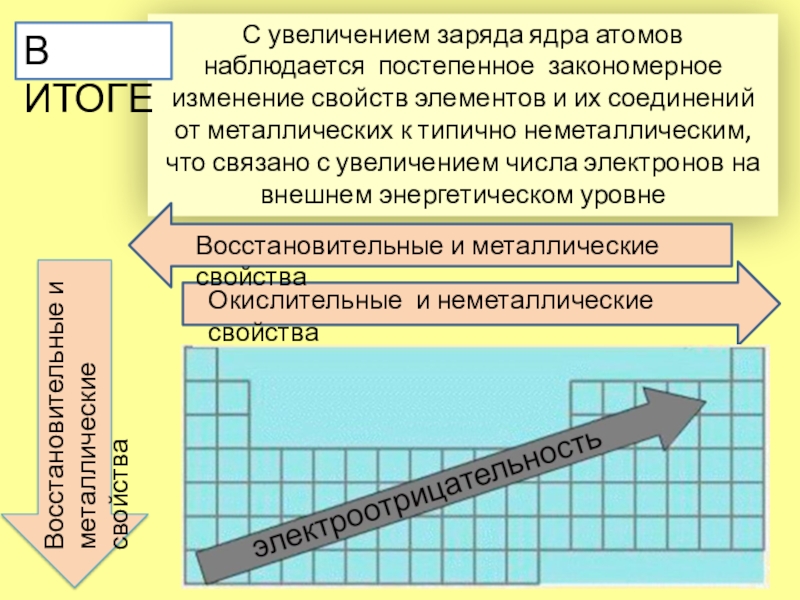
Слайд 14С увеличением заряда ядра атомов наблюдается постепенное закономерное изменение свойств
элементов и их соединений от металлических к типично неметаллическим,
что
связано с увеличением числа электронов на внешнем энергетическом уровнеВ ИТОГЕ
Восстановительные и металлические свойства
Окислительные и неметаллические свойства
Восстановительные и
металлические свойства
Слайд 15
Zn Cr Al Sn Pb
Mn Fe Be
Есть еще элементы,
которые образуют так называемые амфотерные соединения.
Они проявляют как металлические, так
и неметаллические свойства.Слайд 16В ряду Li → Ве → В → С
А усиливаются
восстановительные свойства простых веществ
Б усиливается основность соединений
В усиливаются кислотные свойства
соединенийГ кислотные свойства элементов ослабевают
Тест
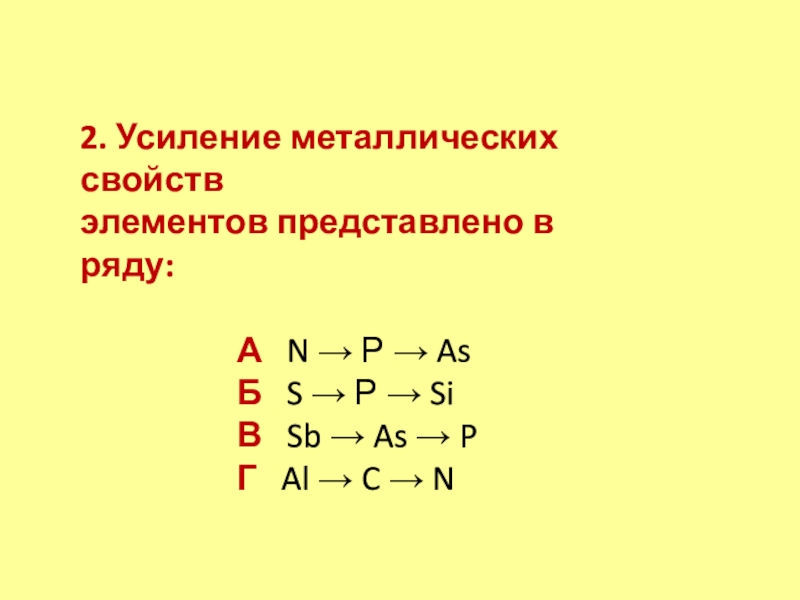
Слайд 172. Усиление металлических свойств
элементов представлено в ряду:
А N
→ Р → As
Б S → Р → Si
В
Sb → As → PГ Al → C → N
Слайд 183. Электронную конфигурацию
1s(2)2s(2)2р(6)3s(2)Зр(6)4S(0) имеет ион
А Ca(0)
Б Al(3+)
В
Cs(+)
Г K(+)
Слайд 194. В каком ряду кислотность
соединений возрастает
А Cr(0), Cr(3+),
Cr(+6)
Б Mn(+6), Mn(+4), Mn(+2)
В Cl(+7), Cl(+3), Cl(+1)
Г S(+6),
S(+4), S(0)Слайд 205. Как изменяются кислотные свойства
оксидов хрома в ряду: CrO
- Cr2O3 - CrO3
А основной - кислотный - амфотерный
Б
основной - амфотерный - кислотныйВ все основные
Г все несолеобразующие
Слайд 216. Даны элементы: F, O, N, Cl.
Какие утверждения верны?
А
в заданном ряду элементов электроотрицательность уменьшается
Б основные свойства
оксидов этих элементов ослабевают, а кислотные усиливаютсяВ неметаллические свойства простых веществ усиливаются
Г степень окисления атомов в высших оксидах одинакова
Слайд 238. Только амфотерные оксиды указаны в ряду:
А Na2O, ZnO,
CuO
Б ZnO, Al2O3, Cr2O3
В Al2O3, FeO, SO3
Г
CO2, CO, N2O5Слайд 249. Выберите правильное утверждение:
А - в ряду элементов: Na
– Si – Cl неметалличность простых веществ, образуемых этими элементами,
усиливаетсяB - в этом ряду степени окисления атомов в соединениях с кислородом увеличиваются
А утверждение А верно
Б верное утверждение - B
В оба утверждения верны
Г оба неверны
Слайд 2510. Соединения элемента
с порядковым номером 20
А простое вещество
проявляет металлические свойства
Б оксид элемента — кислотный
В при
взаимодействии с водой оксид элемента образует кислотуГ в соединениях проявляет отрицательную степень окисления