Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Полезный задачник по химии Авторы: 9 класс Кузнецов Арсений, Шумилин Артём,
Содержание
- 1. Полезный задачник по химии Авторы: 9 класс Кузнецов Арсений, Шумилин Артём,
- 2. Проблема. Предлагаемые в учебнике задачи сухие, не
- 3. Этапы реализации с содержанием деятельности. Этап
- 4. Ожидаемый результат: Создание задачника. Критерии результативности: Информативность, расширяющая кругозор.
- 5. Методы отслеживания результативности:Сбор отзывов от учащихся, которые
- 6. Оглавление задачника Вычисления массовой доли элементов. Вычисления массовой
- 7. Примеры задач, которые будут в нашем задачнике
- 8. Вычисления массовой доли элементов. Всё сельское хозяйство
- 9. Для этого воспользуемся формулой нахождения массовой доли элемента:
- 10. Соединения калия – важнейший биогенный элемент, и
- 11. Для этого нам нужно вычислить процентное содержание
- 12. Фосфор – удивительно полезный для растений элемент.
- 13. Для этого мы используем формулу массовой доли
- 14. Вычисления массовой доли вещества в растворе. Одно
- 15. Воспользуемся формулой нахождения массы вещества при помощи массовой доли:
- 16. Рассчитайте массу марганцовки и воды, требующиеся
- 17. Воспользуемся формулой нахождения массы вещества при помощи массовой доли:
- 18.
- 19. Расчет по термохимическим реакциямЗадача 1Найдите количество вещества,
- 20. Дано: Pешение:m(С2Н2)=14г Составим уравнение Найти:
- 21. Задача 2Найдите количество теплоты при горении
- 22. Дано: Решение:m(P)=93г 3
- 23. Вычисления доли выхода продукта реакции от теоретически
- 24. Дано: Решение:m(NH4NO3)=200г
- 25. Задача 2При взаимодействии 36г водорода с азотом
- 26. Дано:
- 27. Нахождение массовой доли выхода продуктаАммиа́к (нитрид водорода)
- 28. Для решения задачи воспользуемся формулой нахождения массовой
- 29. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Проблема.
Предлагаемые в учебнике задачи сухие, не интересные, не
связанные
с жизнью.
Цель.
Показать роль химии в жизни человека.
Задачи.
Найти интересный материал, который можно использовать для
составления задач для 8 и 9 классов. А также привлечение материала по
другим дисциплинам.
Слайд 3Этапы реализации с содержанием деятельности.
Этап 1
Обучение умению создавать задачи.
Изучение
отношения старшеклассников к задачам по химии и их решению.
Этап
2
Создание задач в групповой работе.
Поиск интересного практического материала для составления задач. Этап 3 Создание проекта сборника задач. Оформление издания.
Слайд 4
Ожидаемый результат:
Создание задачника.
Критерии результативности:
Информативность, расширяющая кругозор.
Слайд 5
Методы отслеживания результативности:
Сбор отзывов от учащихся, которые решали придуманные задачи.
Форма
презентации и отчётности:
Применение задач на уроках.
Материальные ресурсы:
Печать, издание.
Слайд 6Оглавление задачника
Вычисления массовой доли элементов.
Вычисления массовой доли вещества в растворе.
Задачи
на примеси.
Расчёты по уравнениям.
Расчёты по термохимическим уравнениям.
Вычисления доли выхода продукта
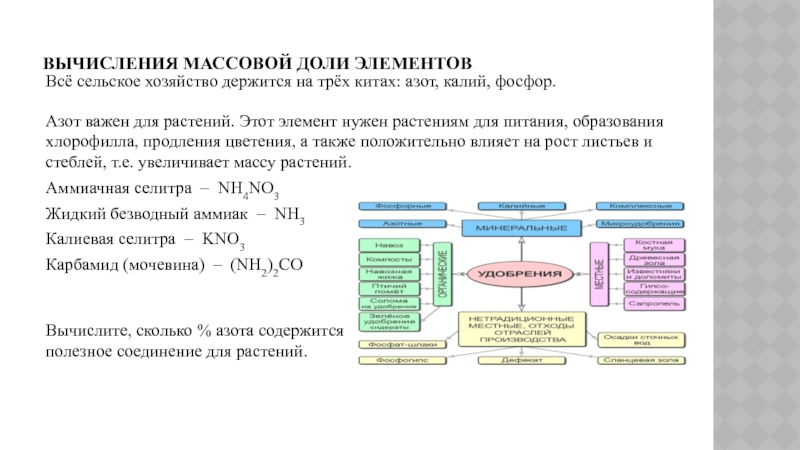
реакции от теоретически возможного. Слайд 8Вычисления массовой доли элементов.
Всё сельское хозяйство держится на трёх китах:
азот, калий, фосфор.
Азот важен для растений. Этот элемент нужен растениям
для питания, образования хлорофилла, продления цветения, а также положительно влияет на рост листьев и стеблей, т.е. увеличивает массу растений.Аммиачная селитра – NH4NO3
Жидкий безводный аммиак – NH3
Калиевая селитра – KNO3
Карбамид (мочевина) – (NH2)2CO
Вычислите, сколько % азота содержится в каждом удобрении и определите самое полезное соединение для растений.
Слайд 10Соединения калия – важнейший биогенный элемент, и потому применяется в
качестве удобрений.
Калий крайне полезен в сельском хозяйстве: он повышает морозостойкость
и устойчивость растений к различным заболеваниям, способствует накоплению углеводов в клетках растений, повышает содержание сахаров в корнеплодах. Его наличие способствует сохранению структур мембран хлоропластов растений, в которых происходит фотосинтез.Мы решили выяснить, какое удобрение больше всего подходит для растений:
∙ Хлористый калий – KCl
∙ Сульфат калия –
∙ Поташ -
∙ Сильвинит – KCl x NaCl
Слайд 11Для этого нам нужно вычислить процентное содержание калия в каждом
удобрении по формуле:
После вычислений мы пришли к выводу,
что именно поташ является самым выгодным по содержанию калия удобрением.
Слайд 12Фосфор – удивительно полезный для растений элемент. Он ускоряет развитие
организма, стимулирует цветение и плодоношение, благоприятствует интенсивному росту корневой системы
Какое из ниже перечисленных фосфорных удобрений содержит больше этого элемента в процентном содержании?
Двойной суперфосфат -
Простой суперфосфат –
Преципитат –
Фосфоритная мука -
Слайд 13Для этого мы используем формулу массовой доли элемента в веществе:
Из этих расчётов мы получаем, что двойной суперфосфат -
наиболее выгодное для растений фосфорное удобрение.
Слайд 14Вычисления массовой доли вещества в растворе.
Одно из распространённых средств
лечения при нервной истощённости, повышенной возбудимости, аллергии – это теплые
водно-солевые ванны, содержащие 1-3% хлорида натрия.Рассчитайте, сколько воды и поваренной соли NaCl нужно взять, чтобы приготовить 200 кг 2% раствора
Слайд 16
Рассчитайте массу марганцовки и воды, требующиеся для приготовления
50 г 0,4% раствора;
1000 г 0,1% раствора
Слайд 19Расчет по термохимическим реакциям
Задача 1
Найдите количество вещества, выделившееся при горении
13г ацетилена
Получение и Применение ацетилена:
Ацетилен — органическое соединение, непредельный
углеводород C2H2. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов. При нормальных условиях — бесцветный, очень горючий газВ лаборатории, а также в газосварочном оборудовании, ацетилен получают действием воды на карбид кальция. (Ф. Вёлер, 1862 год)
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C
Слайд 20Дано: Pешение:
m(С2Н2)=14г Составим уравнение
Найти: 0,05
моль
X КджQ=? 2C2H2 + 5O2 = 4CO2 +2H2O +2610 кДж
2 моль 1 моль
1) n(C2H2)=m:M=13:26=0,5 (моль)
2) 0,5:2-X:2610
2X - 0,5 x 2610
X=1305:2=652,5 кДж
Ответ: Q=652,5 кДж
Слайд 21 Задача 2
Найдите количество теплоты при горении 93 г фосфора,
если выделится 3010 кДж
Получение и Применение фосфора :
Существует несколько видов
фосфора: красный, белый, желтый, черный, металлический, Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре около 1600 °С
Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности. Красный фосфор применяют в производстве спичек. Его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробки. При трении спичечной головки, в состав которой входят хлорат калия и сера, происходит воспламенение.
Слайд 22Дано: Решение:
m(P)=93г 3 моль
X моль
Найти: 4P + 5O2 = 2P2O5 + 3010 кДж
Q=? 4 моль
1) n=m:M=93:31=3 (моль)
3:4=X:3010:
4X=3 x 3010
X= (2 x 3010):4+2257,5 кДж
Ответ: Q=2257,5 кДж
Слайд 23Вычисления доли выхода продукта реакции от теоретически возможного
Задача 1
В результате
взаимодействия 44,8л оксида азота (IV) с водой и кислородом получили
100г азотной кислоты. Определите выход кислоты (В %) от теоретическогоПолучение и применение азотной кислоты:
Современный способ её производства основан на каталитическом окислении синтетического аммиака на платино-родиевых катализаторах (процесс Оствальда) до смеси оксидов азота (нитрозных газов), с дальнейшим поглощением их водой
в производстве минеральных удобрений;
в военной промышленности (дымящая — в производстве взрывчатых веществ, как окислитель ракетного топлива, разбавленная — в синтезе различных веществ, в том числе отравляющих);
Слайд 24Дано: Решение:
m(NH4NO3)=200г Составим уравнение:
m(HNO3)=252г
NH3+HNO3=NH4+NO3
Найти: 1) n=m:M=252:63=4(моль)
Wвыхода=? 2) n=(NHO3)=n(NH4NO3)=4(моль)
3) m=M*n; m(NH4NO3)=80*4=240г
Для последних вычислений воспользуемся формулой
Wвыхода=(mпракт*100%):mтеор
Wвыхода=(300*100):240=83,34%
Ответ: Wвыхода=83,34%
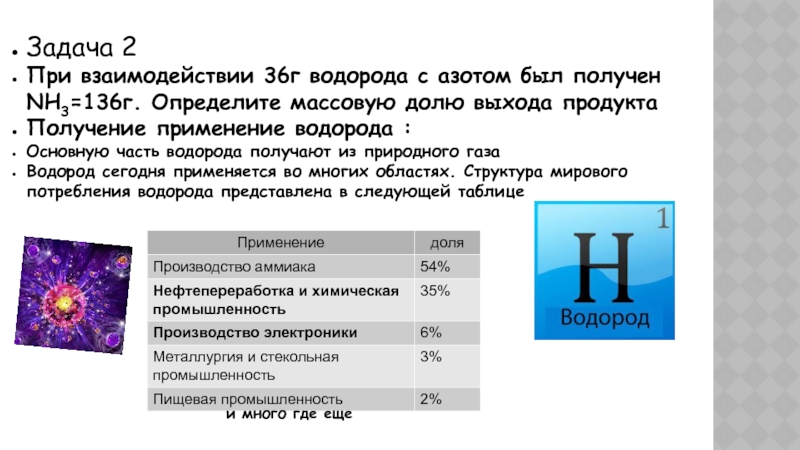
Слайд 25Задача 2
При взаимодействии 36г водорода с азотом был получен NH3=136г.
Определите массовую долю выхода продукта
Получение применение водорода :
Основную часть водорода
получают из природного газаВодород сегодня применяется во многих областях. Структура мирового потребления водорода представлена в следующей таблице
и много где еще
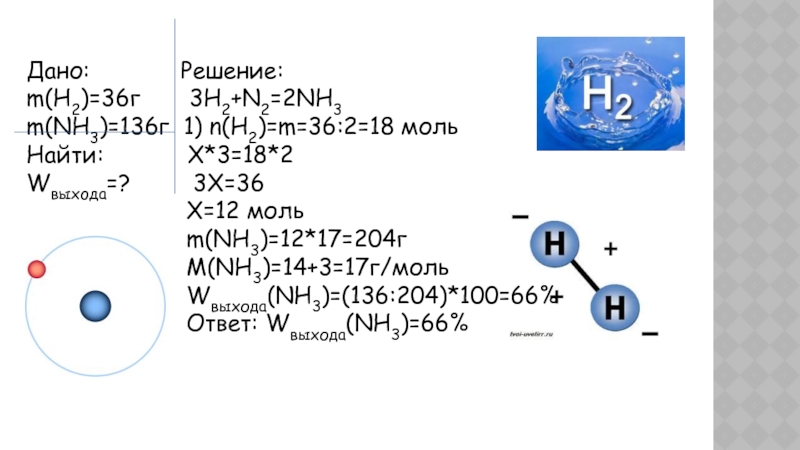
Слайд 26Дано: Решение:
m(H2)=36г
3H2+N2=2NH3
m(NH3)=136г 1) n(H2)=m=36:2=18 моль
Найти:
X*3=18*2Wвыхода=? 3X=36
X=12 моль
m(NH3)=12*17=204г
M(NH3)=14+3=17г/моль
Wвыхода(NH3)=(136:204)*100=66%
Ответ: Wвыхода(NH3)=66%
Слайд 27Нахождение массовой доли выхода продукта
Аммиа́к (нитрид водорода) — химическое cоединение
азота и водорода с формулой NH3, при нормальных условиях —
бесцветный газ с резким характерным запахом.Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство превышает 180 млн тонн.
Жидкий аммиак используют в качестве растворителя, как удобрение и для получения азотных удобрений. В холодильной технике используется в качестве холодильного агента.
Задача 1
При пропускании аммиака (NH3) через 252г азотной кислоты (HNO3), получим 200г нитрата аммония (NH4NO3). Определите массовую долю выхода соли от теоретически возможного.
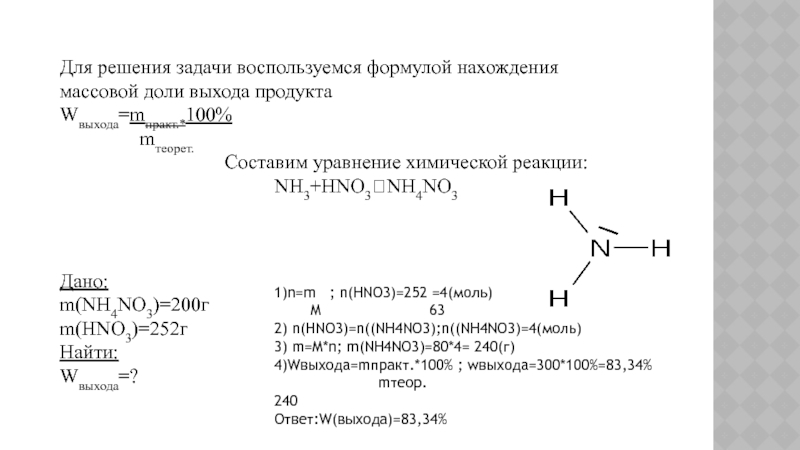
Слайд 28Для решения задачи воспользуемся формулой нахождения массовой доли выхода продукта
Wвыхода=mпракт.*100%
mтеорет.
Составим уравнение химической реакции:NH3+HNO3NH4NO3
Дано:
m(NH4NO3)=200г
m(HNO3)=252г
Найти:
Wвыхода=?
1)n=m ; n(HNO3)=252 =4(моль)
M 63
2) n(HNO3)=n((NH4NO3);n((NH4NO3)=4(моль)
3) m=M*n; m(NH4NO3)=80*4= 240(г)
4)Wвыхода=mпракт.*100% ; wвыхода=300*100%=83,34%
mтеор. 240
Ответ:W(выхода)=83,34%