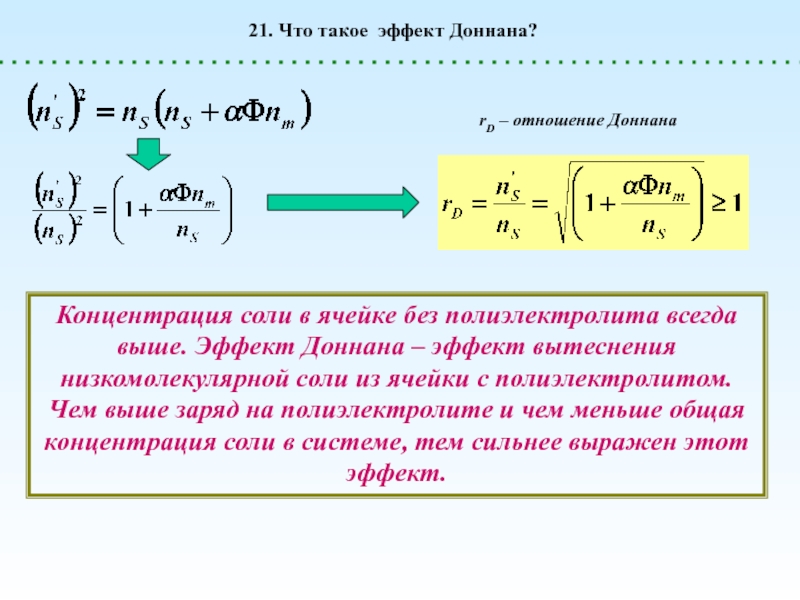
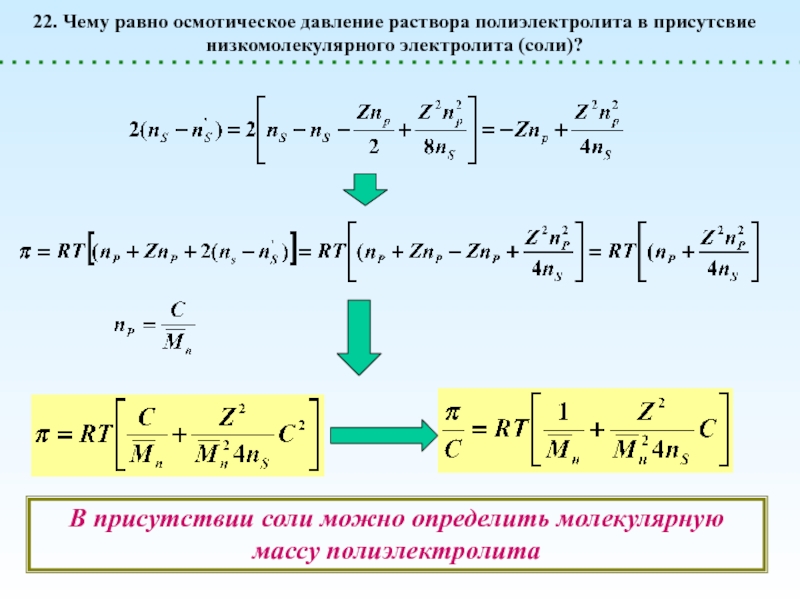
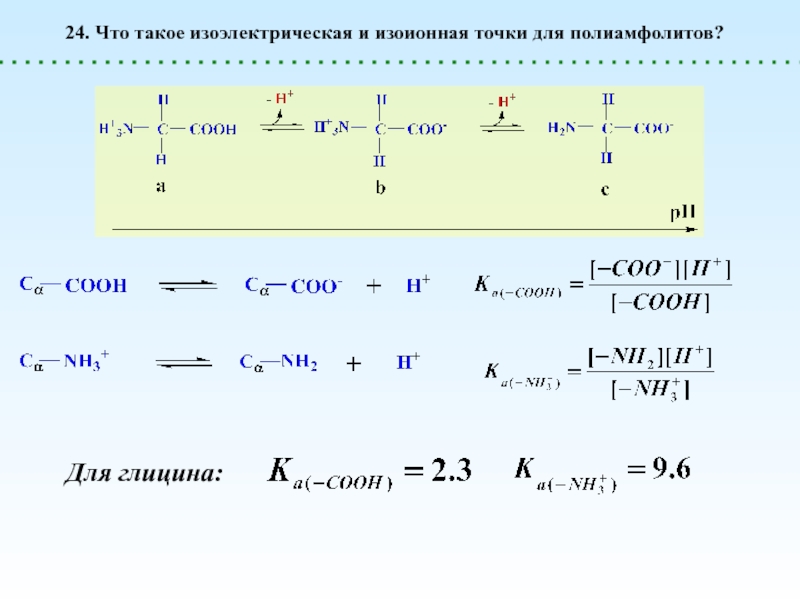
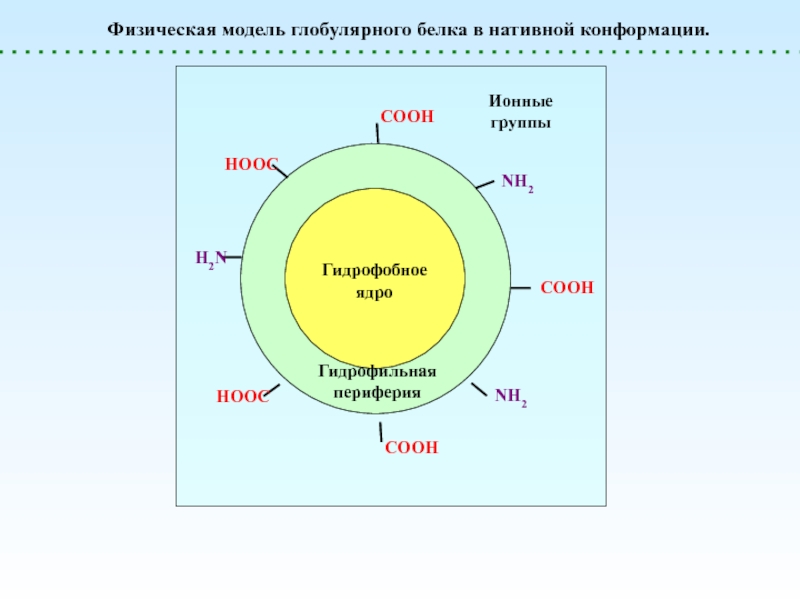
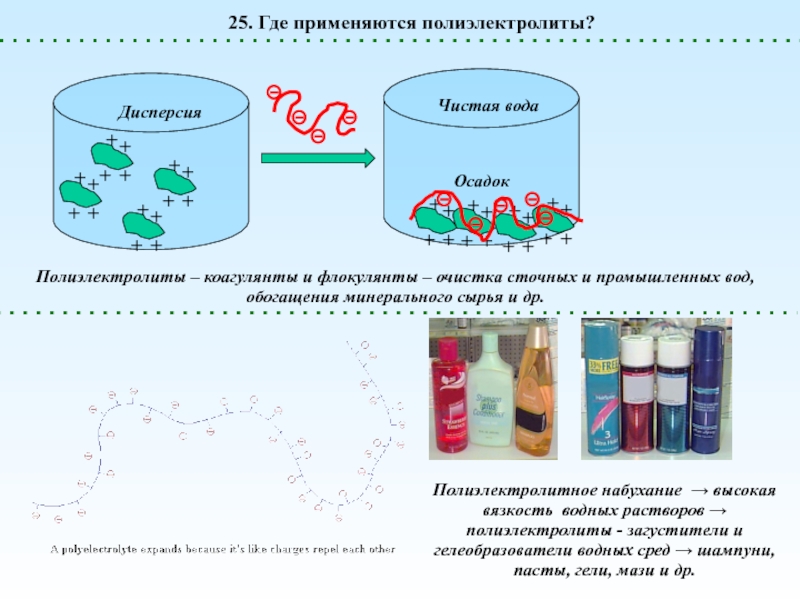
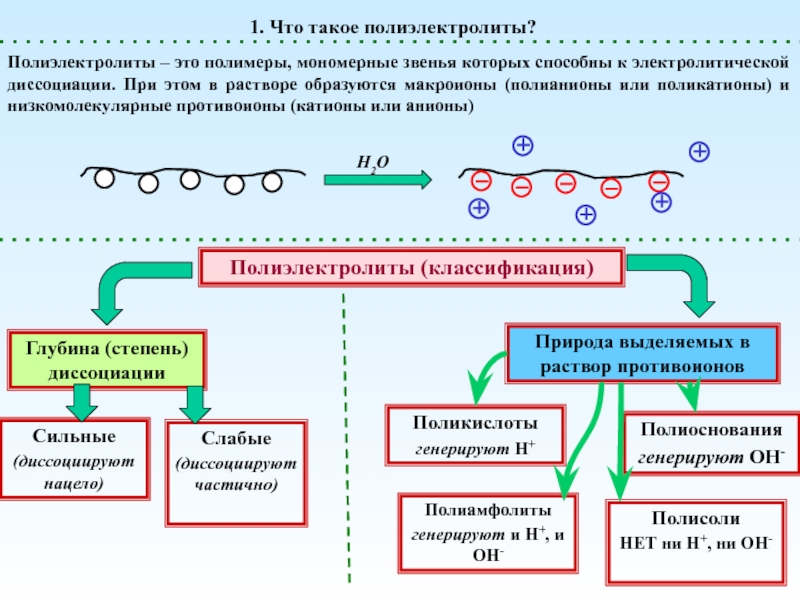
диссоциации. При этом в растворе образуются макроионы (полианионы или поликатионы)
и низкомолекулярные противоионы (катионы или анионы)1. Что такое полиэлектролиты?
H2O
Полиэлектролиты (классификация)
Глубина (степень) диссоциации
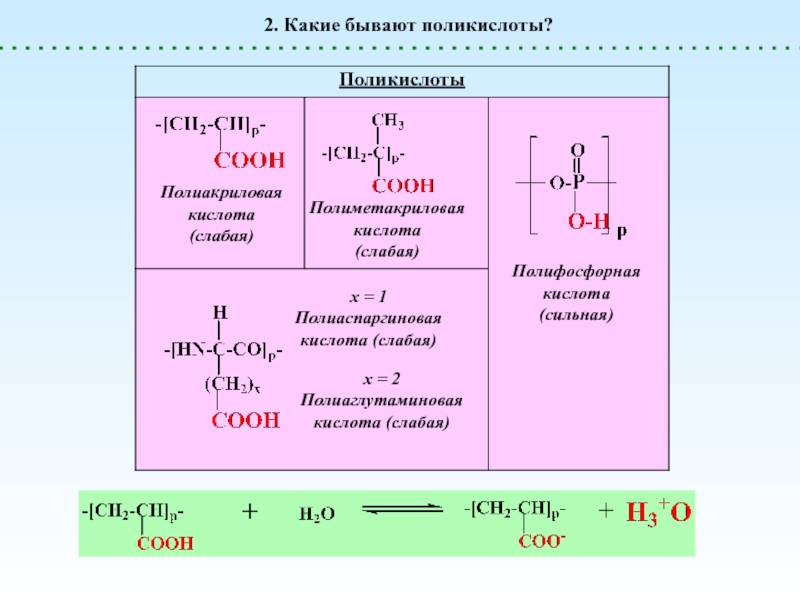
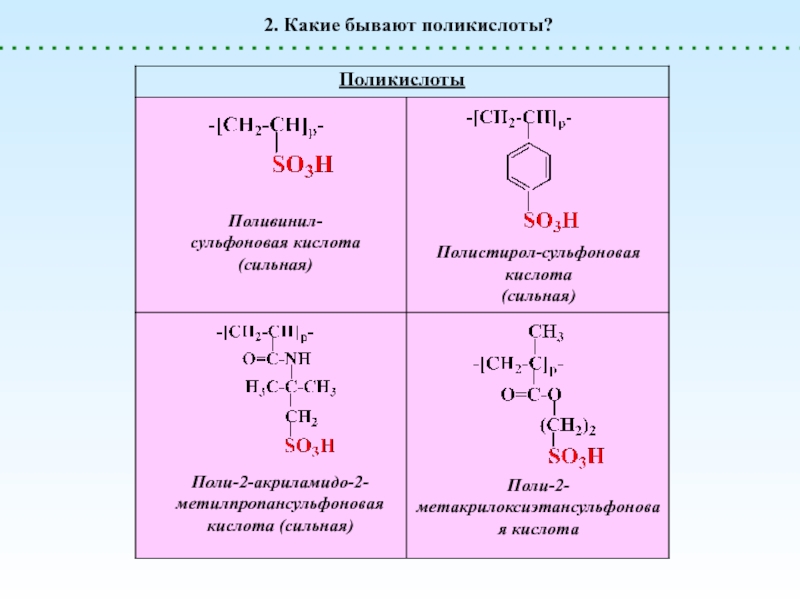
Сильные
(диссоциируют нацело)
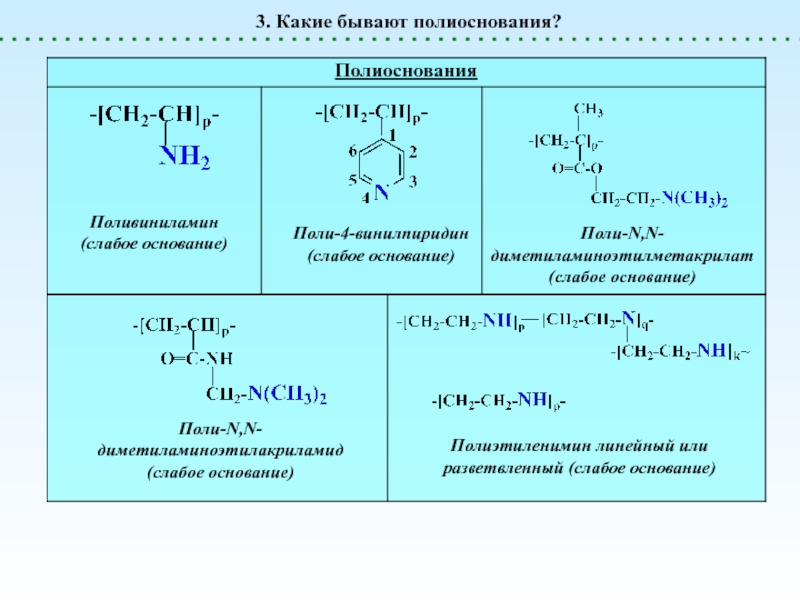
Слабые
(диссоциируют частично)
Природа выделяемых в раствор противоионов
Поликислоты
генерируют H+
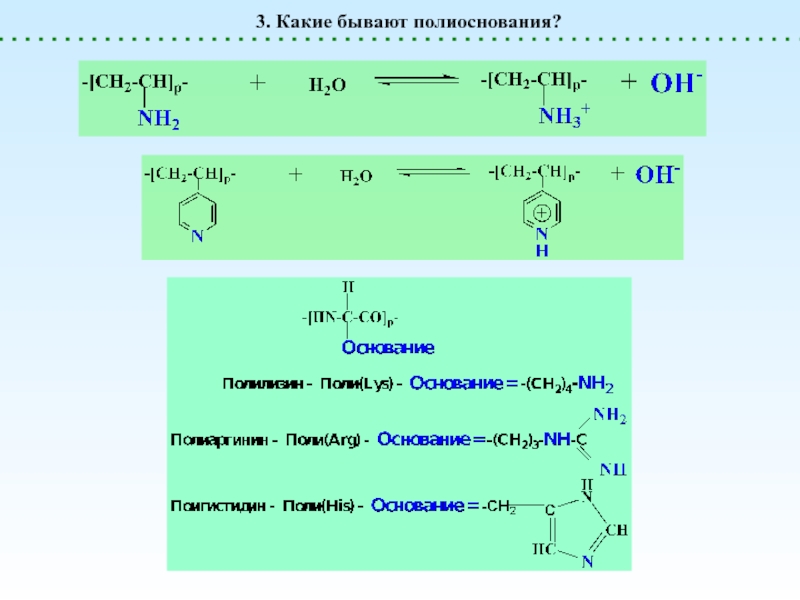
Полиоснования
генерируют OH-
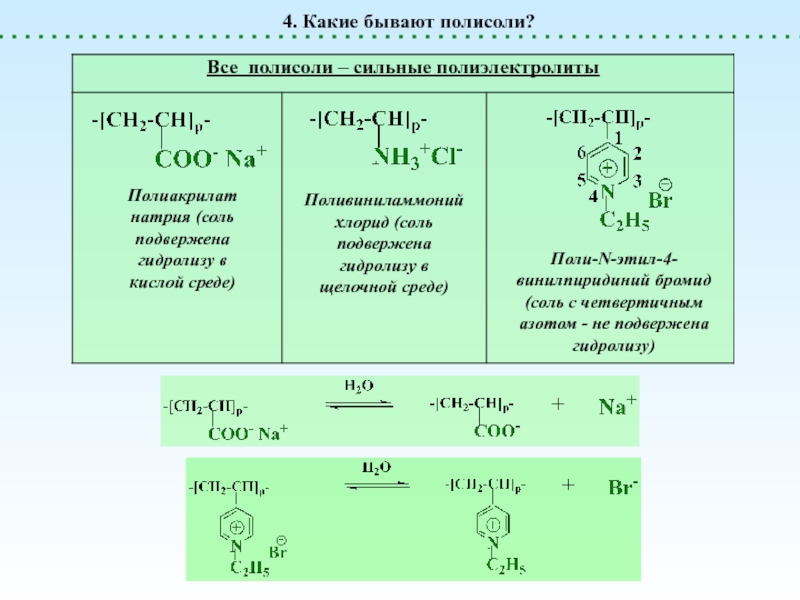
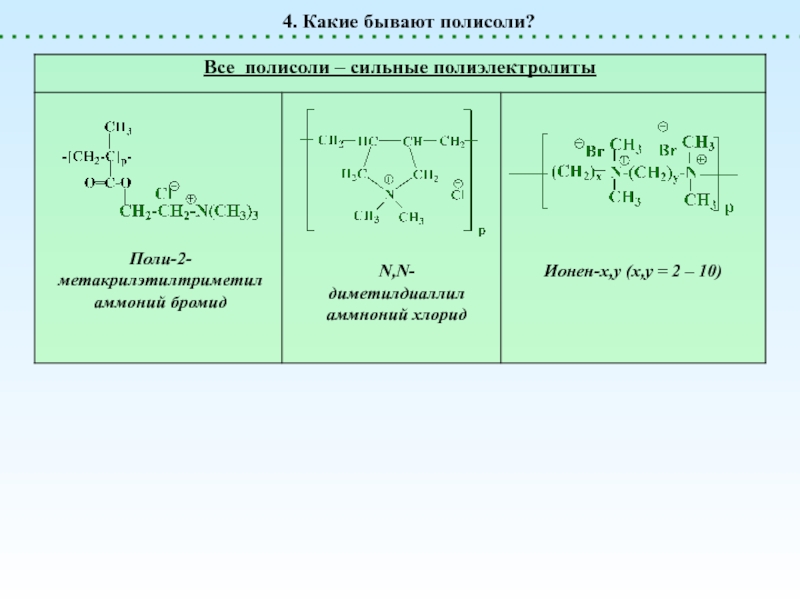
Полисоли
НЕТ ни H+, ни OH-
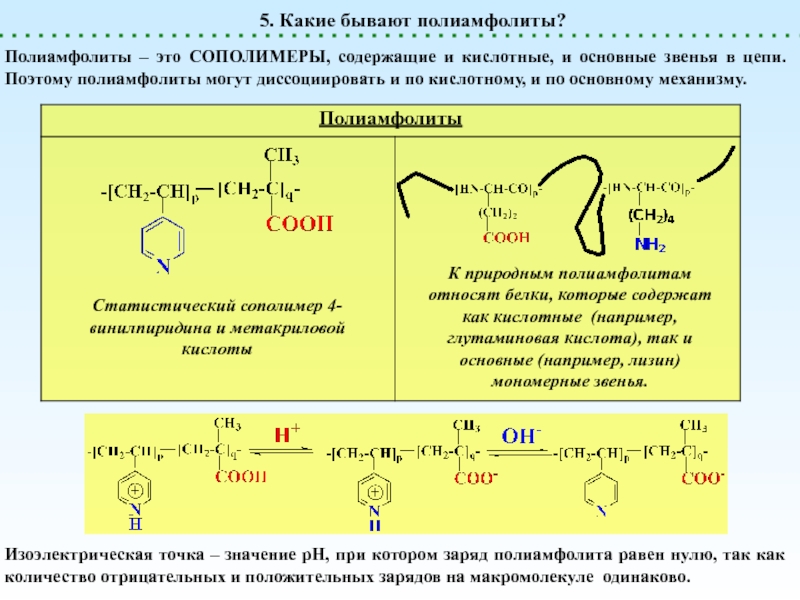
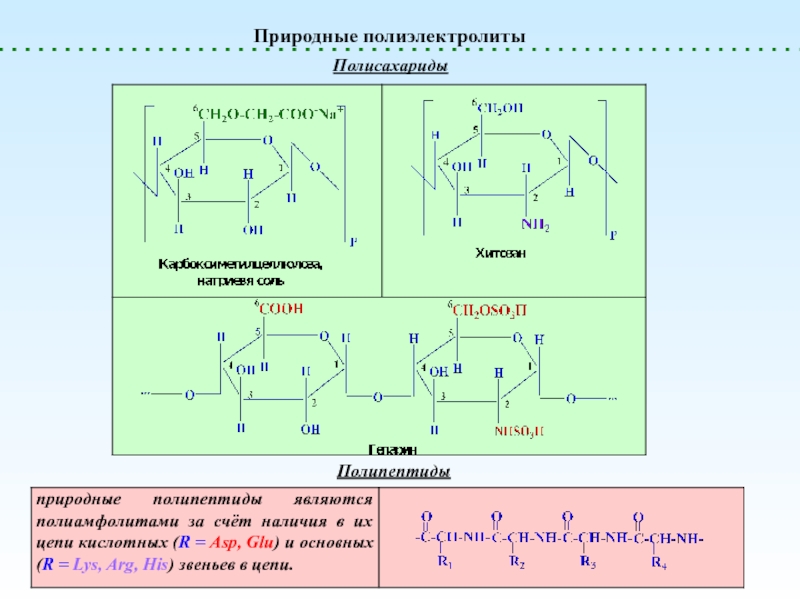
Полиамфолиты
генерируют и H+, и OH-
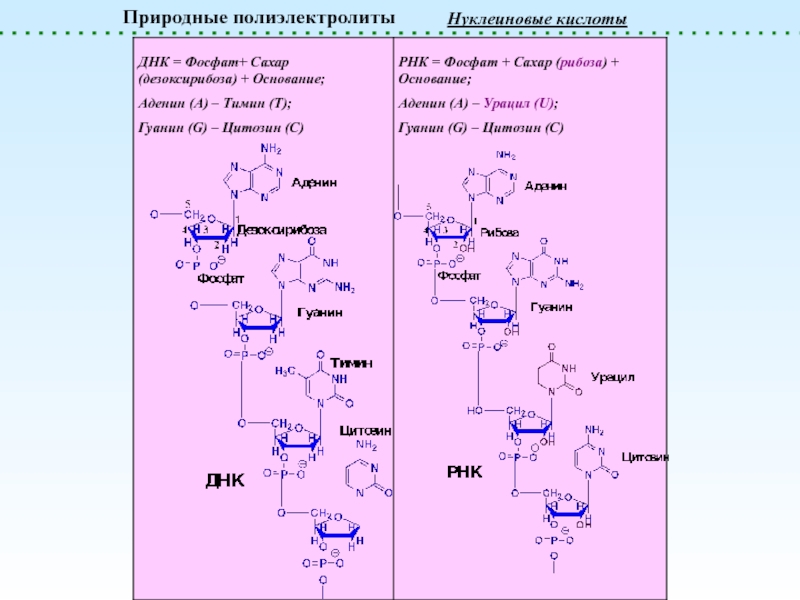
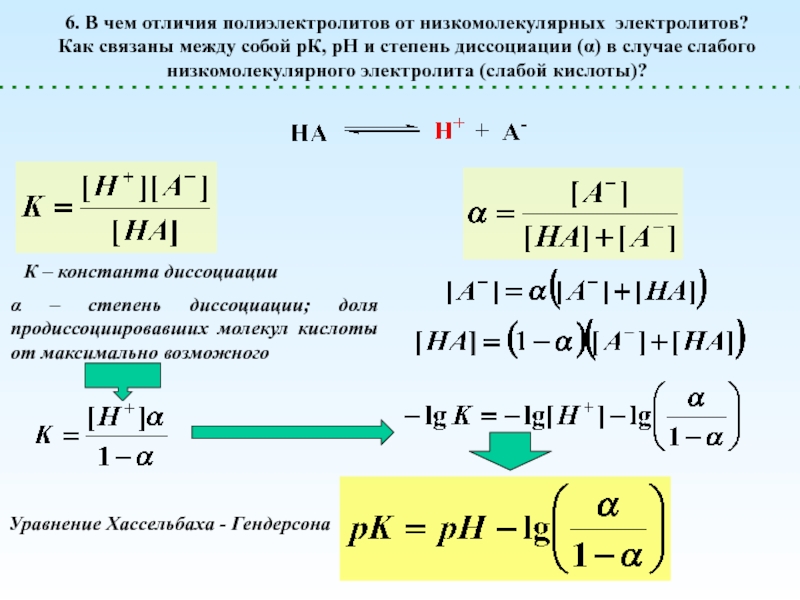
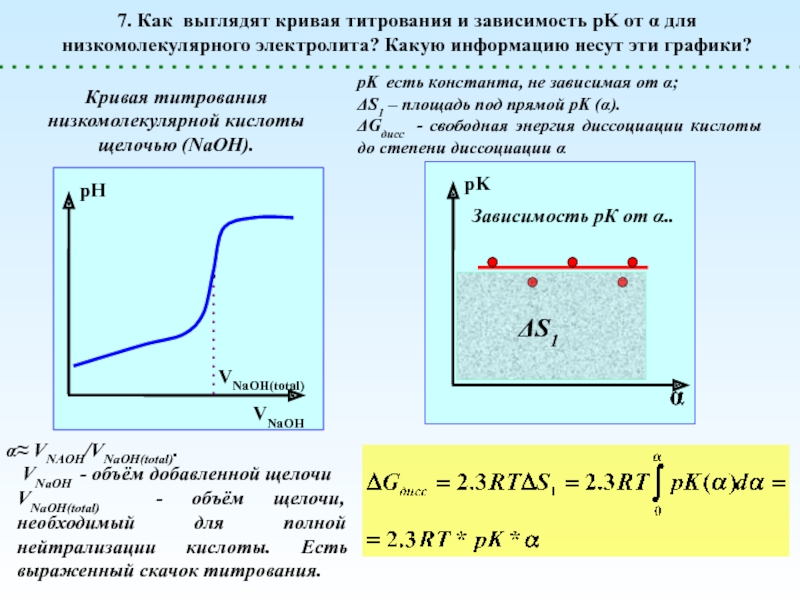
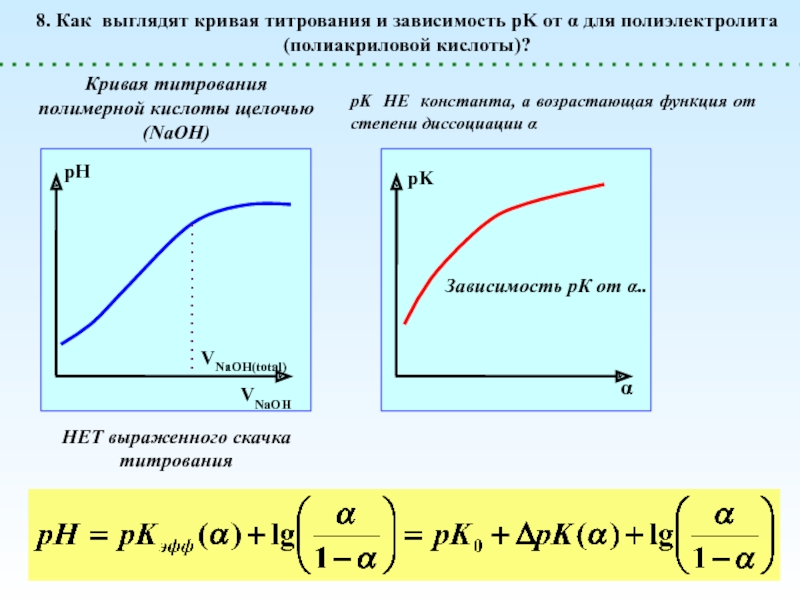
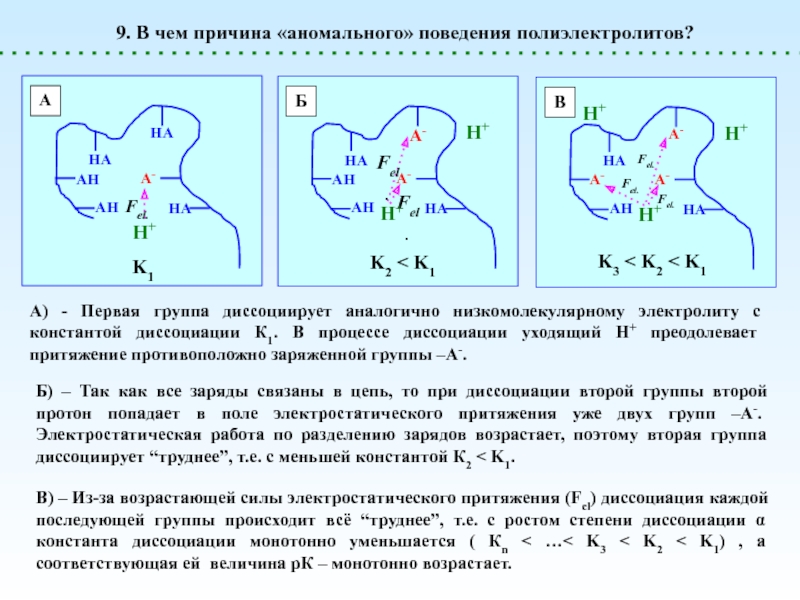
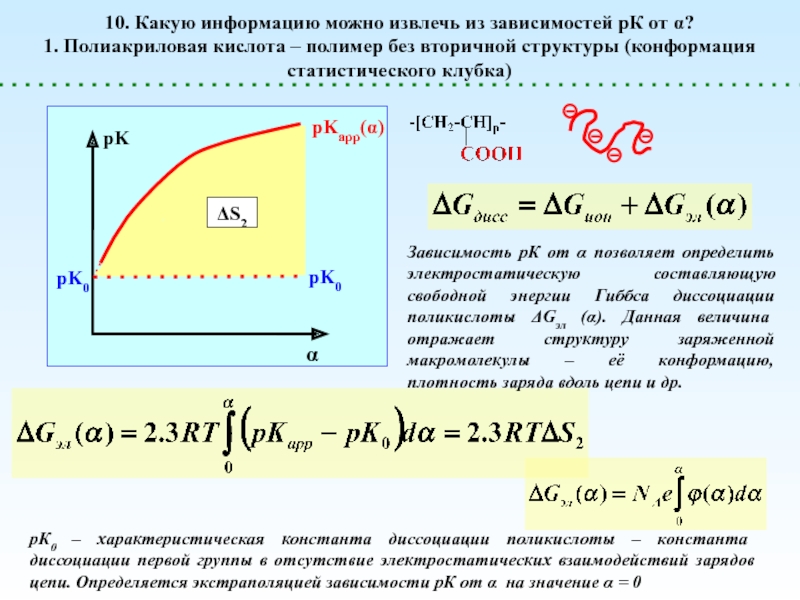
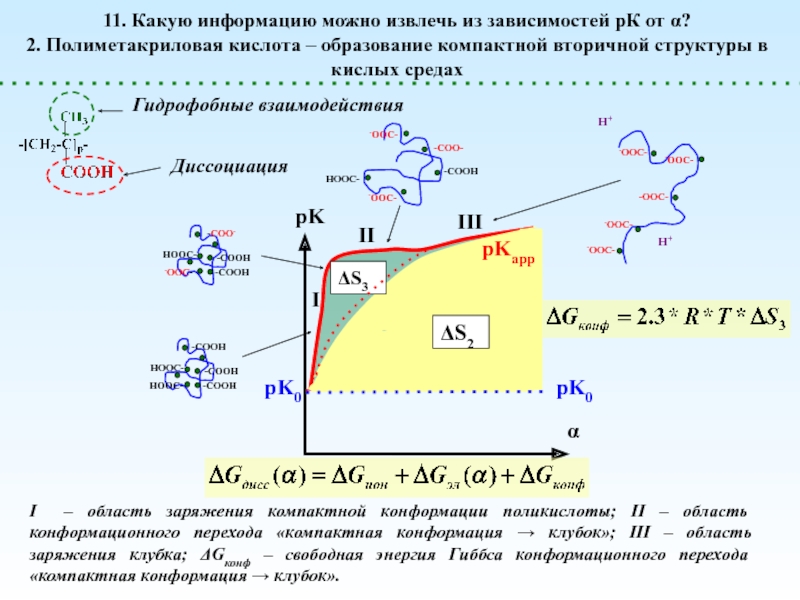
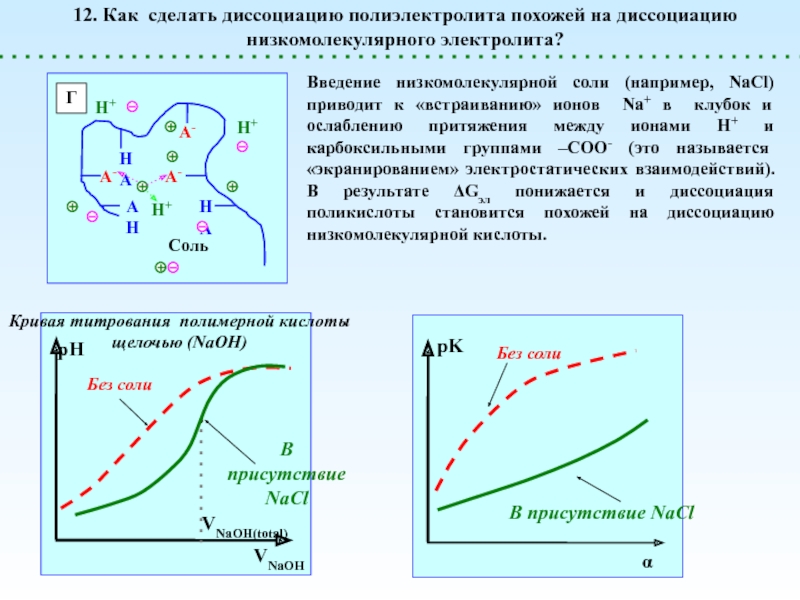
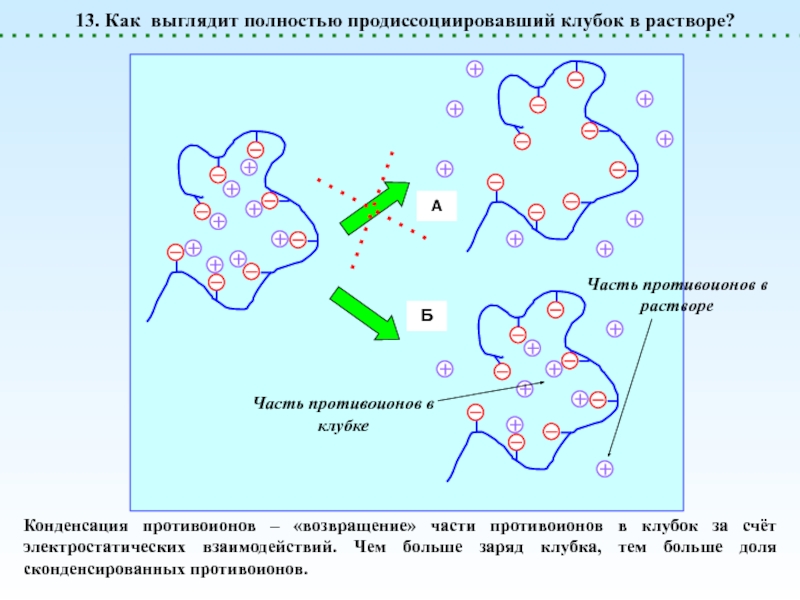
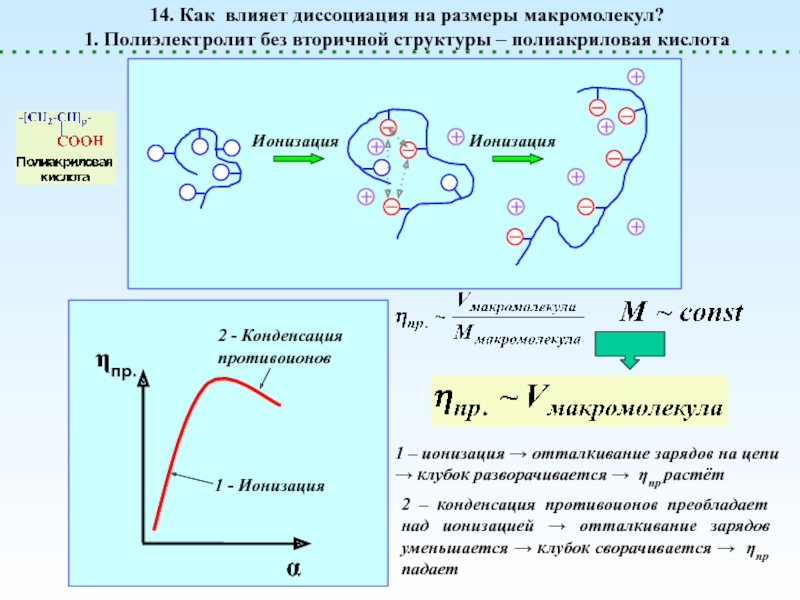
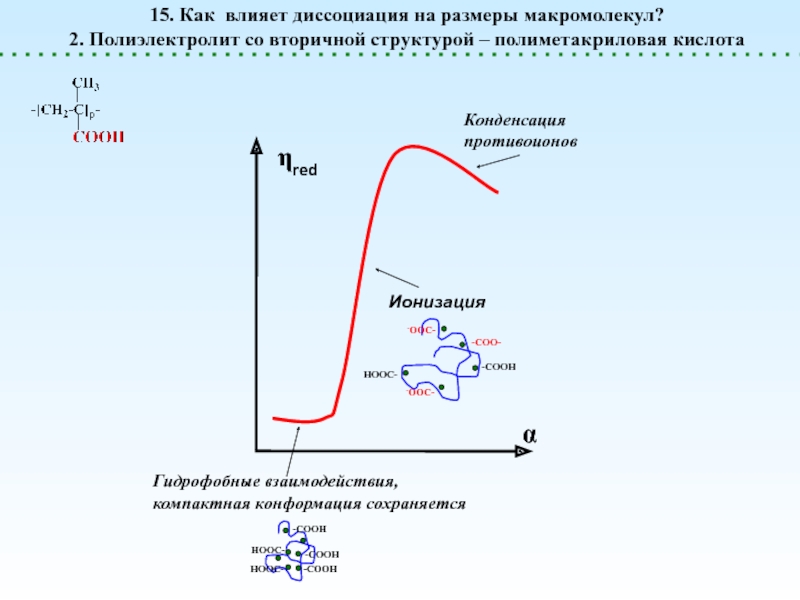
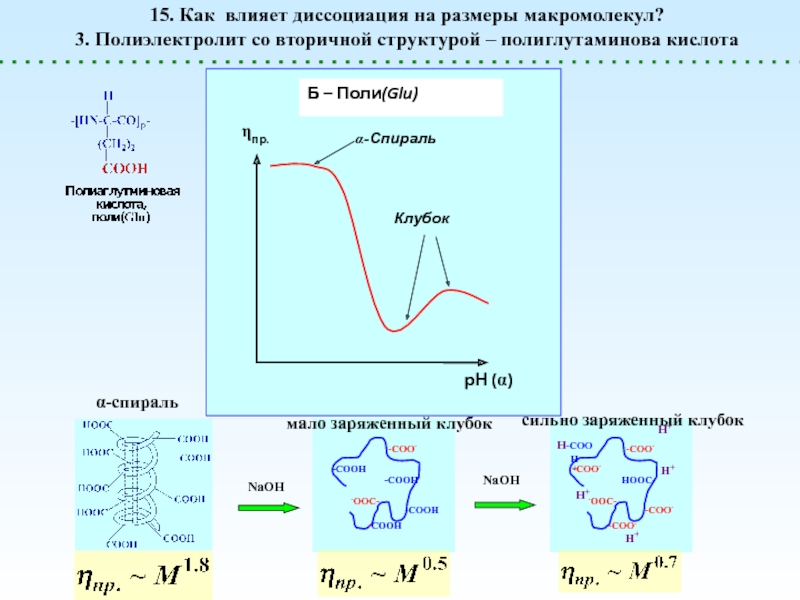
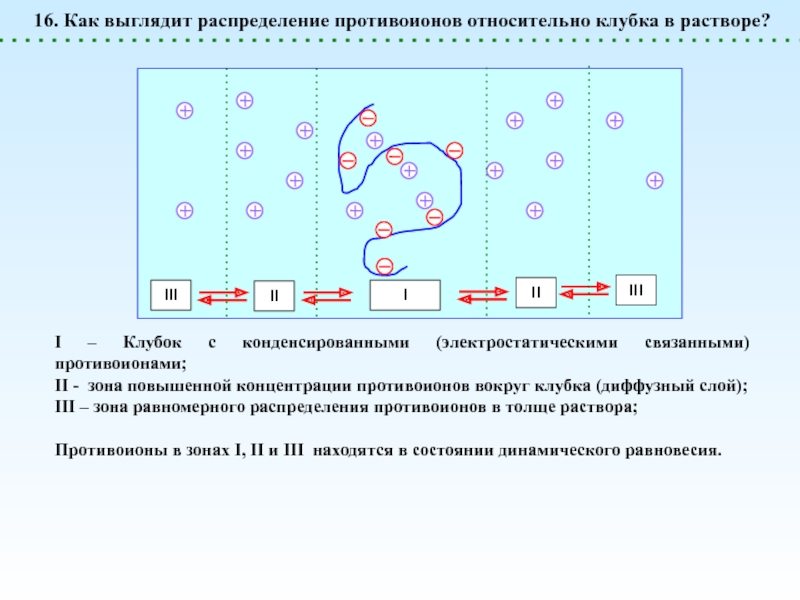
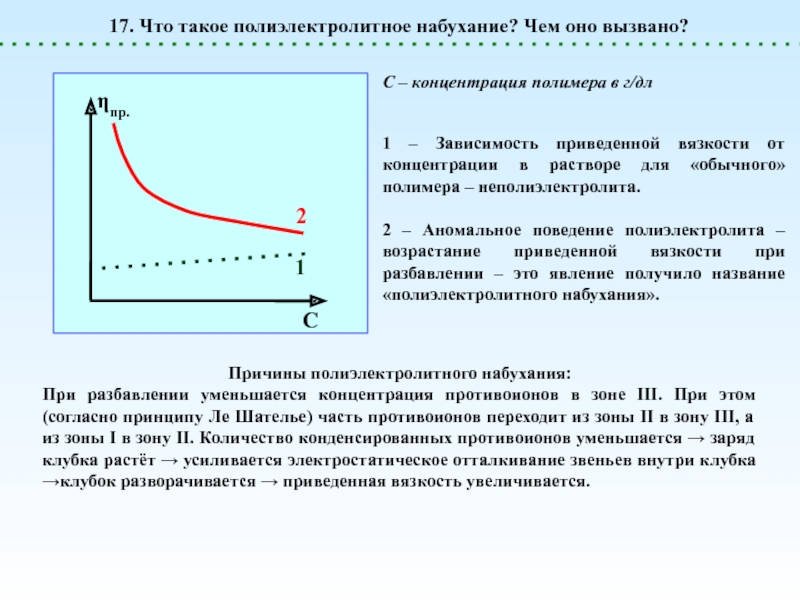
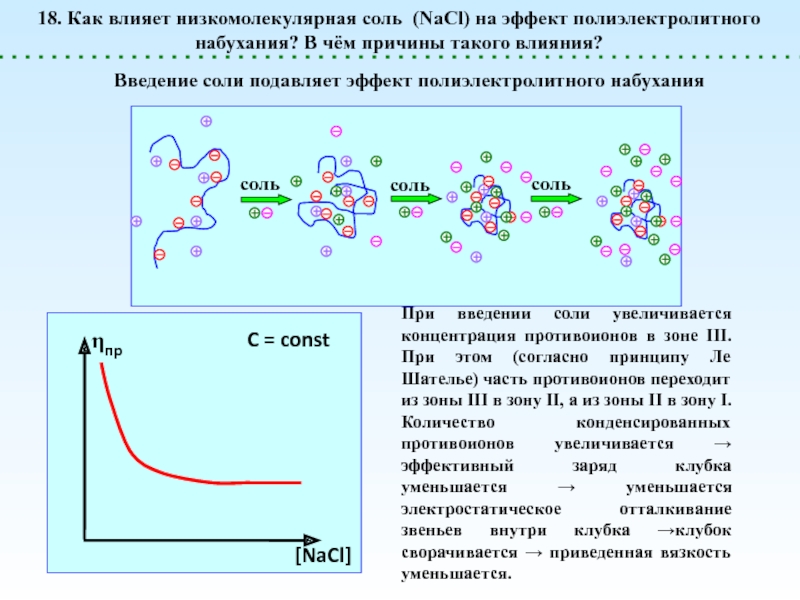
![Полиэлектролиты – это полимеры, мономерные звенья которых способны к 1 – [NaCl] = 0 (эффект полиэлектролитного набухания);2 - [NaCl] < 1 – [NaCl] = 0 (эффект полиэлектролитного набухания);2 - [NaCl] < [Na+]полимер; (концентрация соли меньше мольной концентрации](/img/thumbs/8d6badec953410d196c21eb144b67785-800x.jpg)