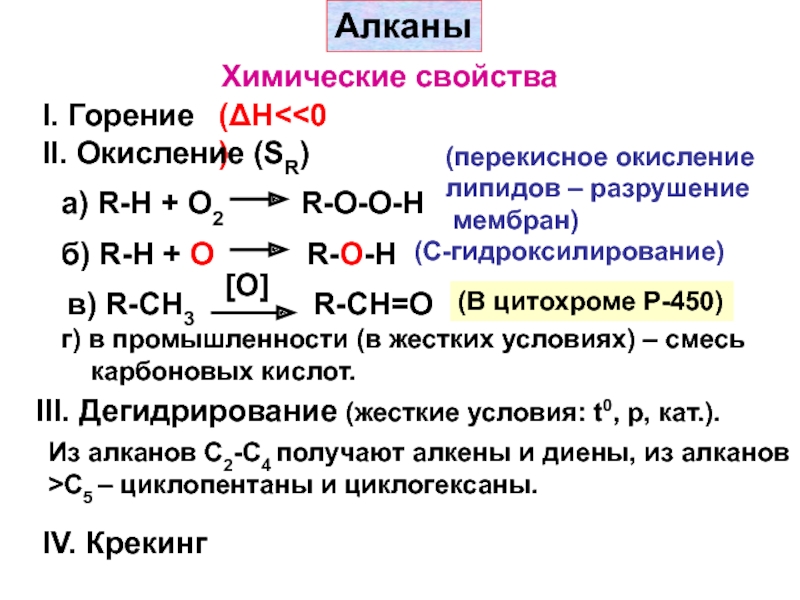
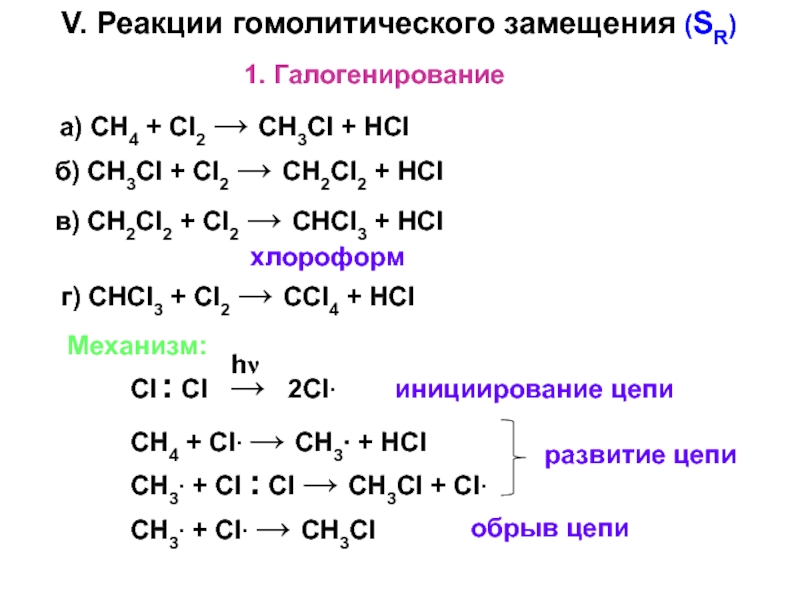
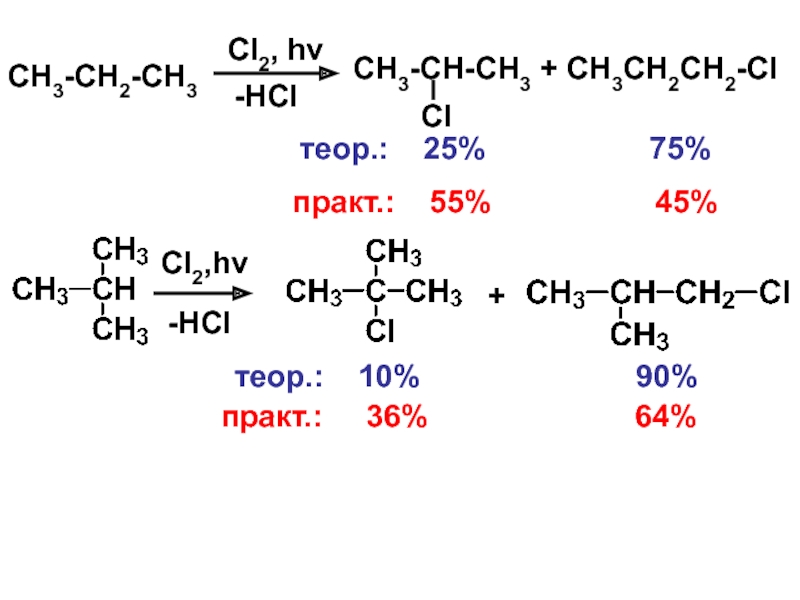
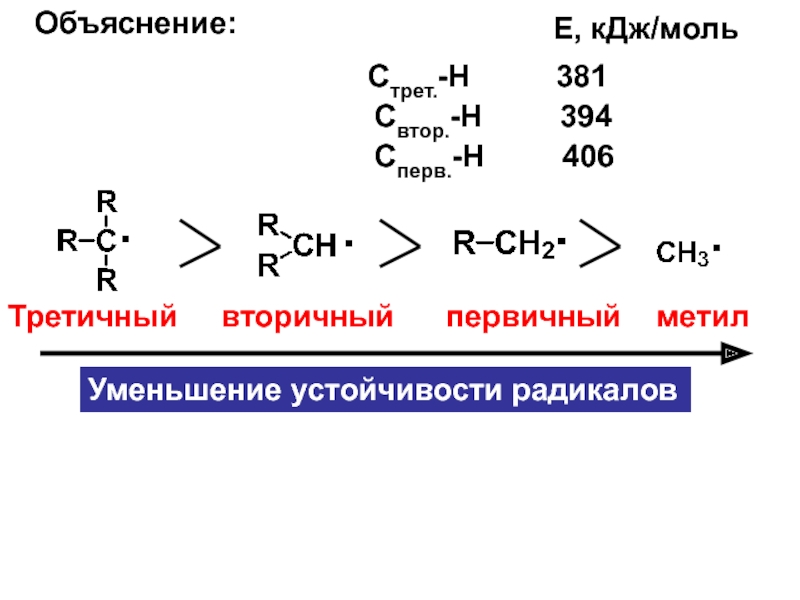
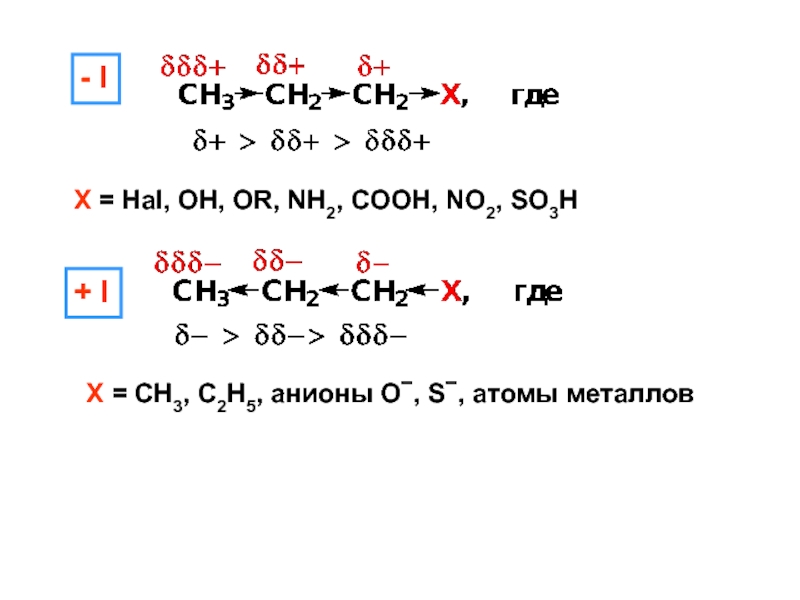
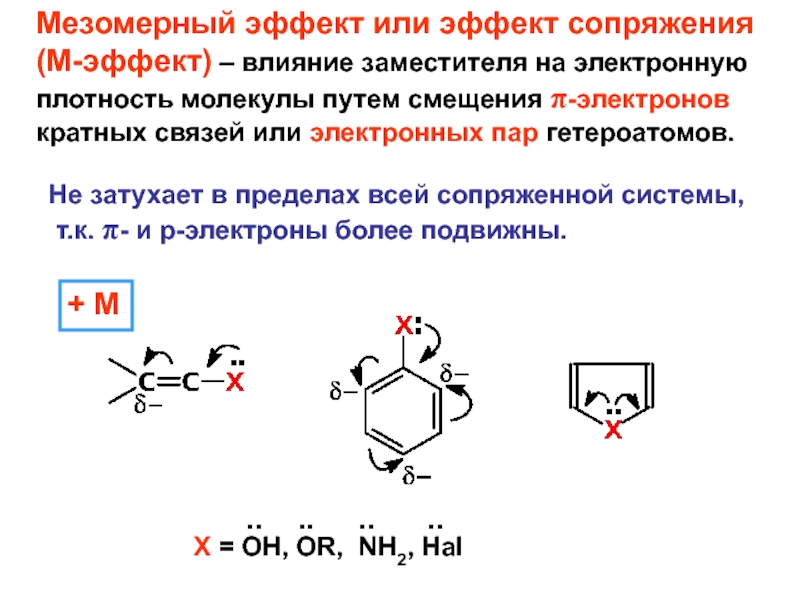
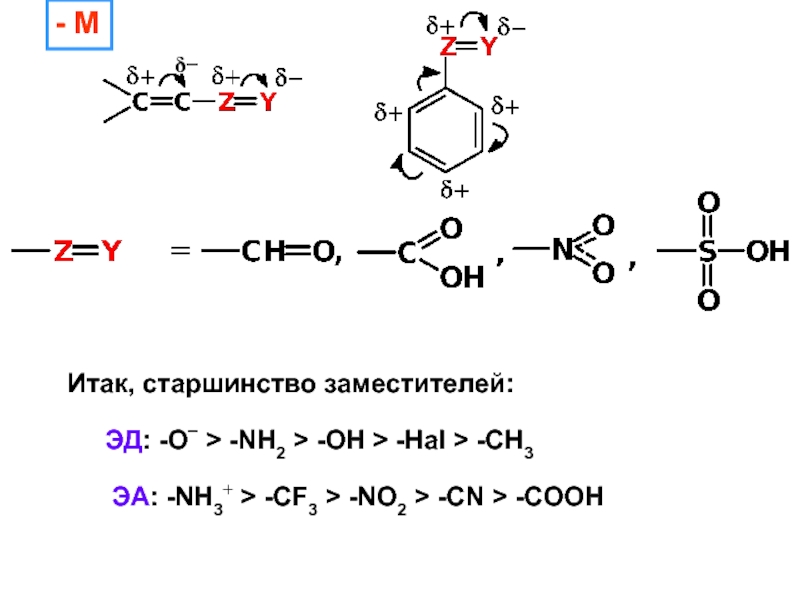
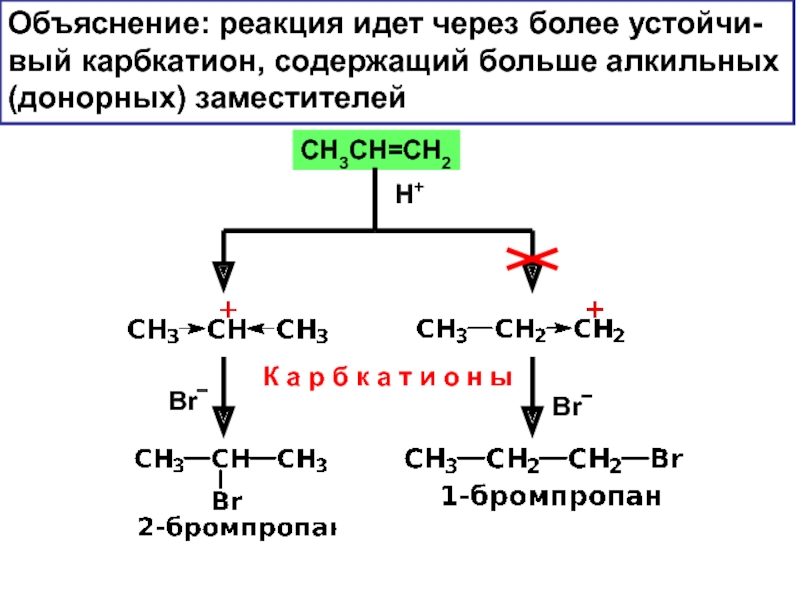
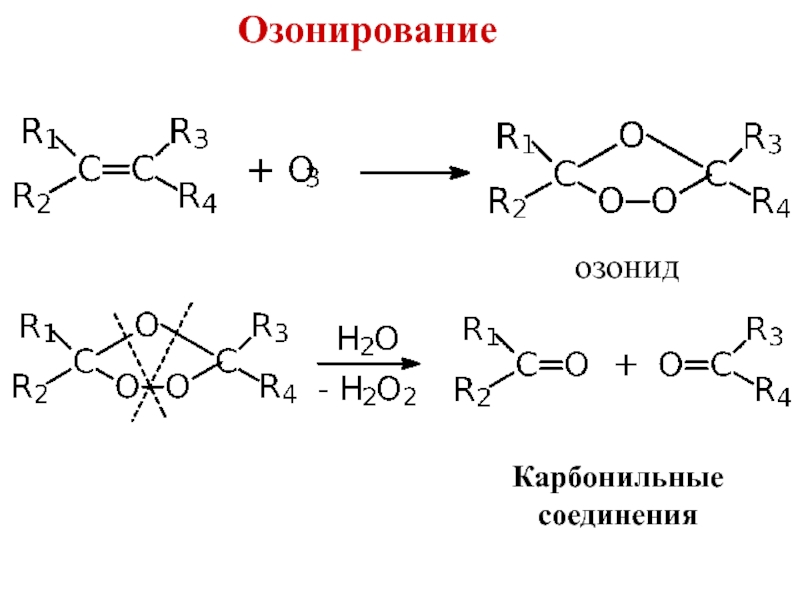
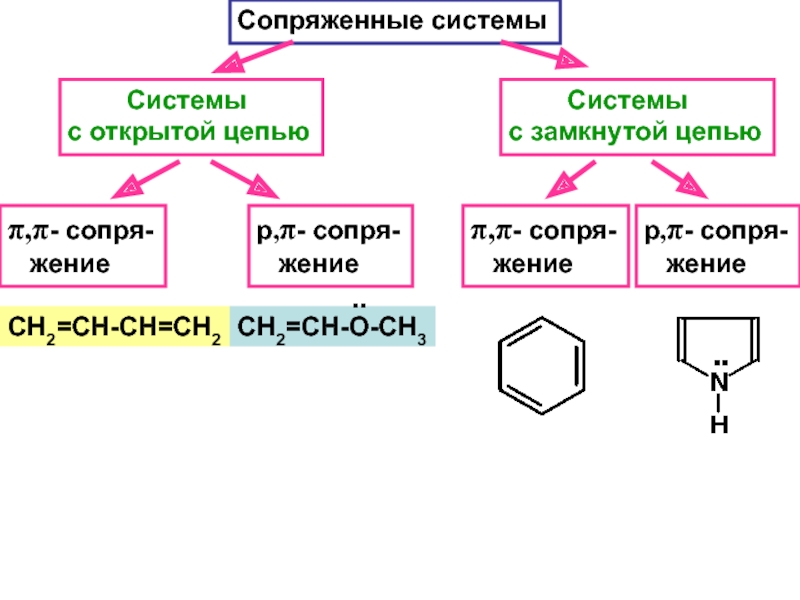
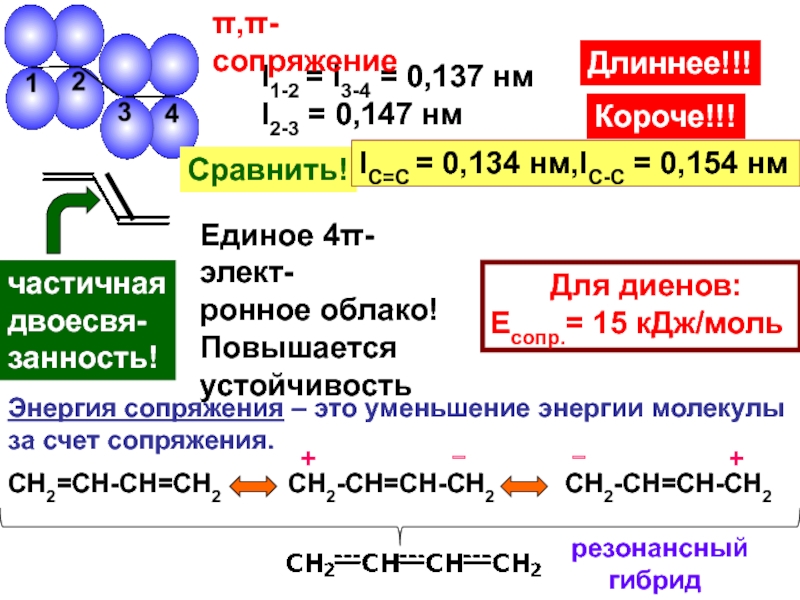
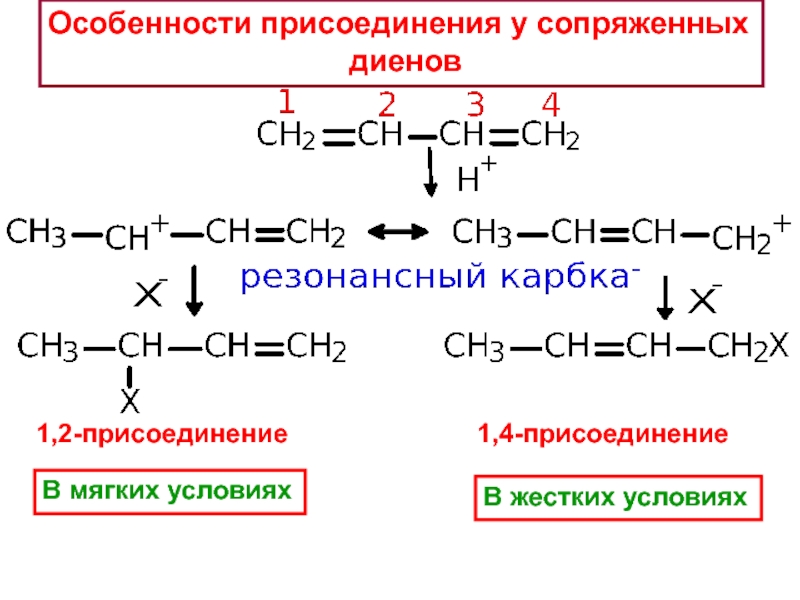
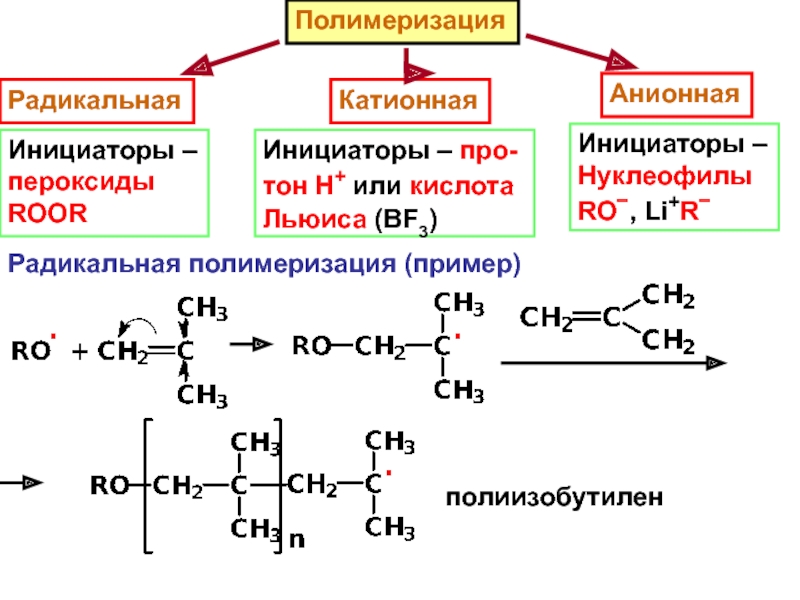
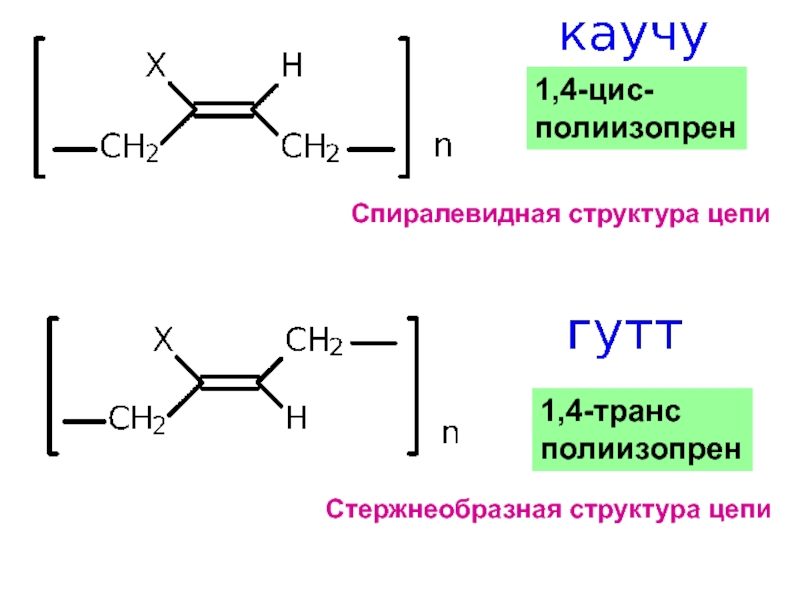
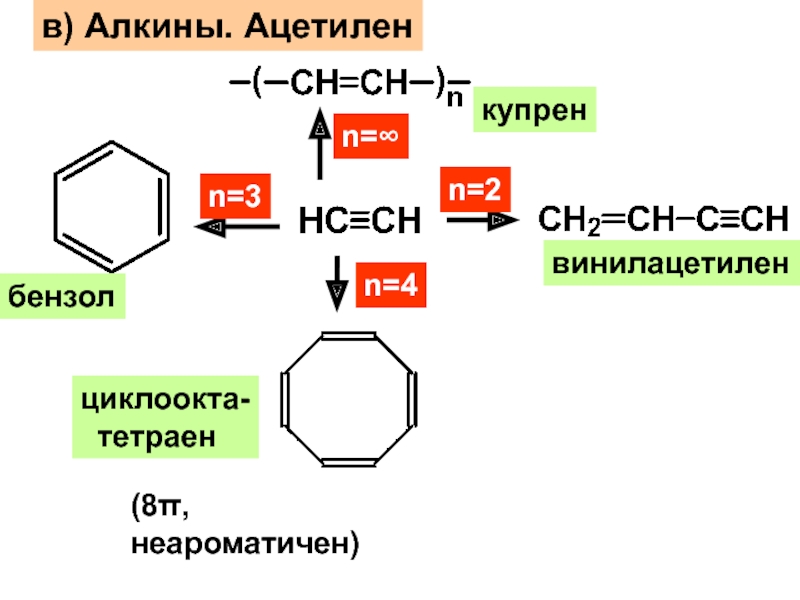
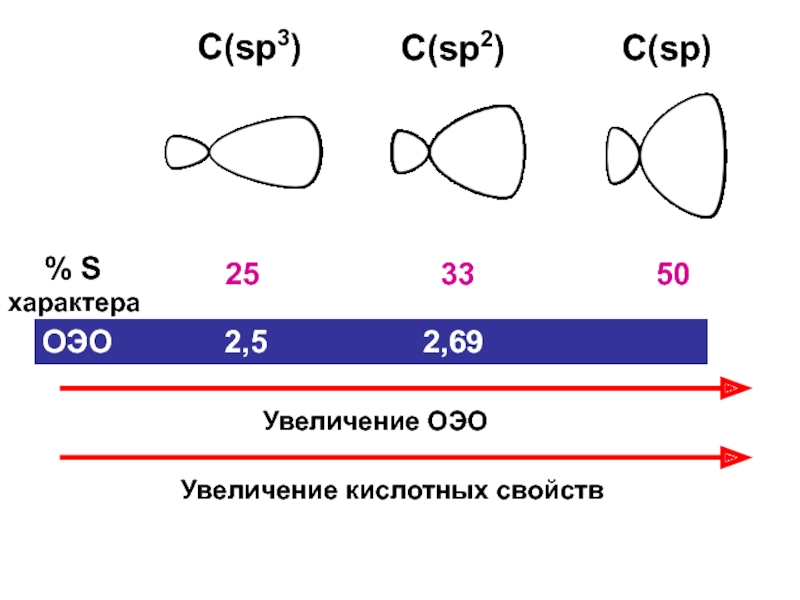
– разрушение
мембран)
б) R-H + O
R-O-H
(C-гидроксилирование)
в) R-CH3
[O]
R-CH=O
(В цитохроме Р-450)
г) в
промышленности (в жестких условиях) – смеськарбоновых кислот.
III. Дегидрирование (жесткие условия: t0, р, кат.).
Из алканов С2-С4 получают алкены и диены, из алканов
>С5 – циклопентаны и циклогексаны.
IV. Крекинг