Слайд 1РЕГУЛЯЦИЯ ЭКСПРЕССИИ ГЕНОВ У ПРОКАРИОТ и ЭУКАРИОТ
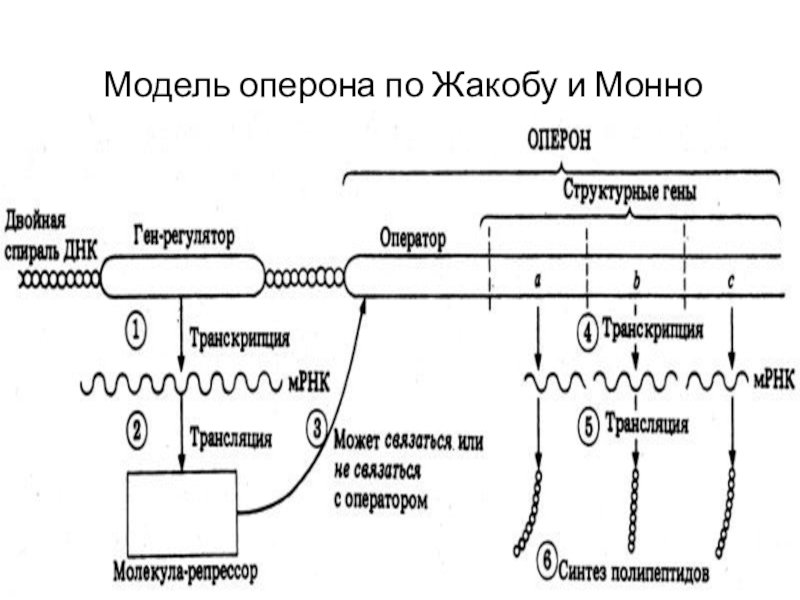
Слайд 2Ф.Жакоб и Ж.Моно 1961: общая теория регуляции генов
Сущность теории сводится
к «выключению» или «включению» генов как функционирующих единиц, к возможности
или невозможности проявления их способности передавать информацию о структуре белка.
У прокариот гены, контролирующие синтез белков-ферментов, катализирующих ход последовательных биохимических реакций, объединяются в структурно-функциональную единицу – оперон.
Слайд 3Модель оперона по Жакобу и Монно
Слайд 4Виды оперонов
Индуцибельный- регулятором является исходный продукт (субстрат). Субстрат стимулирует реакции
своего метаболизма
Репрессибельный- регулятором является конечный продукт (корепрессор). Он тормозит реакции,
ведущие к его образованию.
Слайд 5Состав индуцибельного оперона
Структурные гены, кодирующие белки-ферменты;
Промотор – участок молекулы ДНК,
к которому присоединяется РНК-полимераза;
Оператор – участок молекулы ДНК, место связывания
с регуляторным белком-репрессором;
Индуктор – метаболит, который связывается с белком-репрессором и переводит его в неактивную форму;
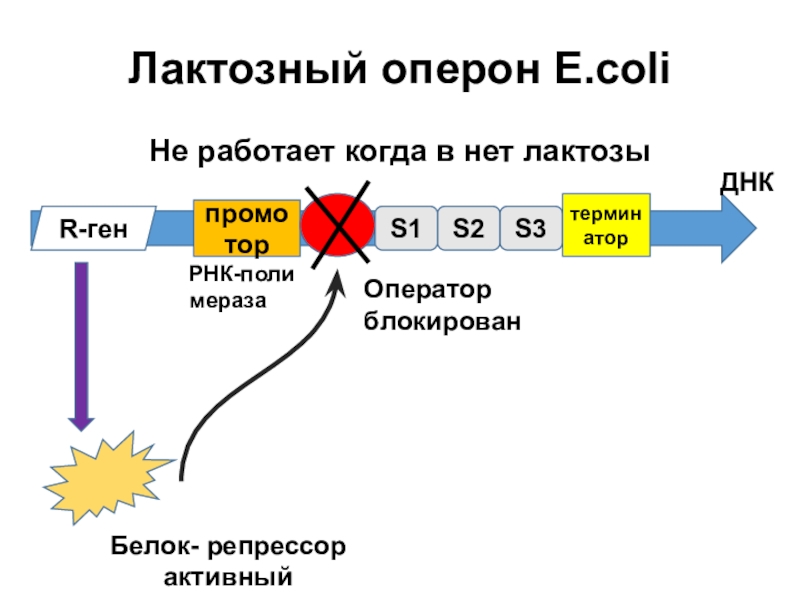
Синтез белка – репрессора контролируется геном- регулятором. Белок-репрессор обладает сродством и к оператору и к метаболиту.
Слайд 6Промоторы генов прокариот
Консенсусная последовательность- последовательность, в которой нуклеотид в каждом
конкретном положении встречается с наибольшей чистотой среди множества изученных промоторов.
Такие последовательности- наиболее сильные промоторы. Среди природных промоторов такиие последовательности не обнаружены. Оптимум между центрами последовательностей -10,-35 равен 17 п.о. ( от 16 до 20 п.о.) Отклонение снижает силу промотора. Старт транскрипции отстает от -15 последовательности на 6-9 п.о. Первый нуклеотид при иницации транскрипции, как правило, пурин.
Сила промотора- частота, с которой происходит инициация транскрипции с конкретного промотора.
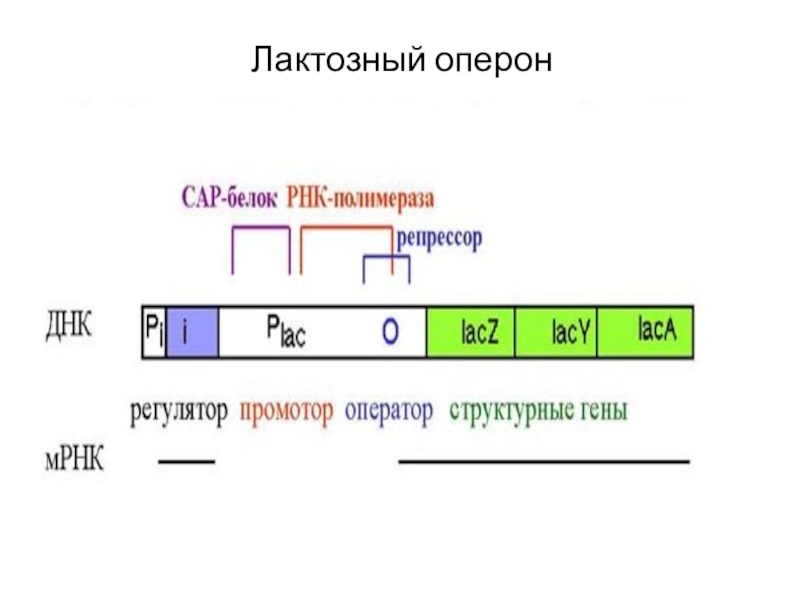
Слайд 8Структурные гены лактозного оперона — lacZ, lacY и lacA:
lacZ кодирует
фермент β-галактозидазу, которая расщепляет дисахарид лактозу на глюкозу и галактозу;
lacY
кодирует β-галактозид пермеазу, мембранный транспортный белок, который переносит лактозу внутрь клетки;
lacA кодирует β-галактозид трансацетилазу, фермент, переносящий ацетильную группу от ацетил-КoA на бета-галактозиды.
Слайд 9Регуляция лактозного оперона
Активность промоторов регулируются с помощью особых белков, которые
могут либо мешать или (негативно регулировать) - репрессор, либо способствовать
(позитивно регулировать) - активатор РНК-пол.
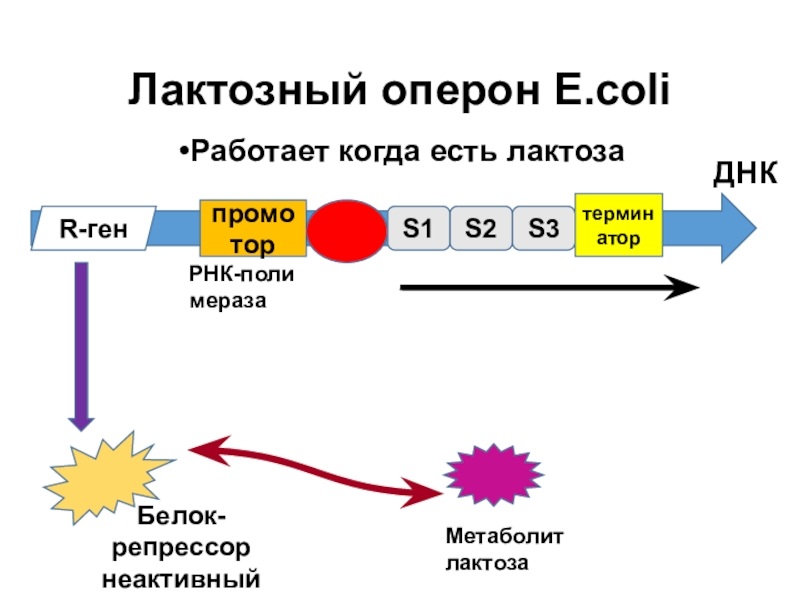
Эффекторы – соединения, определяющие способность репрессора связывать оператор. Разделяют 2 типа эффекторов: индукторы – снижают сродство репрессора к оператору, и корепрессоры – наоборот.
В отсутствии индуктора оперон не транскрибируется.
Ген, кодирующий репрессор(LacI) расположен рядом с лактозным опероном и экспрессируется постоянно. В отсутствии индуктора репрессор постоянно подавляет активность промотора лактозного оперона.
Слайд 10Лактозный оперон E.coli
Не работает когда в нет лактозы
промотор
S1
S2
S3
R-ген
Белок- репрессор
активный
РНК-поли
мераза
Оператор
блокирован
ДНК
терминатор
Слайд 11Лактозный оперон E.coli
Работает когда есть лактоза
R-ген
промотор
S1
S2
S3
РНК-поли
мераза
Белок- репрессор неактивный
Метаболит
лактоза
ДНК
терминатор
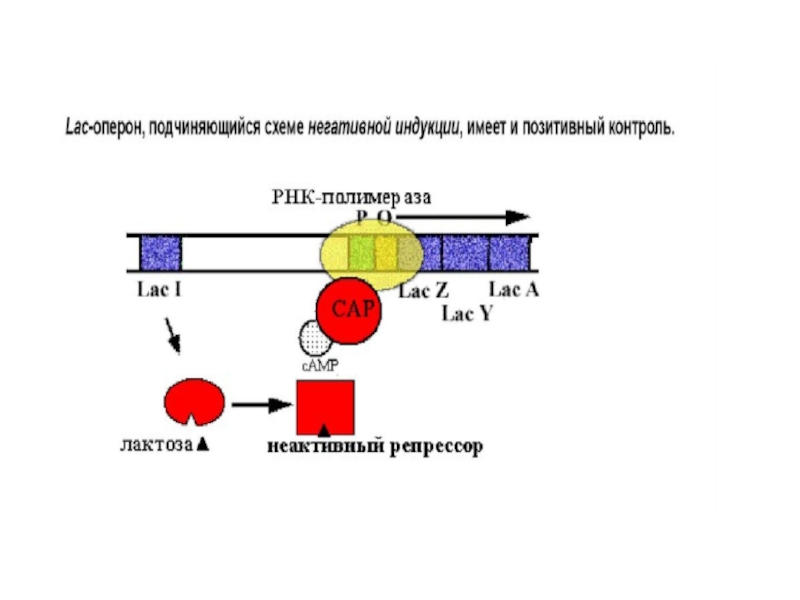
Слайд 12Позитивная регуляция экспрессии лактозного оперона
При понижении в среде концентрации глюкозы
у бактерий наблюдается синтез ц-АМФ. В свою очередь Ц-АМФ связывается
с белком – активатором катаболизма углеводов CAP. После их связывания с сайтами на ДНК, РНК-пол. получает возможность связаться с промоторами лактозного, галактозного и мальтозного оперонов и транскрибировать их.
Слайд 14Триптофановый оперон
Триптофановый оперон (имеется у многих бактерий, впервые описан у
E. Coli) включает гены пяти белков, которые после трансляции дают
4 фермента, необходимых для синтеза триптофана. Эти белки образуются согласованно при трансляции полицистронной мРНК, транскрибируемой с триптофанового оперона. Уровень экспрессии зависит от содержания триптофана в клетке.
Регуляция триптофанового оперона осуществляется двумя способами: с помощью белка-репрессора (репрессия), а также с помощью особой последовательности — аттеньюатора. При этом в каждом из этих случаев регуляция осуществляется по принципу отрицательной обратной связи.
Слайд 15Триптофановый оперон. Репрессия
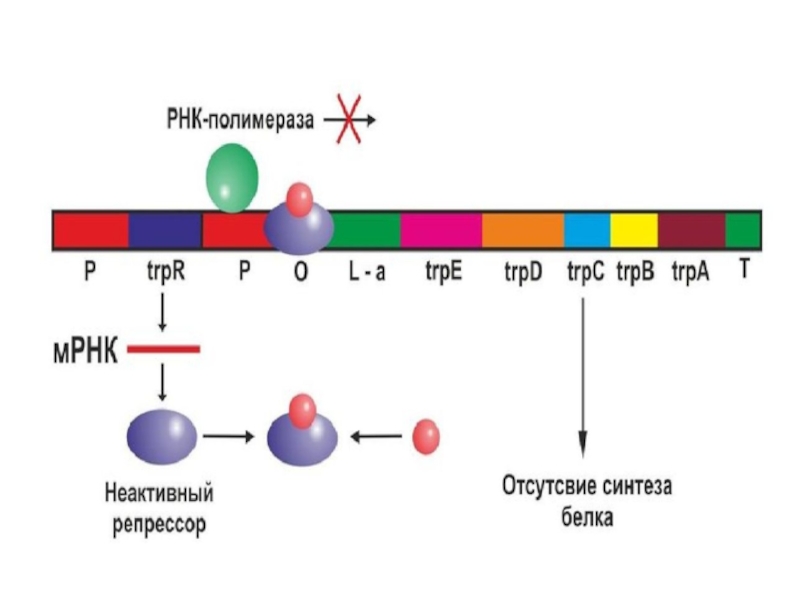
Белок-репрессор (триптофановый репрессор) имеет молекулярную массу 58 кДа,
кодируется геном trpR, расположенным на значительном расстоянии от самого оперона.
Ген trpR непрерывно экспрессируется на невысоком уровне, образуя мономеры, которые затем объединяются в тетрамеры. В отсутствие триптофана эти тетрамеры неактивны и распадаются в нуклеоплазме. Однако если концентрация триптофана в клетке высока, то тетрамеры связываются с триптофаном. Только в комплексе с триптофаном белок-репрессор может изменить конформацию и связаться с оператором, препятствуя взаимодействию РНК-полимеразы с промотором.
Важно, что в триптофановом опероне нуклеотидные последовательности оператора и промотора частично перекрываются, так что присоединение комплекса L-триптофан+белок-репрессор автоматически блокирует связывание РНК-полимеразы с промотором.
Слайд 17Триптофановый оперон. Аттенюация
Этот способ регуляции возможен потому, что у прокариот
процессы транскрипции и трансляции не разделены во времени и пространстве
и идут одновременно: пока РНК-полимераза синтезирует мРНК, синтезированный участок этой мРНК транслируется рибосомой. В связи с этим процесс трансляции может оказывать непосредственное влияние на транскрипцию оперона.
В составе мРНК присутствует последовательность Шайна-Долга (SD-последовательность), ответственная за связывание рибосом, AUG-кодон (инициирующий) и лидерная последовательность.
Слайд 18Лидерная последовательность (162 п.н.) располагается сразу после оператора в триптофановом.
Она кодирует лидерный пептид, который получил такое название, поскольку с
полицистронной мРНК триптофанового оперона этот пептид синтезируется первым. В состав лидерной последовательности входит особая аттенюаторная (ослабительная) последовательность, которая, влияя на вторичную структуру синтезируемой мРНК, способна вызывать преждевременную терминацию транскрипции.
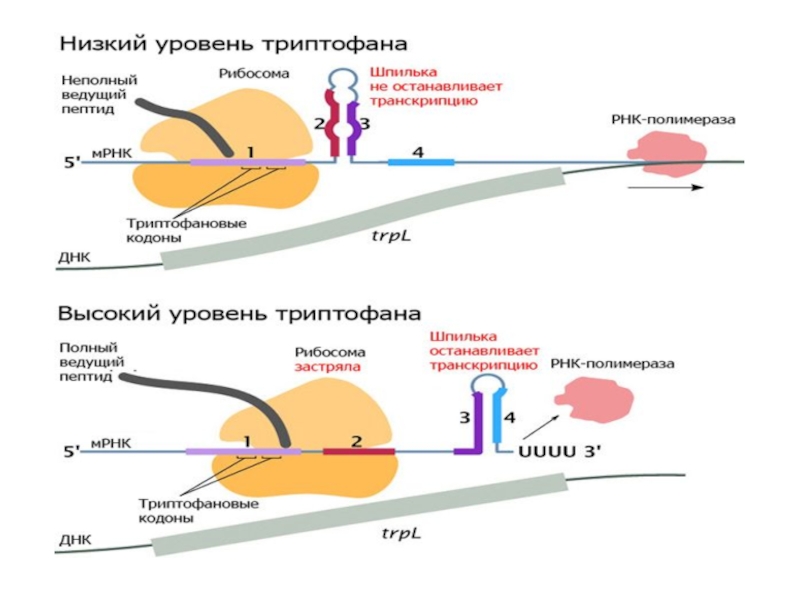
В trp-опероне E.coli аттенюатор имеет 4 области с инвертными повторами, образующими при транскрипции шпилечные структуры. мРНК. Возможны 3 варианта шпилек, а именно между последовательностями: 1—2, 2—3, 3—4. Все три одновременно образоваться не могут. При этом образование шпильки 1—2 блокирует образование шпильки 2—3, а образование шпильки 2—3, в свою очередь, препятствует образованию шпильки 3—4. Только шпилька 3—4 является терминаторной, то есть при её образовании РНК-полимераза с высокой вероятностью диссоциирует от ДНК, и транскрипция прерывается.
Слайд 19В условиях нехватки триптофана рибосома начинает «зависать» на последовательности 1,
так как именно там расположены кодоны для двух остатков триптофана.
Останавливаясь на двух триптофановых кодонах, рибосома закрывает первую из 4 областей обращённых повторов. Из-за этого образуется шпилька 2—3 (антитерминирующая), а терминаторная шпилька 3—4 не образуется, и транскрипция продолжается дальше в область структурных генов. Это ведет к транскрипции полноразмерной мРНК триптофанового оперона и биосинтезу ферментов, необходимых для синтеза триптофана.
Если же концентрация триптофана высока, то «зависания» рибосомы на триптофановых кодонах не происходит: необходимый комплекс триптофанил-тРНКTrp находится быстро. В этом случае рибосома закрывает уже не одну первую, а две первые области обращённых повторов. Остаются свободными области 3 и 4, из-за чего формируется терминаторная шпилька 3—4, а значит, транскрипция останавливается. В итоге образуется лишь короткий нефункциональный пептид.
Слайд 21Для правильной работы аттенюатора чрезвычайно важна одновременность процессов транскрипции и
трансляции лидерного пептида. Чтобы обеспечить её, в лидерной области имеется
особый «сайт паузы». Достигнув его, РНК-полимераза приостанавливает транскрипцию, пока не начнётся трансляция. Таким образом процессы транскрипции и трансляции протекают синхронизированно.
Схожий механизм аттенюации имеет место при синтезе других аминокислот: гистидина, фенилаланина и треонина. В аттенюаторе гистидинового оперона Escherichia coli имеется 7 гистидиновых кодонов, фенилаланинового — 7 фенилаланиновых кодонов.
Слайд 22Классы эукариотических генов
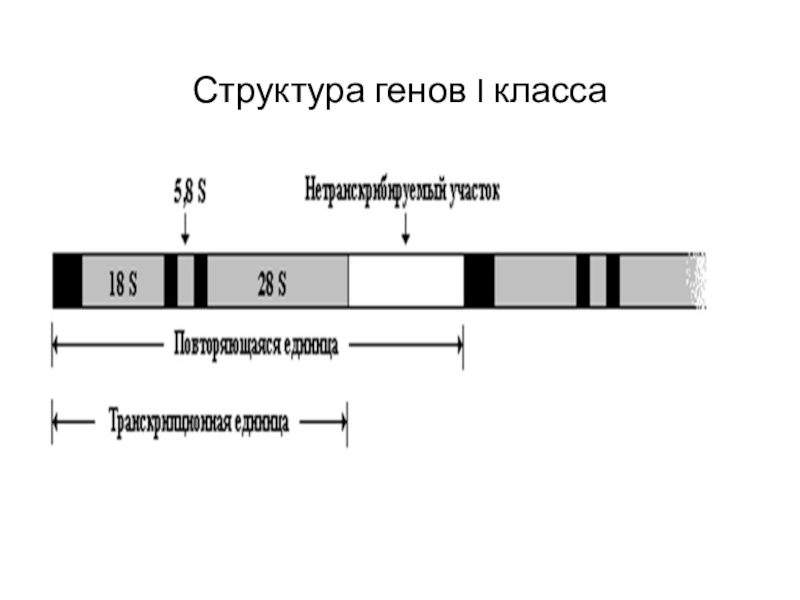
Гены I класса - это гены рРНК
объединенные в кластеры. Один кластер содержит гены 18S рРНК, 5,8S
рРНК и 28S рРНК (5S рРНК кодируется генами класса III). В спутничных районах акроцентрических хромосом (13,14,15, 21, 22 пары) кластеры расположены тандемно (друг за другом) в большом количестве копий. Между генами рРНК и между кластерами расположены спейсеры (вставки), которые удаляются при созревании молекул рРНК.
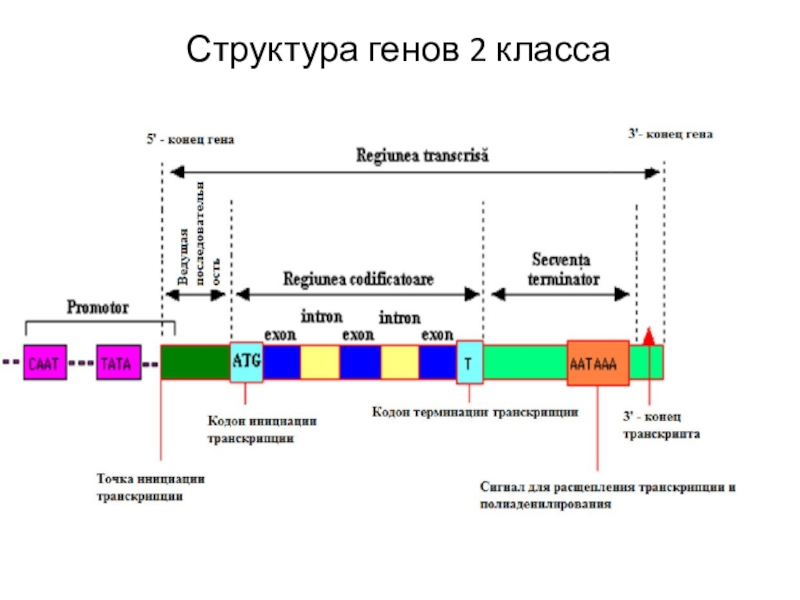
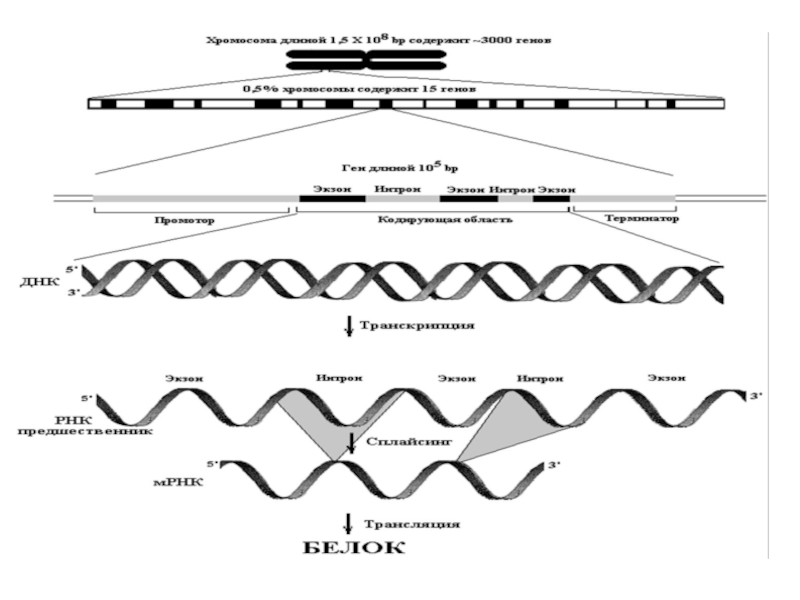
Гены класса II имеют прерывистое строение. Экзоны (последовательности, кодирующие последовательность аминокислот белка) чередуются с интронами (последовательности, не кодирующие белки). Единица транскрипции всегда начинается с экзона и заканчивается экзоном. На 5'- конце единицы транскрипции располагаются 5'-нетранслируемые последовательности, на 3'- конце - 3'-нетранслиркемые последовательности.
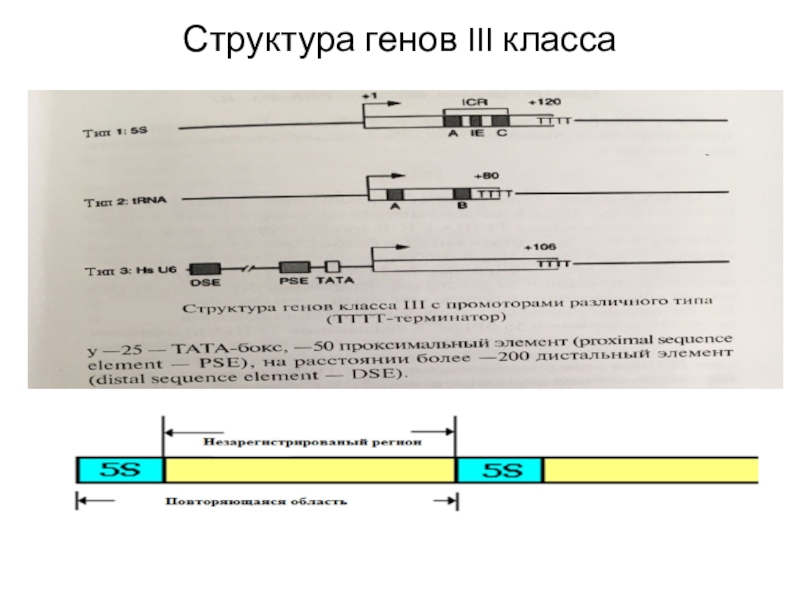
Гены разных III класса - гены тРНК сгруппированы в кластеры и расположены в разных хромосомах. У человека на гаплоидный геном приходится 1300 генов тРНК. Промотор генов тРНК располагается в внутри кодирующей последовательности и имеет два района (А- и В-боксы). В генах тРНК есть один интрон размером от 14 до 60 нп. Он располагается через один нуклеотид от 3'-конца антикодона.

Слайд 26ДНК зависимая-РНК-полимераза
РНК-полимераза I - транскрибирует гены класса I - такие
как 28S, 18S, 5S (то есть все типа рРНК, кроме
5SрРНК).
РНК- полимераза II - транскрибирует гены класса II - малые ядерные РНК (U1-U5), гены кодирующие белки ( то есть продуктом РНК-полимеразы II является мРНК), вирусные РНК.
РНК- полимераза III - транскрибирует гены класса III - осуществляет снитесь тРНК, 5SрРНК, U6 (одна из мяРНК), вирусные РНК.
Слайд 28Регуляция экспрессии генов
у эукариот
Слайд 29Регуляция на уровне транскрипции:
В основу регуляции положено взаимодействие определенных участков
ДНК с белками - транскрипционными факторами (TF).
Структура хроматина;
Энхансеры- усилители транскрипции;
Сайленсеры
– ослабляют транскрипцию;
Связываются с промотором, обеспечивая присоединение РНК-полимеразы.
Слайд 30Регуляция за счет конденсации и деконденсации ДНК
В ходе матричных процессов
— транскрипции и репликации — полимеразные белки и белковые факторы
должны иметь возможность присоединяться к цепи ДНК. Однако практически вся ДНК у эукариот связана с гистонами и образует нуклеосомную нить.
Для того, чтобы экспрессировать генетическую информацию ДНК, транскрипционный аппарат клетки должен получить «доступ» к ДНК, которая упакована в нуклеосомную нить гистоновыми белками.
Неэкспрессируемая ДНК — гетерохроматин — обычно высокоспирализована и потому недоступна дляРНК-полимераз. Транскрипционно активная форма ДНК —эухроматин — имеет меньшую степень спирализации.
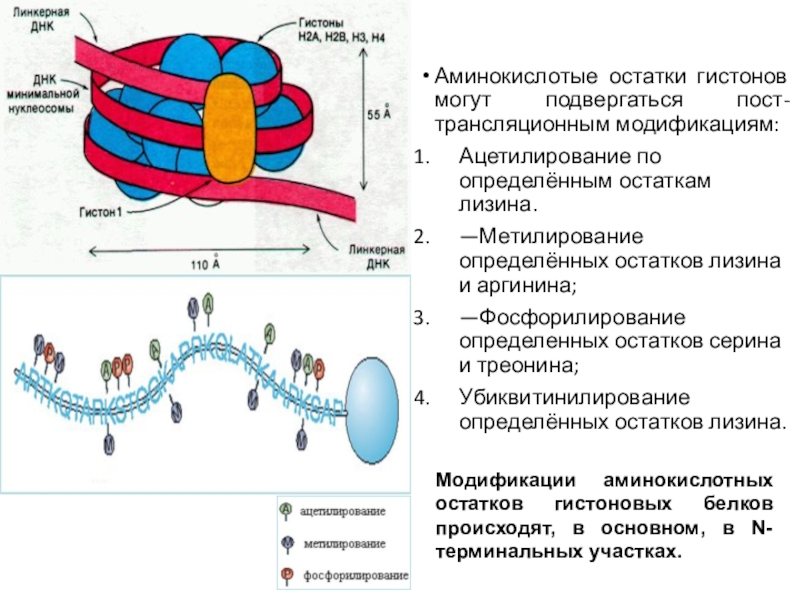
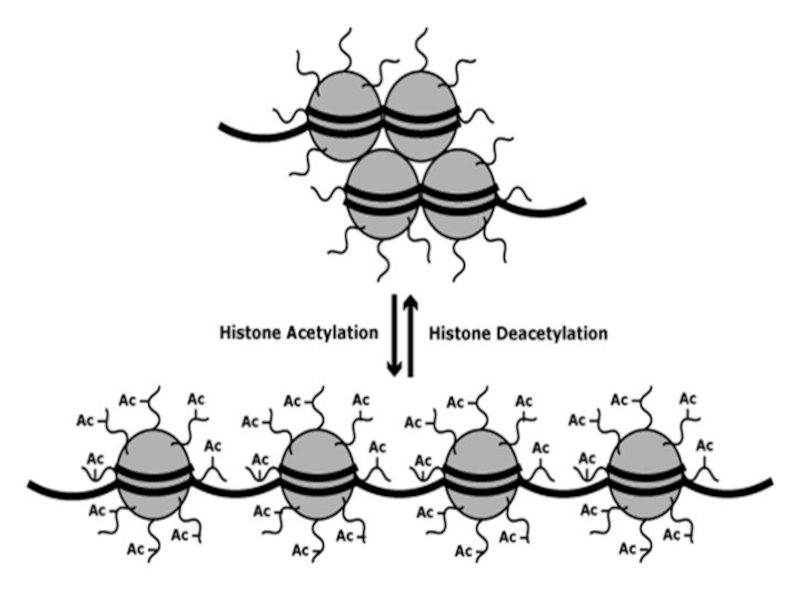
Слайд 32Аминокислотые остатки гистонов могут подвергаться пост-трансляционным модификациям:
Ацетилирование по определённым остаткам
лизина.
—Метилирование определённых остатков лизина и аргинина;
—Фосфорилирование определенных остатков серина и
треонина;
Убиквитинилирование определённых остатков лизина.
Модификации аминокислотных остатков гистоновых белков происходят, в основном, в N-терминальных участках.
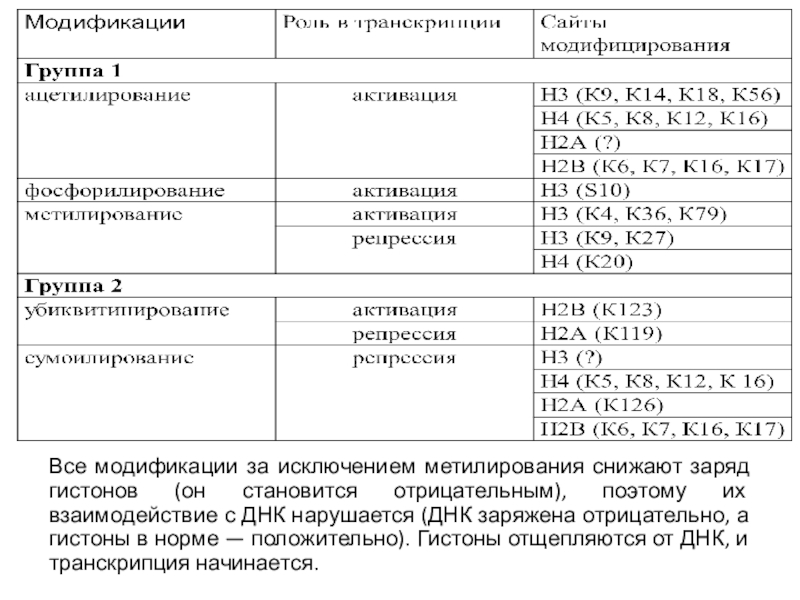
Слайд 34Все модификации за исключением метилирования снижают заряд гистонов (он становится
отрицательным), поэтому их взаимодействие с ДНК нарушается (ДНК заряжена отрицательно,
а гистоны в норме — положительно). Гистоны отщепляются от ДНК, и транскрипция начинается.
Слайд 37Что происходит?
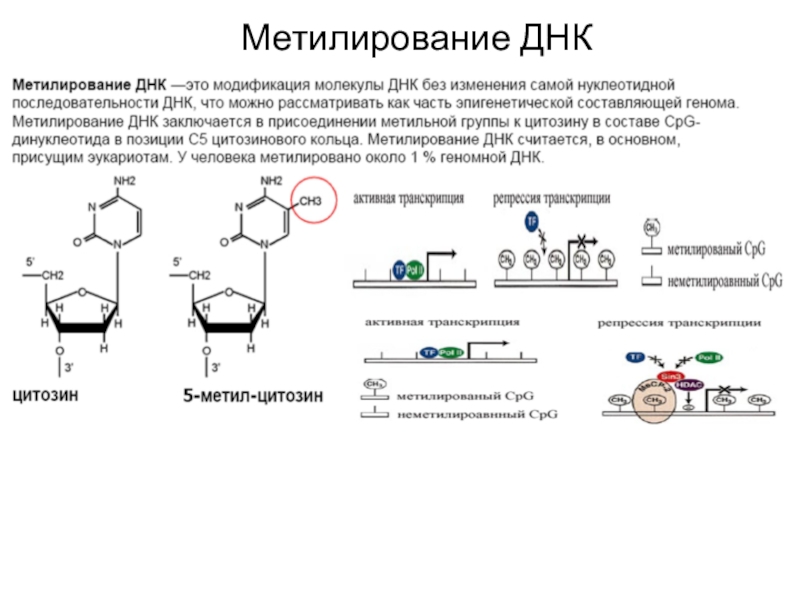
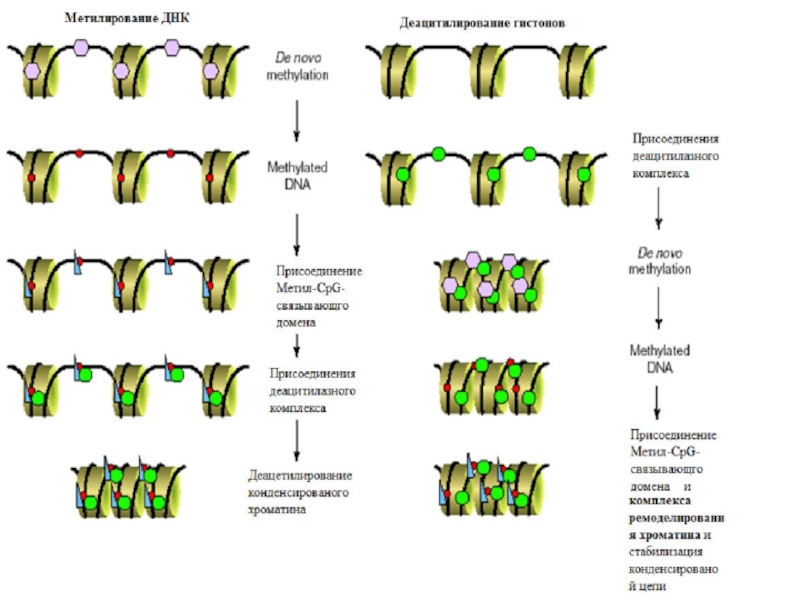
Метильные группы нарушают ДНК-белковые взаимодействия, выступая в большую бороздку
ДНК и препятствуя связыванию специфических транскрипционных факторов;
Метилированные районы ДНК
специфически связывают транскрипционные репрессоры;
Метилирование ДНК влияет на структуру хроматина.
В результате осуществляется контроль процессов:
Транскрипции;
Репликации;
Рекомбинации;
Репарации;
Транспозиции генов;
Инактивации Х-хромосомы.
Слайд 38Архитектурные белки высокомобильной группы (HMG)
Были названы так потому, что обладают
высокой электрофоретической мобильностью в полиакриламидном геле (электрофорез).
HMG-белки способны изменять
конформацию ДНК, вызывая скручивание, выпрямление, разматывание цепи или формирование петель.
HMG 14/17. Кoровые частицы нуклеосом содержат на своей поверхности две молекулы HMG 14/17, которые соединяют между собой цепи ДНК двух соседних витков. HMG-белки этой группы могут замещать гистон H1 в активно транскрибируемых генах.
HMG 1/2 - способствуют сборке нуклеосом in vitro, однако физиологическое значение этого факта остается непонятным.
HMG I/Y преимущественно взаимодействуют с АТ-богатыми участками ДНК, что характерно и для гистона Н1. Предполагается, что эти белки конкурируют с гистоном Н1 in vivo за промоторы и области начала репликации ДНК. Являются вспомогательными факторами для факторов транскрипции.
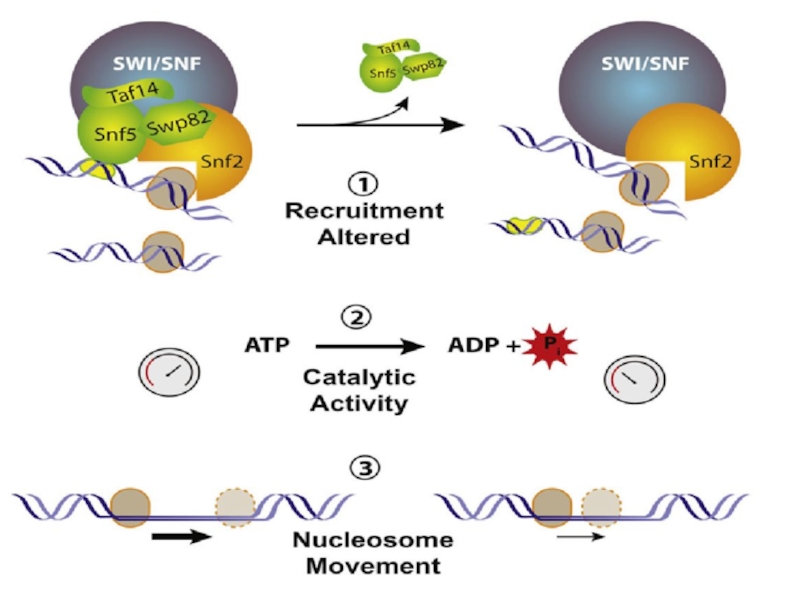
Слайд 39Хроматин-перестраивающие комплексы
В середине 90-хгодов стало известно, что хроматин содержит комплексы,
перестраивающие нуклеосомы и использующие энергию АТФ. Эти комплексы разрывают связи
между ДНК и гистонами, благодаря чему ДНК становится доступной для других белков, а гистоновый октамер «скользит» вдоль цепи ДНК или даже переносится на другую цепь. Таким образом, хроматин-перестраивающие комплексы придают хроматину «плавающую» структуру, не меняя общую степень упаковки ДНК.
Хроматин-перестраивающие комплексы состоят из множества субъединиц, организованных в комплекс SWI/SNF (~11 субъединиц) и комплекс RSC.
Предполагаемый механизм действия этих комплексов заключается во внесении локальных изгибов в цепь ДНК, благодаря созданию «волн», которые постепенно разрывают связи между ДНК и гистонами. В результате нуклеосомный кор «соскальзывает» с нужного участка ДНК, приоткрывая его для белков-ферментов.
Слайд 41Факторы транскрипции
Для генов I класса:
TIF-IA-белок 75 кДа, который принимает участие
в инициации транскрипции. Синтезирует первую фосфодиэфирную связь и выходит из
комплекса.
TIF-IB-ключевой фактор инициации транскрипции. Узнает коровый элемент промотора. Состоит из элементов TBP. TBP является видоспецифичным и отвечает за связывание TATA-последовательности.
UBF-связывает UCF-последовательность. Это фактор активирующий транскрипцию. Также способен связывать энхансеры.
TIF-IC-фактор инициации и элонгации. Без данного фактора эллонгация невозможна, так как именно он отвечает за разрыв связи РНК-полимеразы с непромоторной последовательностью. Имеет высокое сродство к РНК-полимеразе.
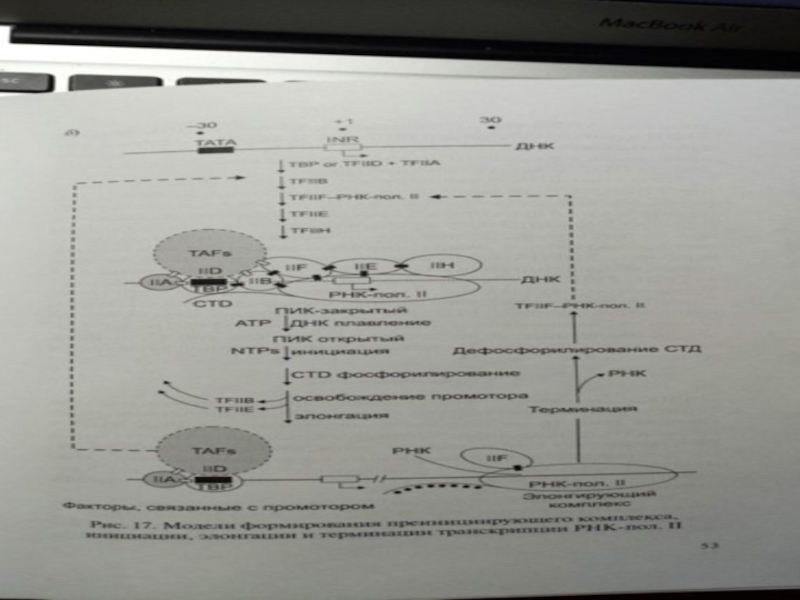
Слайд 42Факторы транскрипции
Для генов II класса:
TFIIA-стабилизирует комплекс TFIID и ДНК. Может
связывать ингибиторы, препятствующие формированию преинициирующего комплекса на TATA-содержащих промоторах.
TFIIB -
превращает комплекс в преинициирующий, в его составе появляется последовательность ДНК до +10, включающая точку старта инициации транскрипции +1.
TFIIF рекрутирует РНК полимеразу II.
TFIIH - до состоит из 9 субъединиц, выполняет ферментативные функции, необходимые для инициации транскрипции.
TFIID-связывается с TATA-боксом. Субъединица TFIID, которая узнает этот бокс, была названа TBP.
TFIIH, содержит ДНК-хеликазу как одну из своих субъединиц, открывает доступ ДНК-полимеразе II к матричной цепи, гидролизуя ATФ и раскручивая ДНК, и тем самым «открывая» матричную нить.
Слайд 44Факторы транскрипции
Для генов III класса:
TFIIIA. Участвует в транскрипции только генов
5S-рРНК. Формирование преинициирующего комплекса на генах начинается с взаимодействия TFIIIA
с ICR либо ICR-C-бокс.
TFIIIB. Привлекает и рекрутирует РНК-полимеразу и осуществляет коррецию инициации транскрипции. В составе есть TBP, два TAF (ассоциированные факторы). Второй TAF или TFIIIB 90. Превращает «закрытый» преинициирующий комплекс в «открытый».
TFIIIС- лосуществляет селекцию промоторов при транскрипции тРНК.
TFIIIE-стимулирует общий уровень транскрипции тРНК генов.
SNAPс. Связывает промоторную PSE-последовательность, расположенную у -50 -55 и является ядром для сборки транскрипционной машины при транскрипции генов мяРНК, РНК-пол-II, РНК-пол-III.
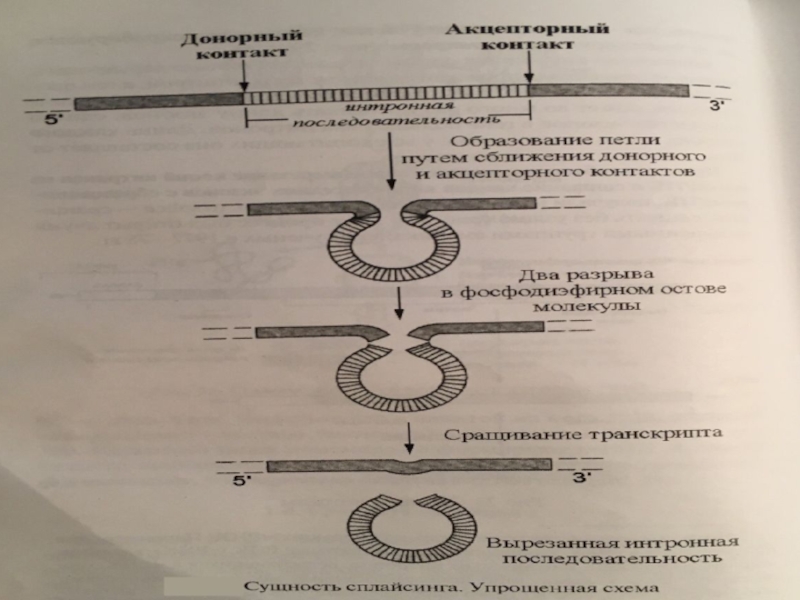
Слайд 45На уровне процессинга
Точность сплайсинга обеспечивается взаимодействием белков-сплайсинга и мя-РНК (комплекс
сплайосома). Сплайосома связывается с концевыми участками интрона ( 5′
-конец интрона почти всегда содержит ГУ, а 3′- конец интрона содержит АГ), что способствует точному вырезанию интронов ферментами рестриктазами.
Процессинг состоит из следующих этапов:
Кэпирование 5’-конца мРНК;
Полиаденилирования 3’-конца;
Сплайсинг;
Редактирование-крайне редко.
Слайд 46Кэпирование и Полиаденилирование
Кэпирование 5’-конца – защищает 5’-конец от действия экзонуклеаз,
а также обеспечивает правильную установку мРНК на рибосоме за счет
кэп-связывающих белков.
Полиаденилирование 3’-конца-защищает 3’-конец от гидролиза и обеспечивает стабильность ядерного РНК.
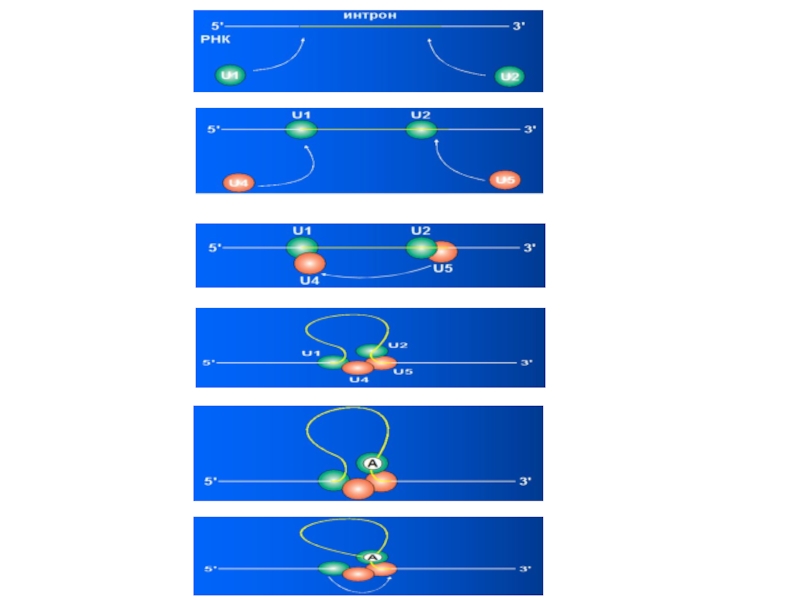
Слайд 47Сплайсинг
Сплайсинг осуществляется с помощью малых ядерных рибонуклеопротеидов (мя РНП). Рибосома
– большой рибонуклеопротеид. В состав входит РНК и несколько белков.
мя РНП участвует 4 типа :U1, U2, U4, U5 (всего известно около 10 видов).
Участок РНК, входящий в состав U1, комплементарен донорному сайту, а участок РНК, входящий в состав U2, комплементарен акцепторному сайту, благодаря чему четкое соответствие между первичным транскриптом и мя РНП. После этого присоединяется U4 и U5, так как в их составе есть частично комплементарные участки.
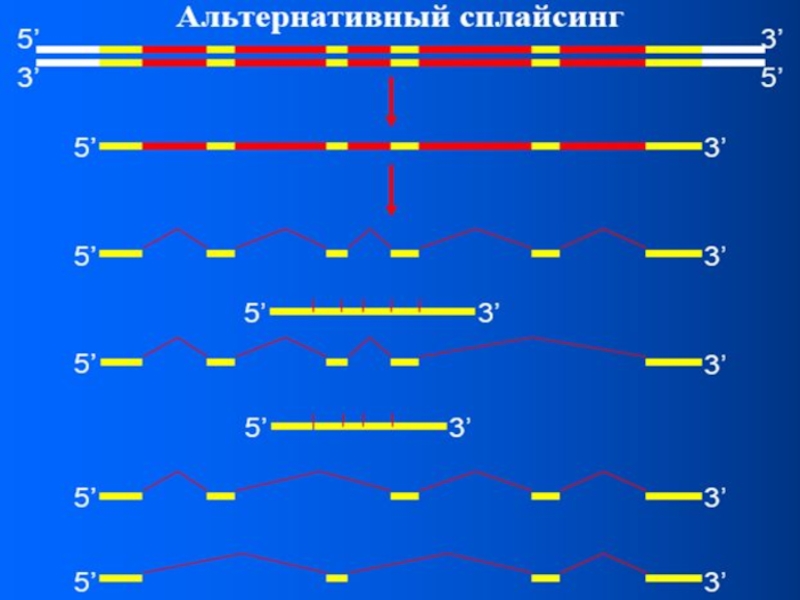
Слайд 50Альтернативный сплайсинг
Представим ситуацию, если мяРНКU1 свяжется с донорным сайтом 4
интрона, а мяРНКU2 свяжется с акцепторным сайтом 5 интрона. Такое
может произойти, тогда будет вырезаны 2 интрона и содержащийся между ними экзон. И тогда продуктом сплайсинга будет являться молекула мРНК, лишенная одного из кодирующих участков. «Это приведет к потере части информации» - абстрактное заключение, так как зрелые мРНК нужны для кодирования белков. Поэтому получится белок, у которого N-концевая часть белка будет одинакова, а если будет вырезаны 3 молекулы, то и С-конец будет также одинаков.
В среднем каждый ген человека способен обеспечивать синтез трех различных мРНК. Пример: ген кальцитонина может кодировать гормон кальцитонин и относящийся к кальцитониновому гену пептид альфа. В С-клетках щитовидной железы в результате сплайсинга объединяться экзоны 1-4, которые кодируют кальцитонин. В чувствительных же нейронах процессируется мРНК, где экзон 4 отсутствует, но добавятся 5 и 6 экзоны. В результате клетки будут синтезировать уже не кальцитонин, а относящийся к кальцитониновому гену пептид альфа.

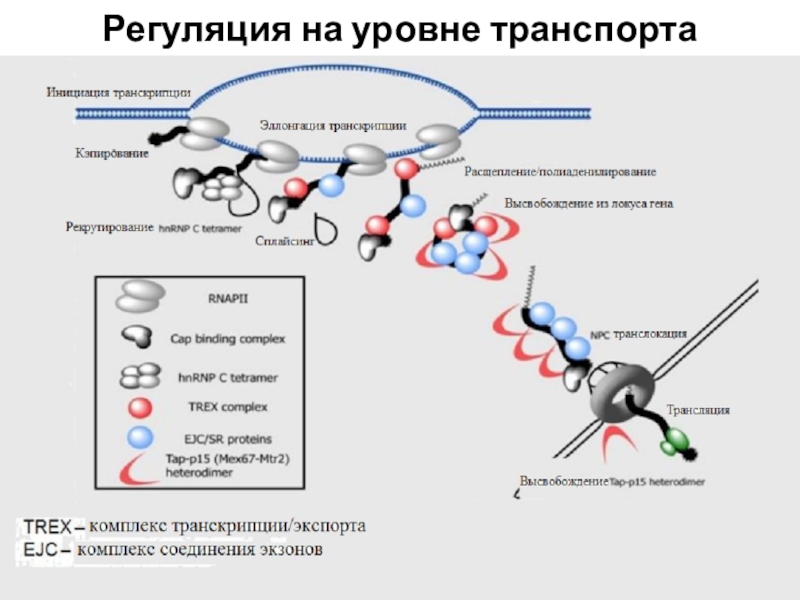
Слайд 53После сплайсинга появляется комплекс – TREX (Транскрипционно-экспортный комплекс). Транскрипционно-экспортный комплекс.
Он связывается с участком, где вырезался первый интрон. По мере
продвижения транскрипции происходит присоединение белков, маркирующих области, где произошло вырезание интронов (EJC/SR-расположен на стыке 2-х экзонов, они же связываются с SR-белками регуляторами сплайсинга, за счет чего идет компактизация). С этими белками будут взаимодействовать белки-переносчики. После проверки того, что все интроны вырезались, мРНК сможет двигаться дальше. Еще один TREX присоединяется у полиА последовательности, ограничивая зрелую мРНК. С белками-маркерами начинает взаимодействовать Tap-p15, который участвует в переносе через ядерную пору. Весь этот комплекс движется 5’ концом к поре. После выхода из поры происходит диссоциация и переносчик освобождается.
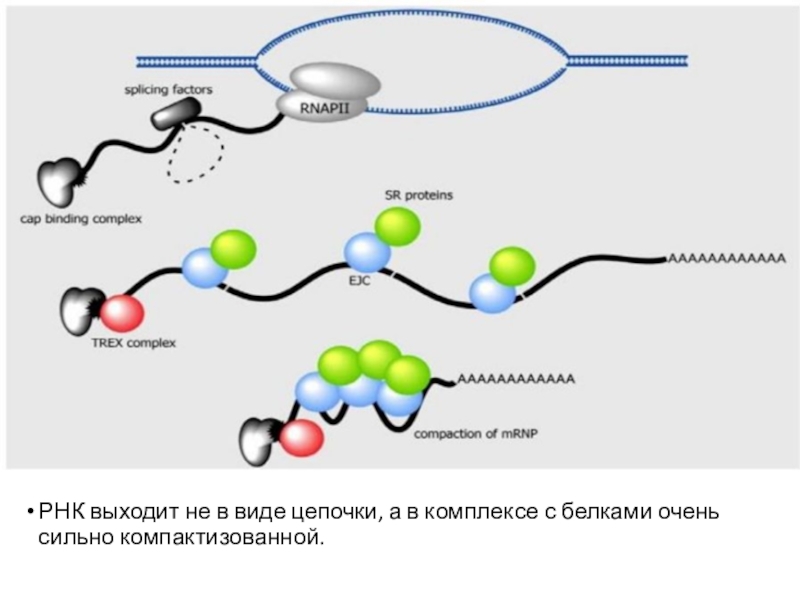
Слайд 54РНК выходит не в виде цепочки, а в комплексе с
белками очень сильно компактизованной.
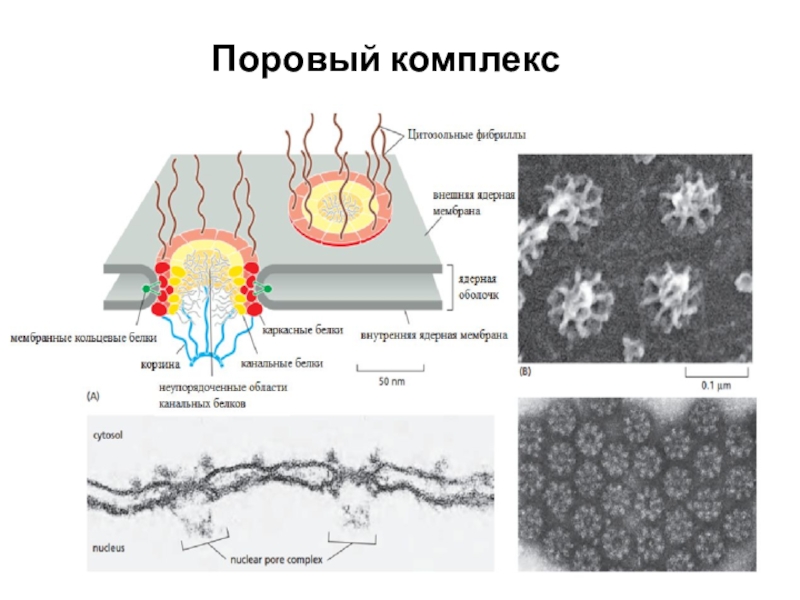
Слайд 56РНК должны попасть из ядра в цитоплазму. Для этого нужно
преодолеть ядерную мембрану. Мембрана пронизана большим количеством пор. У млекопитающих
от 3000 до 5000 таких пор.
Цитоплазматическая часть. Содержатся вытянутые цитоплазматические фибриллы. Со стороны ядра ядерные фибриллы. Они более длинные. Ядерные фибриллы собраны кольцом, образуют подобие сетки. Фибриллы являются первыми, кто встречает молекулы, которые нужно перенести.
Центральная часть. Образована кольцами: Ядерное, Цитоплазматическое, Центральное. Центральный канал образован нуклеопоринами, которые различаются по свойствам и функциям т.е. структурные и содержащие большое количество гидрофобных аминокислот, которые способствуют взаимодействию с белками, которые транспортируются.
Слайд 57Регуляция на уровне трансляции
Редактирование РНК;
Общий контроль - факторы инициации соединяются
с метилированным гуанином на 5-конце м-РНК, в результате происходит соединение
с малой субъединицей рибосомы, другой набор белков - FI присоединяется к полиаденилатной последовательности на 3-конце. В этом случае м-РНК является активно транслируемой.
Негативная регуляция: синтезируемый полипептид связывается с собственной м-РНК и блокирует дальнейший синтез.
Фосфорилирование белков- факторов инициации (eIF) специальным ферментом приводит к нарушению связывания мет-тРНК с малой субъединицей рибосомы и синтез белка блокируется.
Слайд 58Чаще всего происходит на стадии инициации. Реже –элонгация (сдвиг рамки
считывания, постинициационное ингибирование за счет микро-РНК) и терминация (проскакивание стоп-кодона);
Чаще
ингибирование, но иногда и стимуляция;
Общая регуляция-через факторы инициации или рибосомные белки;
Специфическая регуляция – через сиквенс-специфические мРНК-связывающие белки или микроРНК/миРНК.
Слайд 59Наиболее обычный путь тотальной регуляции белкового синтеза у эукариот- это
активация специальной фосфокиназы, которая фосфорилирует фактор инициации eIF2, что приводит
к подавлению инициации трансляции всех мРНК клетки. Сигналами для активации фосфокиназы в клетке являются тепловой шок и другие виды стрессовых воздействий.
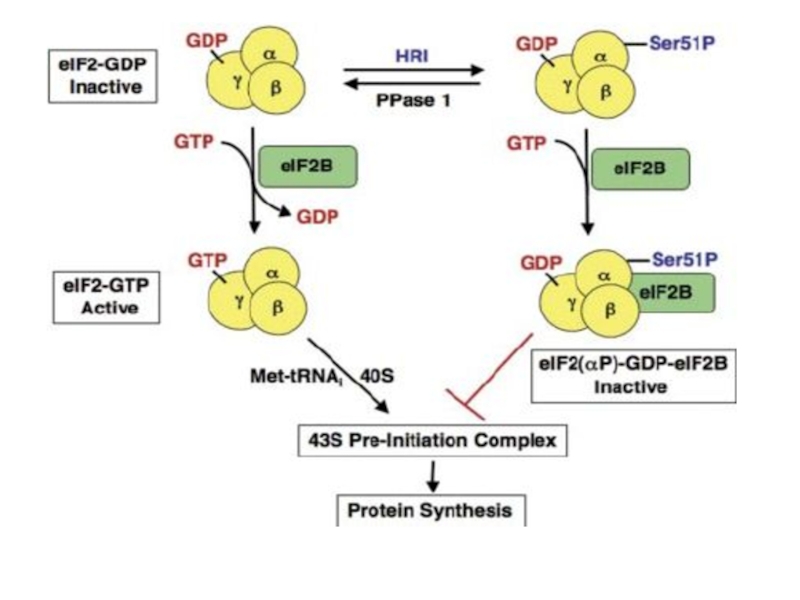
Слайд 61Для связывания инициаторной аминоацил-тРНК (Met-tRNAi) с малой рибосомной субчастицей в
процессе инициации трансляции требуется eIF2 в комплексе с ГТФ (GTP);
в ходе инициации ГТФ гидролизуется на ГДФ (GDP) и ортофосфат и eIF2 в комплексе с ГДФ (eIF2 : GDP) освобождается из рибосомы. в норме дополнительный фактор eIF2В принимает участие в том, чтобы превратить отработанный (неактивный) eIF2 : GDP в необходимый для следующей инициации eIF2 : GTP. Этот фактор играет каталитическую роль в обмене ГДФ на ГТФ, и его в клетке мало. Когда eIF2 фосфорилируется фосфокиназой (eIF2Р), он может обычным образом участвовать в инициации трансляции, но, освободившись из рибосомы с ГДФ (в форме eIF2Р : GDP), он образует прочный комплекс с eIF2В (eIF2В : eIF2Р : GDP) и тем самым связывает весь eIF2В клетки, лишая последнюю возможности катализировать регенерацию eIF2 : GTP из eIF2 : GDP.
Слайд 62Регуляция на уровне деградации
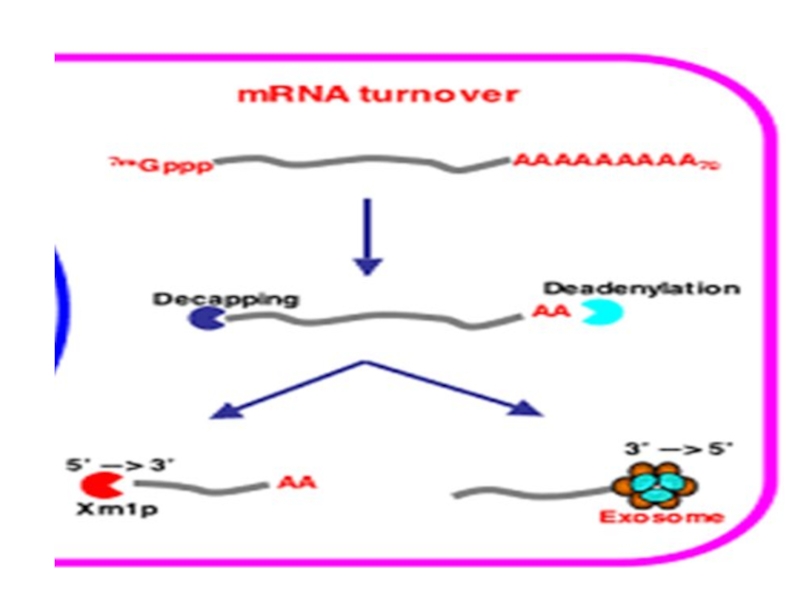
Декэпирование — комплекс DCP-1 и 2. Кэп
защищается факторами eIF-4E и eIF-4G. В путях контроля качества или
при повреждении. Далее декепированое РНК пожирается экзонуклеазами Xrn1.
Деаденилироваеие (укорочение поли-А). Поли-А защищается белком PABP-1. Во многих путях контроля качества и деградации короткоживущих РНК. Далее идет пожирание экзосомой.
Оба этих процесса тесно связаны.
Так же существуют особые способы деградации: Присоединение коротких поли-А или длинных поли-U, что приводит к непосредственному привлечению к экзосоме.
Слайд 65В ядре
В ядре, как правило, отсеиваются не стабильные РНК не
относящиеся ни к одной из групп РНК. Они распознаются по
определенным последовательностям и отправляются на деградацию.
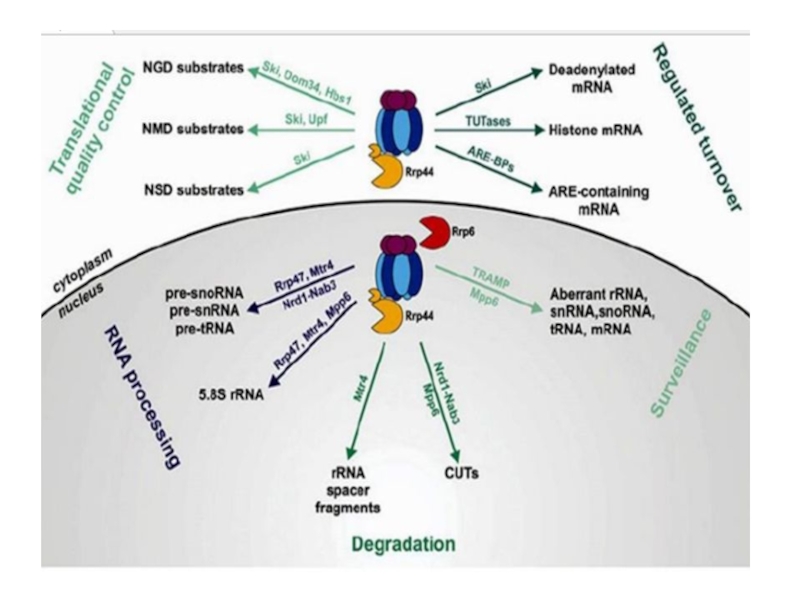
По мимо экзосомы за деградацию отвечают следующие белки:
1. Nrd1 и Nab3- распознают последовательности GUAA/G и UCUUG. Уничтожают не кодирующие короткие участки РНК(CUTs), а также предшественники sno/sn/tr RNA;
2. Мультисубъединичный комплекс TRAMP-связывается с РНК в ядре или ядрышке и способствует деградации неправильно процессированной РНК:
Trf 4 и 5. Это неканонические полиА-полимераза. Добавляет коротенькие полиА хвосты, которые являются сигналами для отправления молекул на деградацию. Полиаденилирование является необходимым условием функционирования мРНК у эукариот.
Air 1 и 2. Они взаимозаменяемы. Это РНК связывающие белки.
Mtr 4. Это геликаза. Обладает АТФ-азной активностью. Именно эта геликаза обеспечивает продвижение РНК, которую надо деградировать в полость экзосомы.
Слайд 66В цитоплазме
Можно разделить на 2 категории:
Регуляция оборота (обновления) РНК:
Ликвидация деаденилированых
мРНК;
Ликвидация мало живущих гистоновых мРНК- вместо полиаденилирования у них консервативная
шпилька (Histone 3' UTR stem-loop) и пурин-богатый участок (HDE). Со шпилькой взаимодействует SLBP, с HDE — U7RNP. Фосфорилилрование SLBP в G2-фазе стимулирует присоединение короткого поли-U, далее декэпирование и деградация;
ARE-содержащие мРНК (?).
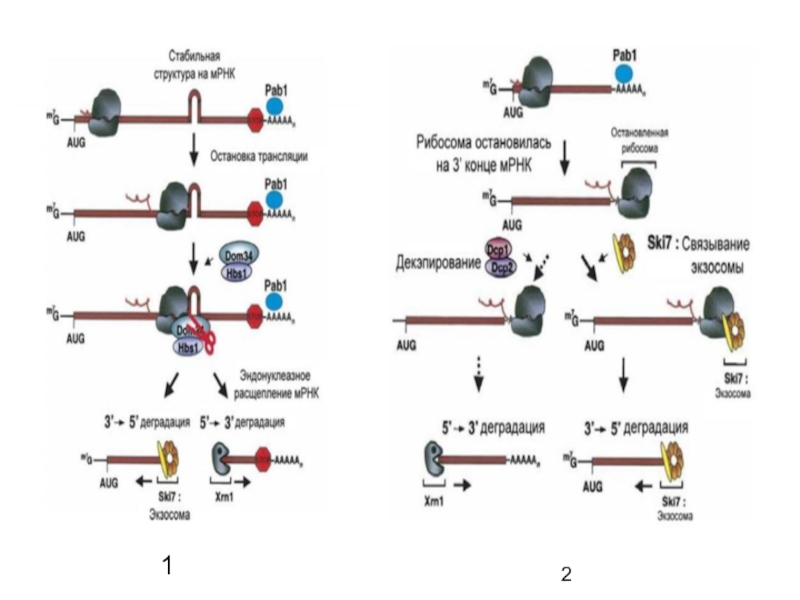
Контроль качества трансляции, который можно осуществить 3 разными способами: NMD, NGD, NSD.
Слайд 67No-Go decay (NGD) - расщеплением без движения, нацелен на мРНК
со шпильками для деградации, инициированными эндонуклеолитическим расщеплением в окрестности застопоренной
рибосомы;
Non-Stop decay (NSD) - безостановочное расщепление направлено на обнаружение молекул мРНК, у которых отсутствует стоп-кодон.
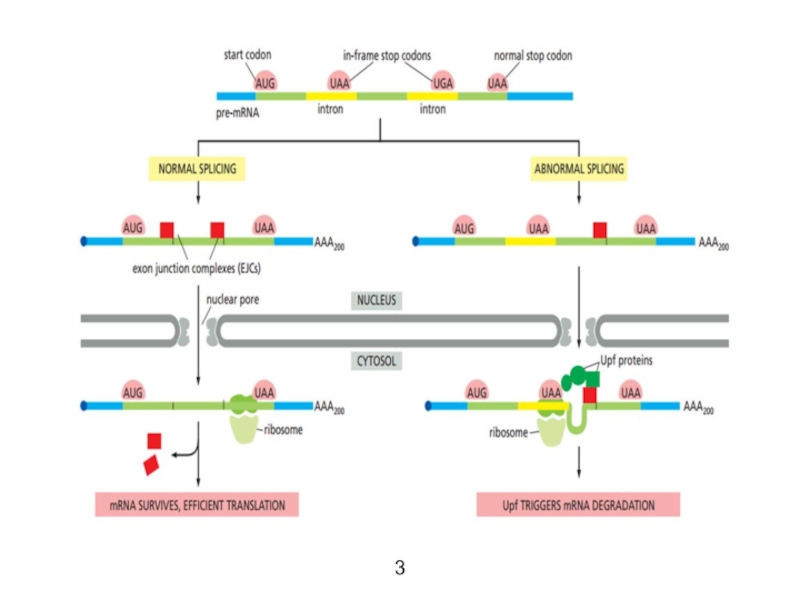
Nonsense-mediated decay (NMD) - нонсенс-опосредованный распад. По пути NMD расщепляются мРНК, содержащие стоп-кодоны в неправильных местах (и, следовательно, неправильно сплайсированные. Таким образом, NMD предохраняет клетку от синтеза усечённых белков, которые могут оказаться опасными для клетки.
Слайд 70Регуляция на уровне активности белка
Фолдинг;
Вторичные ковалентные модификации;
Нековалентное присоединение кофакторов (в
т.ч. ионов);
Образование белковых комплексов или фолдинг из нескольких полипептидных цепей;
(
Модификации повреждающими факторами ).
Слайд 71Модификации концевых NH2- и COOH — групп;
Присоединение к радикалам аминокислотных
остатков:
Малых функциональных групп (ацетилирование, метилирование, фосфорилирование и др.)
Гидрофобных остатков;
Углеводов и
гликолипидов;
Пептидов и небольших белков;
Простетических групп (флавины, биотин и др).
Циклизации, связи между радикалами аминокислотных остатков, отщепления и замещения в радикалах;
Ограниченный протеолиз;
Сплайсинг белков.
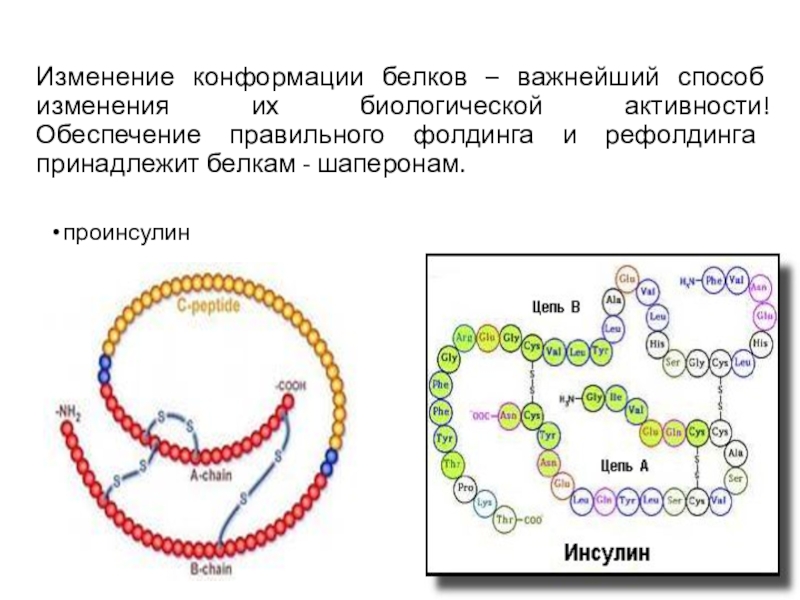
Слайд 72Изменение конформации белков – важнейший способ изменения их биологической активности!
Обеспечение
правильного фолдинга и рефолдинга принадлежит белкам - шаперонам.
проинсулин
Слайд 73Гормональная регуляция:
Стероидные гормоны связываются с белком-рецептором в клетке, данный комплекс
проникает в ядро, связывается с определенными участками ДНК, регулируя транскрипцию.
Пептидные
гормоны связываются с белками – рецепторами на мембране и передают сигнал внутрь клетки на белки цитоплазмы, в ответ на внутриклеточные изменения в ядро поступает сигнал, регулирующий экспрессию.