Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Репликация. транскрипция
Содержание
- 1. Репликация. транскрипция
- 2. Содержание лекции1. Репликация ДНК2.Принципы транскрипции3. Биосинтез
- 3. Слайд 3
- 4. Каждая репликативная
- 5. Матричная цепь
- 6. Поэтому на второй матричной цепи
- 7. Слайд 7
- 8. Слайд 8
- 9. Далее
- 10. Далее ДНК – полимераза 1
- 11. В
- 12. Слайд 12
- 13. Каждая репликативная
- 14. Слайд 14
- 15. Слайд 15
- 16. На некотором расстоянии
- 17. Субстратами для РНК-полимераз служат рибонуклеозид-трифосфаты (активированные нуклеотиды).
- 18. Слайд 18
- 19. Слайд 19
- 20. Транскрипция осуществляется ДНК-зависимыми
- 21. Слайд 21
- 22. РНК-полимераза -1 катализирует синтез
- 23. РНК-полимераза-2 синтезирует
- 24. Слайд 24
- 25. Как уже
- 26. После инициации синтеза (2),
- 27. Слайд 27
- 28. Слайд 28
- 29. Большинство клеток
- 30. Контроль транскрипции
- 31. Факторы транскрипции
- 32. Дополнительные факторы
- 33. Слайд 33
- 34. Слайд 34
- 35. Сплайсинг РНК
- 36. В этой реакции принимают
- 37. Слайд 37
- 38. Слайд 38
- 39. Слайд 39
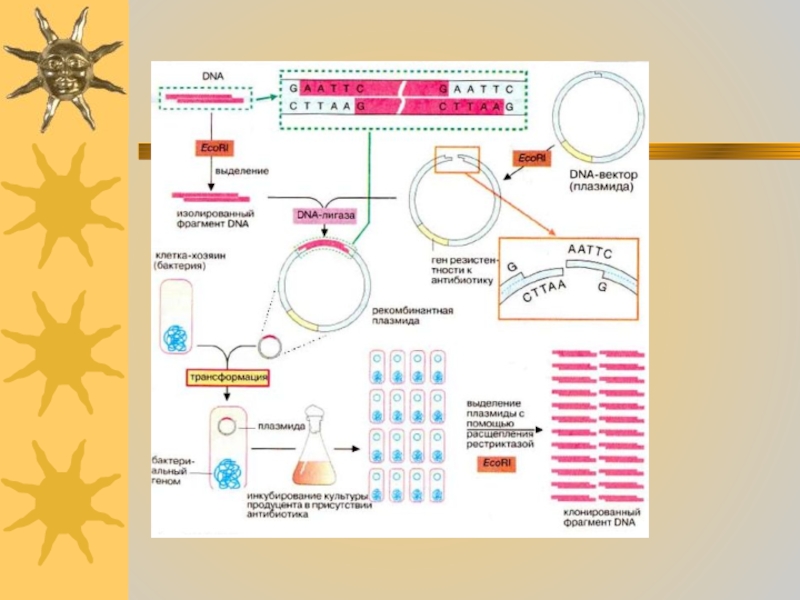
- 40. В генной инженерии часто
- 41. В качестве векторов для получения библиотек ДНК
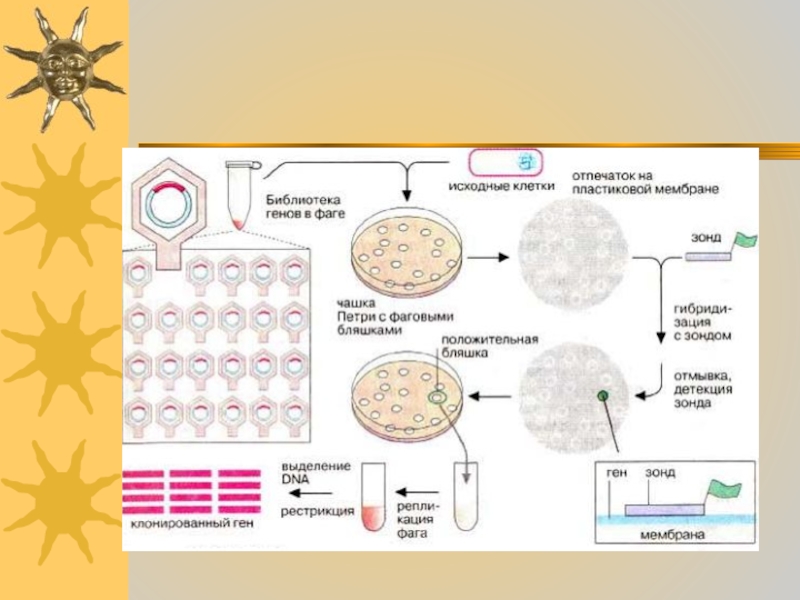
- 42. Клетки в «бляшке» содержат потомство фагов из
- 43. Место связывания зонда можно определить по радиоактивной
- 44. Слайд 44
- 45. Слайд 45
- 46. Слайд 46
- 47. Слайд 47
- 48. Слайд 48
- 49. Слайд 49
- 50. Слайд 50
- 51. Скачать презентанцию
Содержание лекции1. Репликация ДНК2.Принципы транскрипции3. Биосинтез белка. Стадии биосинтеза4. Основные элементы генома. Геном митохондрий5. Патология обмена белков
Слайды и текст этой презентации
Слайд 2 Содержание лекции
1. Репликация ДНК
2.Принципы транскрипции
3. Биосинтез белка. Стадии биосинтеза
4.
Основные элементы генома. Геном
Слайд 3
Процесс репликации начинается со
специфической точки в кольцевойДНК ( область начала репликации ).
При этом образуются две
репликационные вилки, которые
двигаются в противоположных
направлениях, поэтому две цепи
реплицируются одновременно
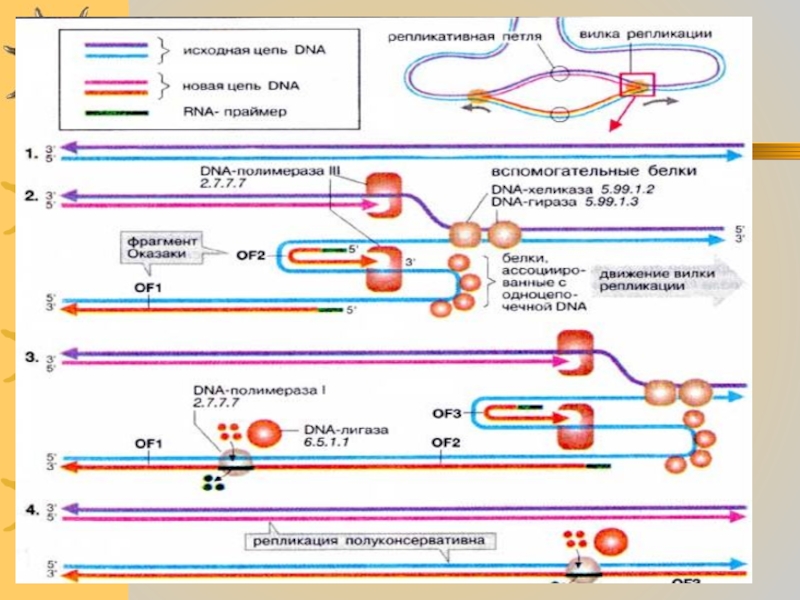
Слайд 4
Каждая репликативная вилка включает
по две молекулы ДНК-полимеразы (3), которые связаны с вспомогательными
белками. К последним относят- ДНК-топоизомеразы( гиразы), которые раскручивают плотно свернутую двойную спираль ДНК, и хеликазы, которые расплетают двухтяжевую ДНК на две цепи.Слайд 5 Матричная цепь ДНК всегда
читается в направлении 3'—5',
поэтому только одна цепь считывается непрерывно ( это
ведущая цепь). На отстающей
цепи информация считывается в
направлении, противоположном
движению репликативной вилки.
Слайд 6 Поэтому на второй матричной цепи вначале синтезируются короткие
фрагменты новой цепи ДНК, так называемые фрагменты Оказаки (ОF). Каждый
такой фрагмент начинается с короткой РНК- затравки( праймера), которая необходима для действия ДНК-полимеразы –IIIСлайд 8
Праймер синтезируется
специальной РНК-полимеразой,
с образованием олигорибонуклеотида, и
достраивается ДНК-
полимеразой –III, до фрагмента
с длиной 1000-2000
дезоксирибонуклеотидных звеньев.
Слайд 9
Далее синтез этого
фрагмента прекращается, и новый синтез начинается со следующего РНК-праймера.
Индивидуальные фрагменты Оказаки первоначально не связаны друг с другом и все имеют РНК на своих 5- концах.Слайд 10 Далее ДНК – полимераза 1 начинает замещать РНК-праймер
последовательностью ДНК. В завершение остающиеся одноцепочечные разрывы репарируются ДНК- лигазой
Слайд 11 В синтезированной таким
образом двойной
спирали ДНК только
одна из цепей синтезирована
заново. Это
полуконсервативный
путь репликации.
Слайд 12
В бактериях
репликация начинается со специфической точки в кольцевой ДНК (область начала
репликации) и продолжается в обоих направлениях.В результате образуются две репликативные вилки, которые продвигаются в противоположных направлениях, т. е. обе цепи реплицируются одновременно. Исходная ДНК (1) окрашена в голубой и фиолетовый цвета, а вновь синтезирующаяся — в розовый и оранжевый. В функционировании каждой вилки принимают участие множество различных белков, из которых здесь указаны наиболее важные.
Слайд 13 Каждая репликативная вилка (2) включает
по крайней мере две молекулы ДНК-полимеразы III, ассоциированные с несколькими
вспомогательными белками. К последним относятся ДНК- топоизомеразы (гиразы), которые раскручивают плотно свернутую двойную спираль ДНК, и хеликазы, которые расплетают двухтяжевую ДНК на две цепи.Поскольку матричная цепь всегда читается в направлении 3'→5', только одна из цепей может считываться непрерывно (розовая/фиолетовая;
Слайд 14
Другая цепь (голубого цвета) считывается в направлении, противоположном движению репликативной
вилки. В результате на матрице вначале синтезируются короткие фрагменты новой цепи ДНК (зеленый/оранжевый), так называемые фрагменты Оказаки (OF). Каждый фрагмент начинается с короткой РНК-затравки (праймера, зеленого цвета), необходимой для функционирования ДНК-полимеразы.Слайд 15
Праймер синтезируется специальной РНК-полимеразой («праймаза», ДНК-полимераза III
достраивает этот праймер до фрагмента ДНК длиной 1000-2000 дезоксинуклеотидных звеньев (оранжевого цвета). Синтез этого фрагмента далее прерывается, и новый синтез начинается со следующего РНК-праймера. Индивидуальные фрагменты Оказаки первоначально не связаны друг с другом и все еще имеют РНК на 5'-концахСлайд 16
На некотором расстоянии от репликативной вилки
ДНК-полимераза I начинает замещать РНК-праймер последовательностью ДНК.
В завершение остающиеся
одноцепочечные разрывы репарируются ДНК- лигазой. В образованной таким образом двойной спирали ДНК только одна из цепей синтезирована заново. Поэтому говорят, что репликация ДНК происходит по полуконсервативному механизму.
Слайд 17
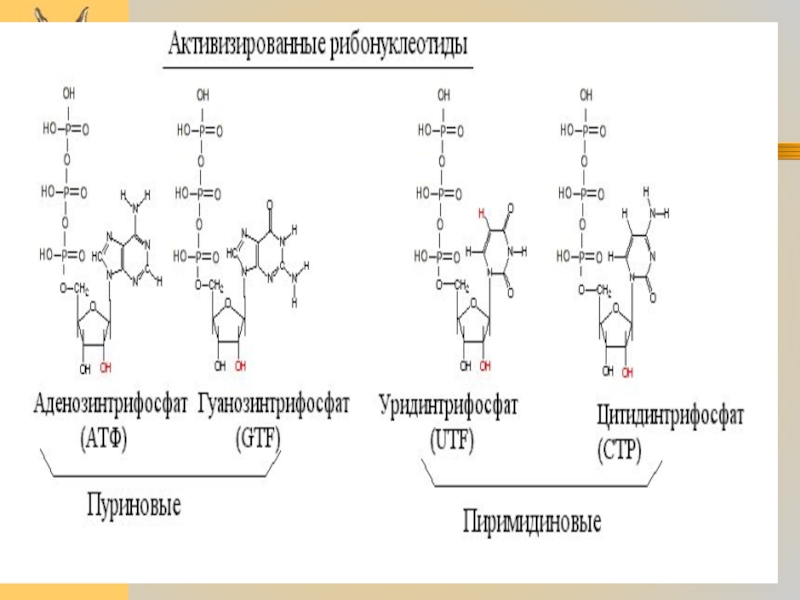
Субстратами для РНК-полимераз служат рибонуклеозид-трифосфаты (активированные нуклеотиды). Весь процесс транскрипции
осуществляется за счет энергии макроэргических связей актвированных нуклеотидов.
Условия транскрипции
Слайд 19
Принципы
транскрипции: 1. Комплементарность.
2. Антипараллельность.
3. Униполярность.
4. Беззатравочность.
5. Асимметричность.
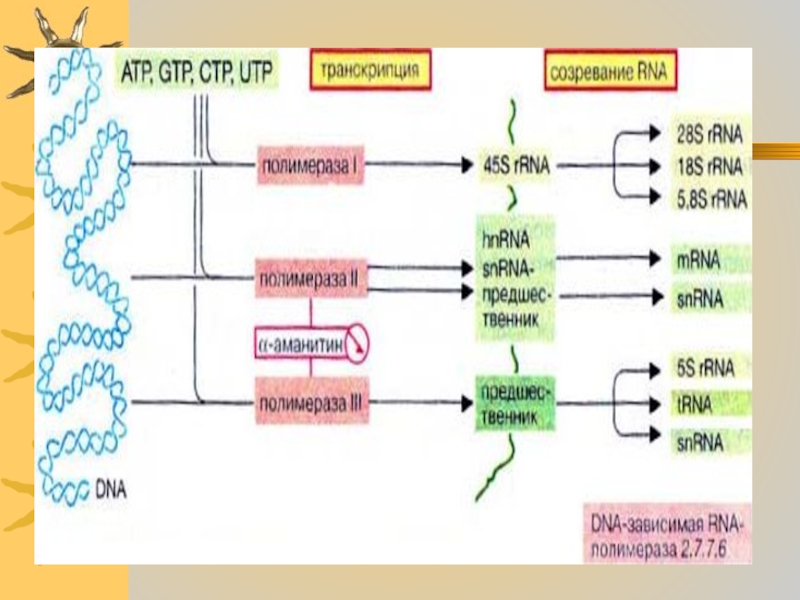
Слайд 20 Транскрипция осуществляется ДНК-зависимыми РНК-полимеразами. Они действуют
подобно ДНК-полимеразам, за исключением того,что включают в синтезируемую цепь РНК
(RNA) рибонуклеотиды, вместо дезоксирибонуклеотидов , а также не нуждаются в праймерах. Эукариотические клетки обычно содержат три различных типа РНК-полимераз.Слайд 22
РНК-полимераза -1 катализирует синтез РНК с коэффициентом
седиментации 45S, которая является предшественником трех различных рибосомных РНК
( 28S rRNA, 18S rRNa,5,8S rRNA).
Слайд 23 РНК-полимераза-2 синтезирует гяРНК, которые
служат предшественниками мРНК и мяРНК.
РНК-полимераза-3
транскрибирует гены, кодирующие тРНК, 5S РНК и некоторые мяРНКСлайд 25
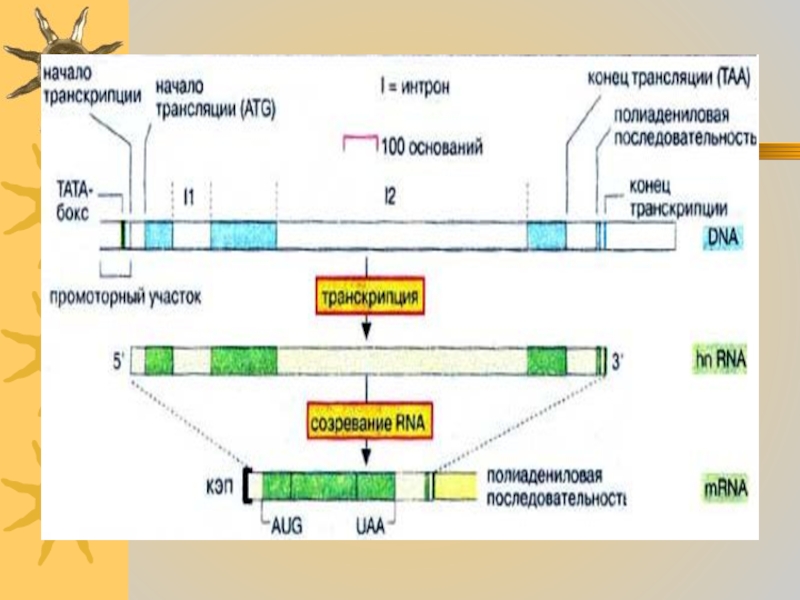
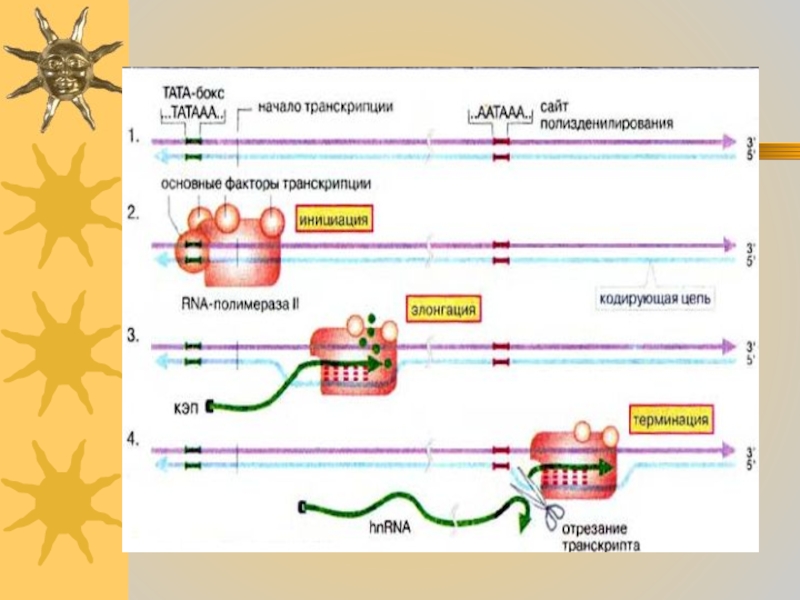
Как уже упоминалось, РНК-полимераза
II связывается с 3'-концом промоторного участка. Последовательность, обеспечивающая это связывание,
так называемый ТАТА-бокс, короткий А- и Т-обогащенный участок, последовательность которого слегка варьирует у разных генов. Типичная последовательность (каноническая) — ...ТАТААА... . Для взаимодействия полимеразы с этим участком необходимы несколько белков, основных факторов транскрипции. Дополнительные факторы могут либо стимулировать, либо ингибировать этот процесс (контроль транскрипции)Слайд 26
После инициации синтеза (2), РНК-полимераза движется в
направлении 3'→5' матричной цепи.
В процессе инициации фермент разделяет короткий
участок двойной спирали ДНК на две отдельные цепочки. Нуклеозидтрифосфаты связываются комплементарно на кодирующей цепочке ДНК водородными связями и шаг за шагом присоединяются к растущей молекуле РНК (3). Вскоре после начала элонгации 5'-конец транскрипта защищается «кэпом».Как только транскрипция доходит до сайта полиаденилирования (обычно это последовательность ...ААТААА...),После этого полимераза прекращает транскрипцию и диссоциирует от ДНК.
Слайд 29
Большинство клеток организма содержит полный
набор генов. Но обычно из этого набора используется крайне незначительный
объем информации. Постоянно транскрибируются только те гены, которые кодируют структурные белки и ферменты промежуточного метаболизма. Кроме этих постоянно необходимых генов имеется много других генов, активных только в определенных типах клеток, при определенных метаболических условиях или во время дифференцировкиСлайд 30 Контроль транскрипции осуществляется структурами двух
типов. Большинство генов содержат в своем промоторном участке несколько коротких
сегментов ДНК (DNA) (регуляторные элементы, цис-действующие элементы), с которыми могут связываться факторы транскрипции. Регуляторные элементы, стимулирующие транскрипцию связанных с ними генов, называются энхансерами (усилителями, от англ. enhancer). Белки, подавляющие транскрипцию. — сайленсерами (успокоителями, от англ. silencer).Слайд 31 Факторы транскрипции — это белки,
т. е. продукты других, независимых генов.
Поэтому их называют опосредованно действующими факторами. Для процесса транскрипции генов требуются не только РНК- полимераза, но и другие белки, называемые основными факторами транскрипции. Установлено, что у эукариот таким фактором является ТАТА-связывающий белок (ТСБ, англ. ТАТА-Вох Binding Protein, TBP), который взаимодействует с основным регуляторным элементом. ТАТА-боксом, присутствующим в большинстве генов
Слайд 32 Дополнительные факторы могут влиять на
инициацию транскрипции, связываясь с
другими регуляторными элементами.
Отсюда они взаимодействуют с основным транскрипционным комплексом, либо активируя, либо ингибируя его. Такие факторы активируют, например, комплексы стероидных гормонов с рецепторами.По завершении транскрипции из гяРНК вырезаются интроны, содержащие некодирующие последовательности.
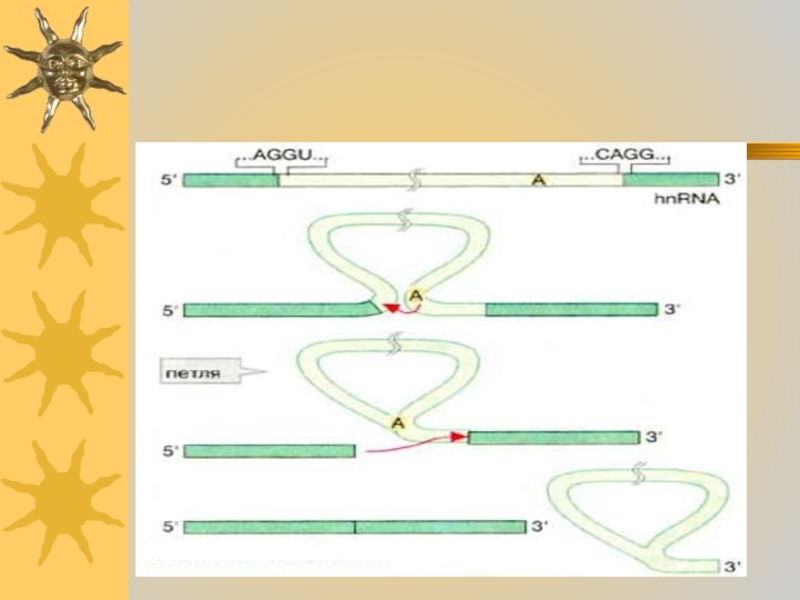
Слайд 35 Сплайсинг РНК катализируется комплексами белков
с РНК, известными как «малые ядерные рибонуклеопротеидные частицы»
Интроны, входящие в гяРНК (hnRNA), имеют специфические последовательности на 3'- и 5'-концах .На первой стадии сплайсинга ОН-группа аденозилового остатка, расположенного в интроне, атакует (при участии мяРНП) и расщепляет фосфодиэфирную связь на 5'-конце интрона (Одновременно в интроне образуется новая связь, которая придает ему форму петли На второй стадии терминальная ОН-группа 5'-концевого интрона атакует связь в 3'-конце интрона. В результате оба экзона соединяются, а интрон освобождается.
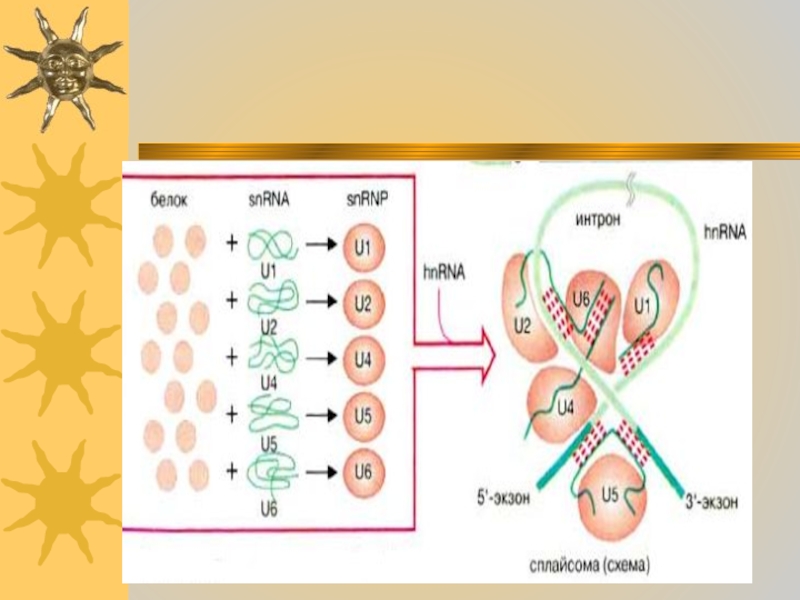
Слайд 36 В этой реакции принимают участие пять различных
мяРНП (U1, U2, U4, U5 и U6). В каждой из
реакций задействованы несколько белковых молекул и одна молекула мяРНК (snRNA).Во время сплайсинга комплексы из гяРНК и мяРНП образуют сплайсому. Полагают, что мяРНК в сплайсоме образуют канонические пары друг с другом и с гяРНК и таким образом фиксируют и ориентируют их реакционные группы. Собственно катализ обусловлен РНК-составляющей сплайсомы Такие каталитические РНК носят название рибозимов