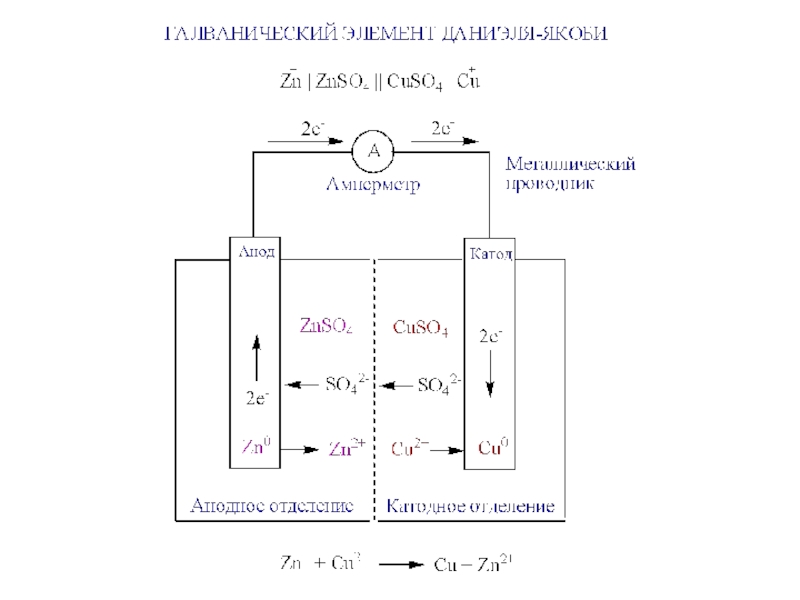
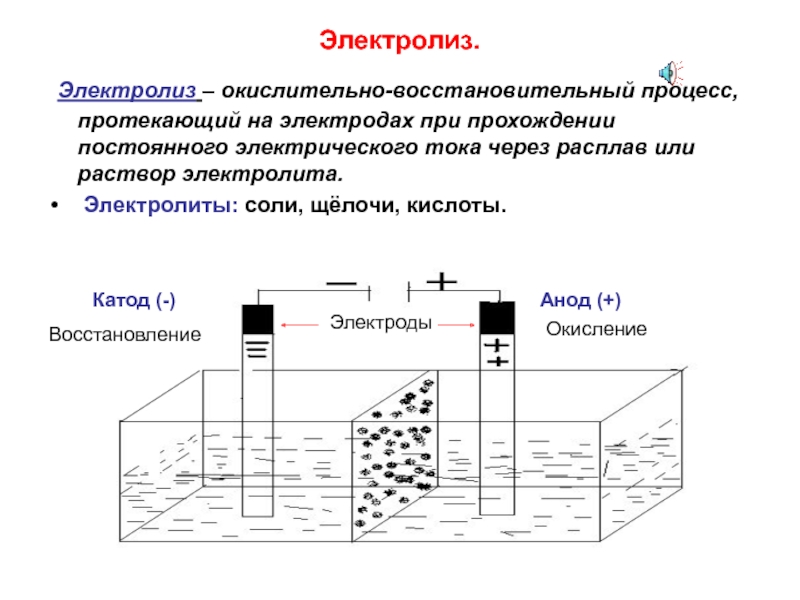
элементов.
К ним относится множество реакций,
в том числе все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество: 0 +1 +2 0 0 0 +2 -2
а) Mg + H2SO4 = MgSO4 + H2 б) 2Мg + O2 = 2MgO
0 +2 0 +2
Mg – 2e¯ Mg – окисление Mg – 2e¯ Mg 2 –
+1 0 0 -2
2Н + 2e¯ H2 – восстановление O2 + 4e¯ 2O 1 –