Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
S - элементы
Содержание
- 1. S - элементы
- 2. S - элементыI Щелочные металлыII Щелочноземельные металлы
- 3. Элементы I группы ПСЭ:
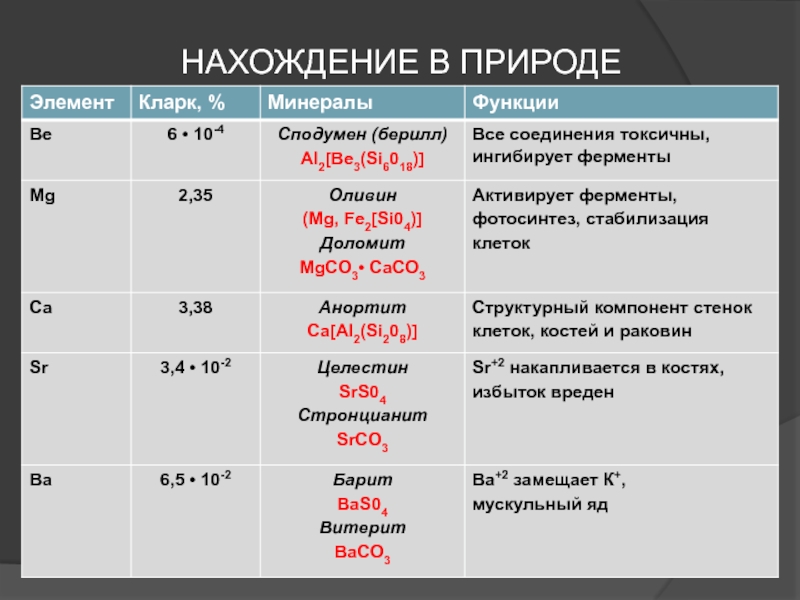
- 4. НАХОЖДЕНИЕ В ПРИРОДЕ
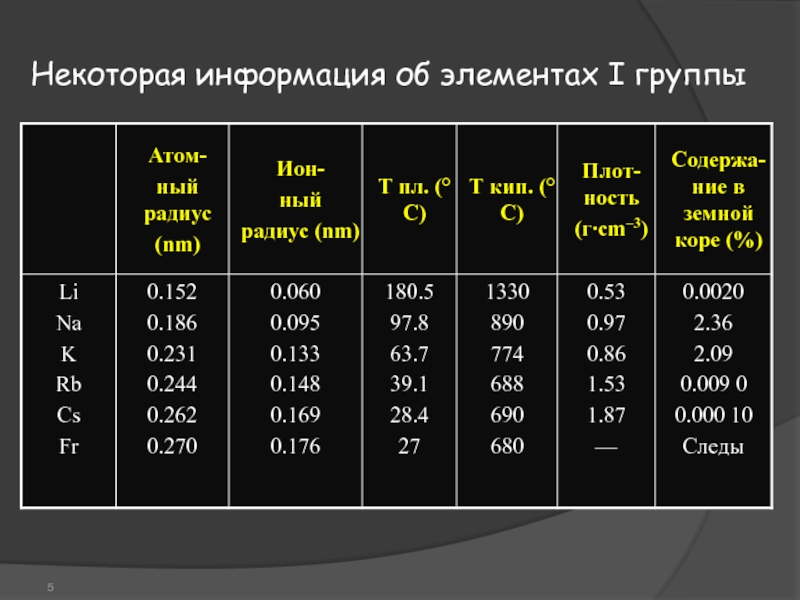
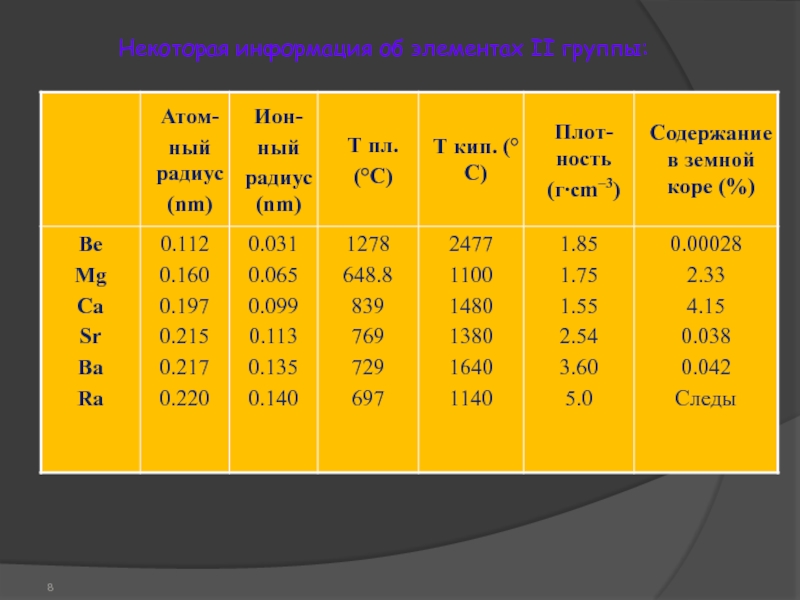
- 5. Некоторая информация об элементах I группы
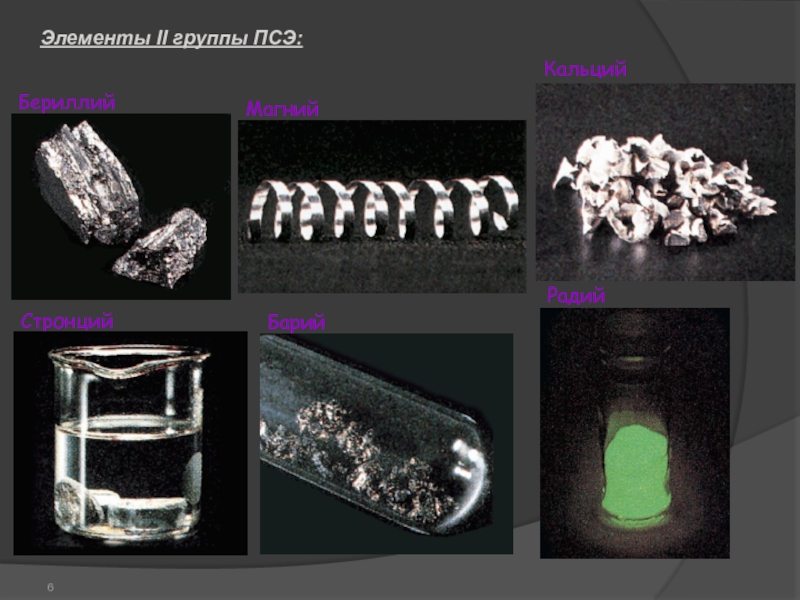
- 6. Элементы II группы ПСЭ:
- 7. НАХОЖДЕНИЕ В ПРИРОДЕ
- 8. Некоторая информация об элементах II группы:
- 9. ЛитийЛитий был открыт в 1817 году шведским химиком А.
- 10. НатрийНатрий был открыт в 1807 году английским химиком Хемфри
- 11. КалийВ 1807 году английский химик Хемфри Дэви электролизом расплава едкого кали (KOH)
- 12. РубидийВ 1861 году немецкие учёные Роберт Вильгельм Бунзен и Густав
- 13. ЦезийЦезий был открыт в 1860 году немецкими учёными Р. В. Бунзеном и Г. Р. Кирхгофом в водах Бад-Дюркхаймского минерального
- 14. ФранцийБыл открыт (по его радиоактивности) в 1939 г. Маргаритой Пере,
- 15. БЕРИЛЛИЙБериллий – хрупкий твердый металл светло-серого цвета.
- 16. Магний, кальцийМагний – открыт В 1808 году. Английский
- 17. Стронций Стронций обнаружил Адер Кроуфорд в
- 18. В 1808 году английский химик Хемфри Дэви электролизом влажного гидроксида бария
- 19. Получить чистый радий в 1902 году стоило
- 20. Хемфри Дэви (1778-1829) Профессор вслух прочитал письмо
- 21. Получение элементов I группыЭлектролизом расплавов солей.NaCl = Na + Cl
- 22. Слайд 22
- 23. Получение элементов II группыBe: минерал берил (3
- 24. Характерные свойств s-элементов I и II группМеталлический характерНизкая электроотрицательностьОсновные оксиды,
- 25. Металлические свойстваВысокая способность к потере электронов и
- 26. ЭлектроотрицательностьСлабое притяжение ядром внешних электроновВысокая электроположительностьНизкая электроотрицательность
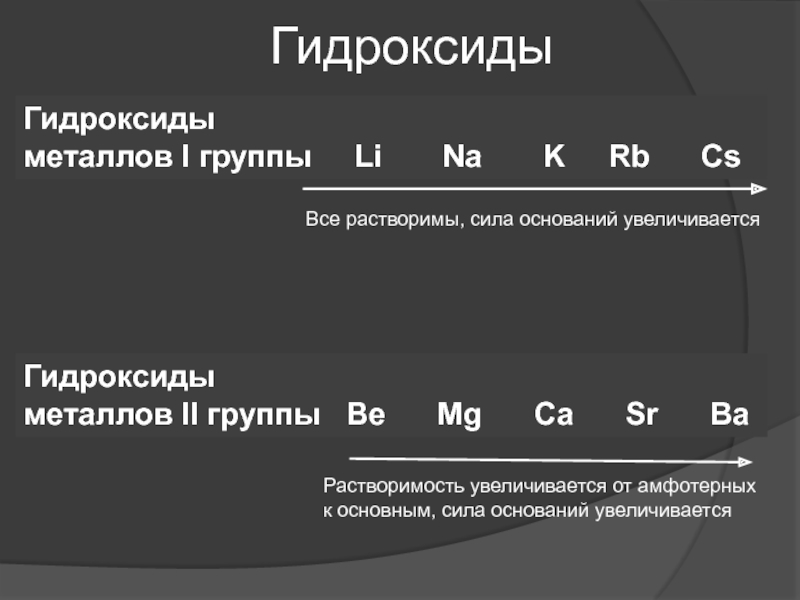
- 27. Основные оксиды, гидроксиды
- 28. ВеО BeO амфотерный оксид – реагирует
- 29. Оксиды, пероксиды, надпероксидыРеакции с водой:Оксиды:
- 30. Гидроксиды
- 31. Ве(ОН)2Ве(ОН)2 + 2NaOH = Na2Be(OH)4Ве(ОН)2 + H2SO4
- 32. Ионные соединения с фиксированной степенью окисленияГруппа I:
- 33. Характерные цвета пламениNa+ Cl- (г) Na (г) +
- 34. Тест в пламениLi - ярко красныйNa -
- 35. Идентификация IА элементов по цвету пламениЦвет пламени
- 36. Слабая тенденция к образованию комплексовИоны s-элементов обладают низкой энергией
- 37. Изменение свойств элементовАтомный радиусЭнергия (потенциал) ионизацииЭнергия гидратацииТемпература плавления
- 38. Атомный радиус (нм)LiFrBeRa
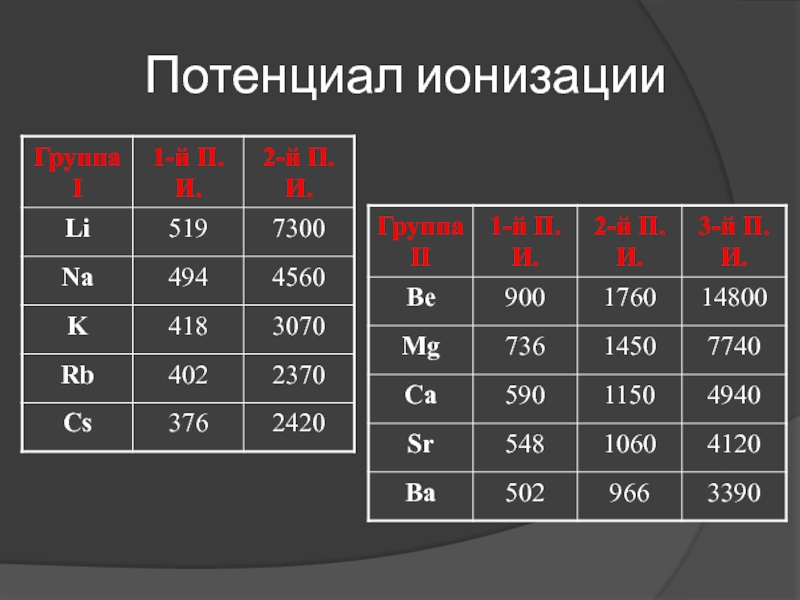
- 39. Потенциал ионизации
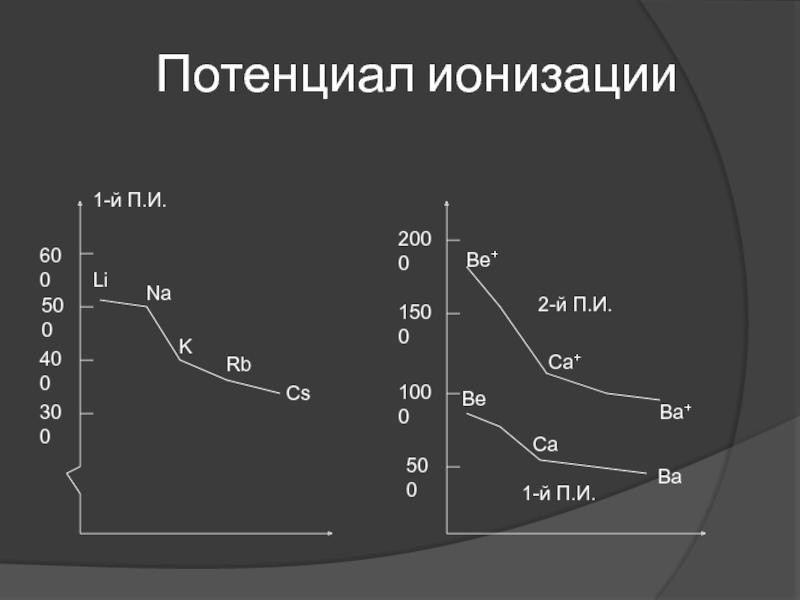
- 40. Потенциал ионизации
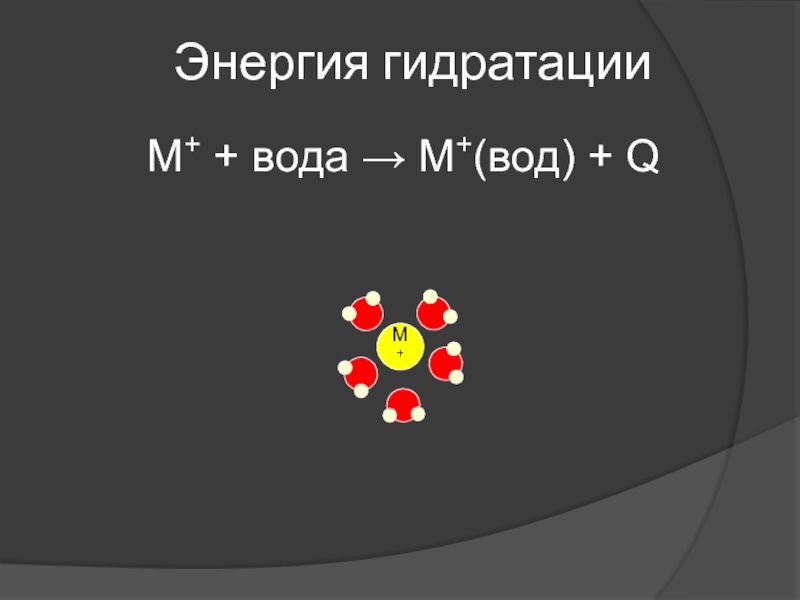
- 41. Энергия гидратацииM+ + вода M+(вод) + Q
- 42. Энергия гидратацииОбщие тенденции: 1. При
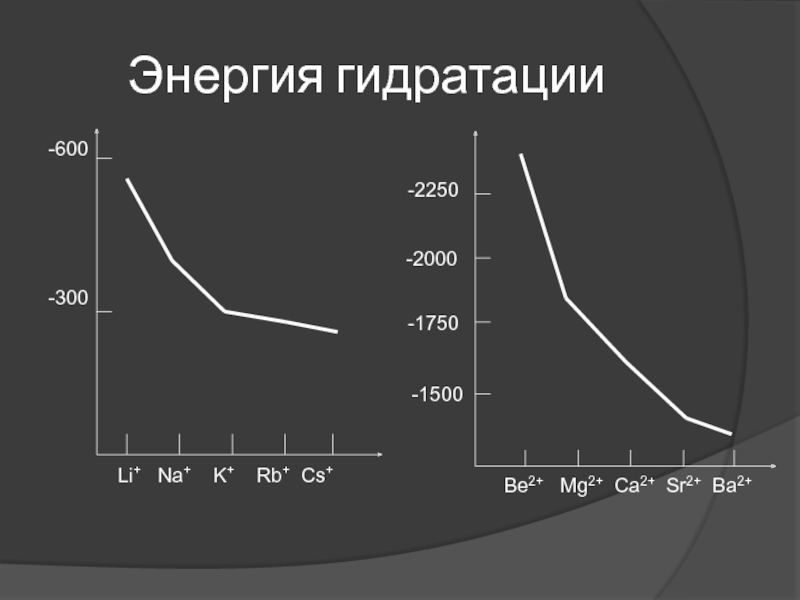
- 43. Энергия гидратации
- 44. Изменение температуры плавленияНизкие значения tпл обьясняются слабыми
- 45. Изменение температуры плавления
- 46. Изменение температуры плавленияОЦКС – обьемноцентрированная кубическая структураГЗС – гексогонально-закрытая структураГЦКС - гранецентрированная кубическая структура
- 47. ОЦКСГЦКСГЗС
- 48. Реакционная способность s-металловS-элементы сильные восстановители. Их восстанавливающая способность увеличивается сверхувниз
- 49. Диагональная связьЛитий по своим химическим свойствам схож с магнием
- 50. ДоказательстваКарбонат лития разлагается с выделением СО2 Li2CO3
- 51. Реакции с кислородомS-элементы легко реагируют с кислородом. Кроме Be и
- 52. Реакции с кислородом .. .. 2-:O-O:
- 53. Окраска усиливается, так как с увеличением размеров
- 54. Na2O + H2O = 2NaOH Na2O +
- 55. Оксиды получают сжиганием соответствующего металла в
- 56. MgO (аморф) + 2HCl = MgCl2 +
- 57. 2Na2О2 + 2СО2 = 2Na2СО3+ О24КО2 +
- 58. Слайд 58
- 59. Реакция с водойM (тв) M+(водн) +
- 60. Химические свойства основанийAlCl3 + 3NaOH = Al(OH)3↓
- 61. 2KOH + Cl2 = KCl + KClO
- 62. Са(ОН)2 + 2HCl = CaCl2 + 2H2O
- 63. Реакция с водородомВсе s-элементы за исключением Be
- 64. ГИДРИДЫГидриды – сильные восстановители. Реагируют: NaH
- 65. 2Na + Cl2 = 2NaCl 2K +
- 66. Щелочные металлы непосредственно соединяются с серой, фосфором,
- 67. 2Na + H3PO4 = Na2HPO4 + H22Na
- 68. t MgCl2 + 2Na = Mg
- 69. Практически все соли легкорастворимы(труднорастворимыми солями являются: перхлорат
- 70. Соединения, получаемые из NaCl
- 71. Метод Сольвэ
- 72. Слайд 72
- 73. Слайд 73
- 74. Сульфат натрия - Na2SO4 и его кристаллическая
- 75. Применяются следующие калийные удобрения:1. Сырые соли -
- 76. Соли: Сульфаты – существуют в виде
- 77. Карбонаты – труднорастворимые соединения.
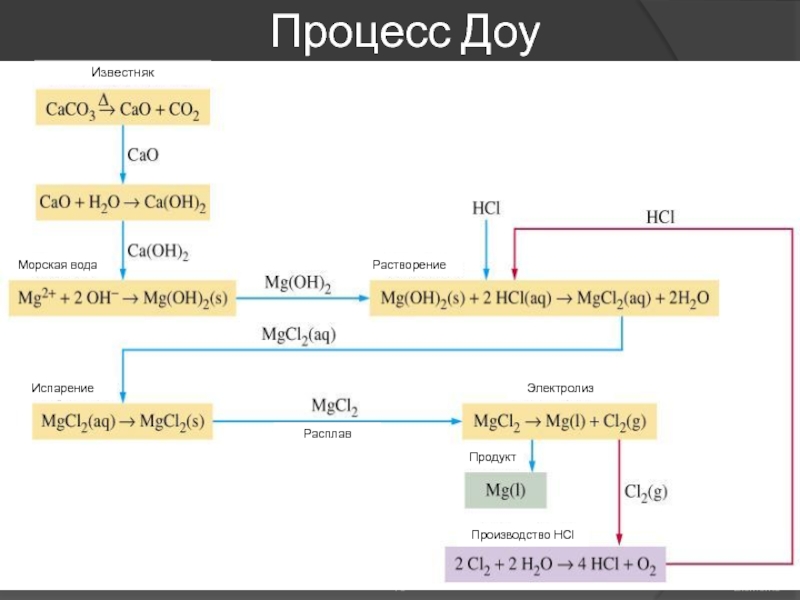
- 78. Chapter 20: s-Block ElementsПроцесс ДоуEOSИзвестнякМорская водаМорская водаИспарениеРастворениеЭлектролизРасплавПродуктПроизводство HCl
- 79. Жесткость воды Обусловлена присутствием в
- 80. Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O Ca(HCO3)2
- 81. Слайд 81
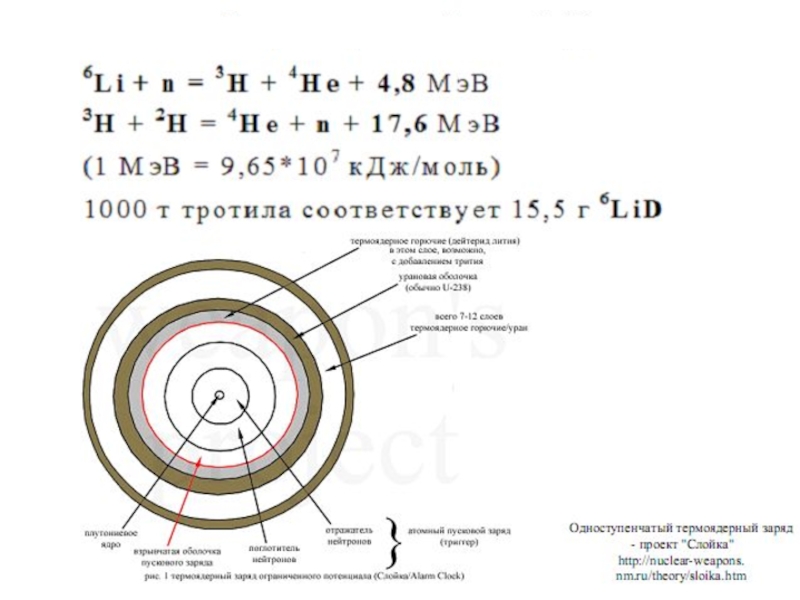
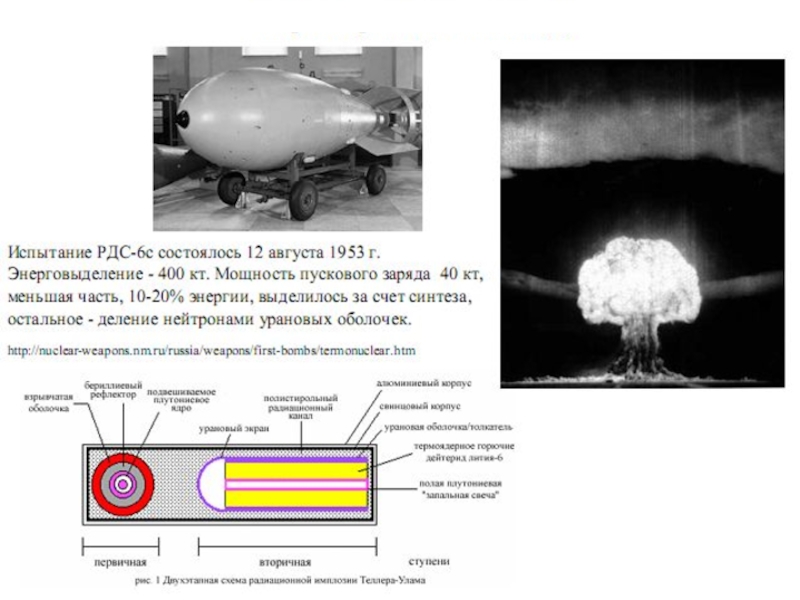
- 82. Появление термоядерного оружия стало возможным только благодаря
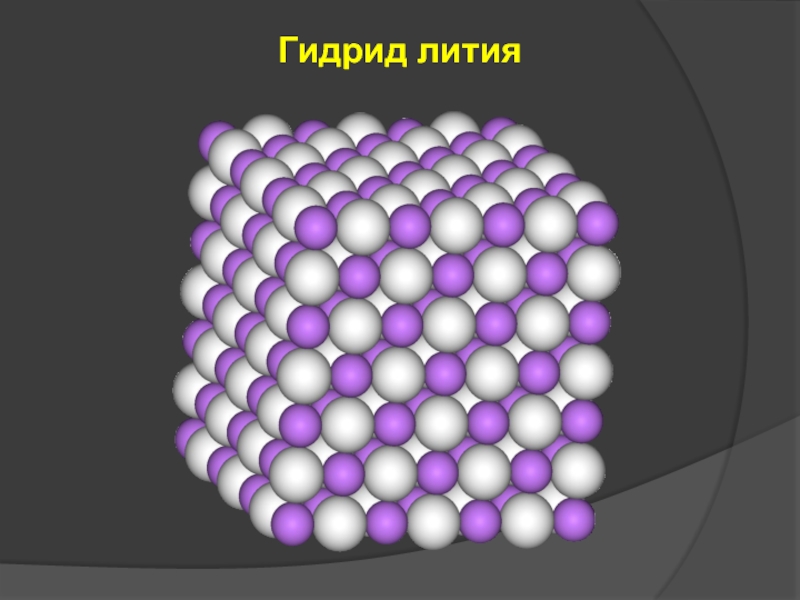
- 83. Гидрид лития
- 84. Слайд 84
- 85. Слайд 85
- 86. Слайд 86
- 87. Слайд 87
- 88. Для того, чтобы создать необходимые для начала
- 89. A Боеголовка перед взрывом. B Взрывчатое вещество
- 90. Андрей Дмитриевич Сахаров (1921-1989) Советский физик-теоретик, академик АН СССР, доктор физико-математических наук (1953), лауреат Нобелевской премии мира (1975).
- 91. Виталий Лазаревич Гинзбург (1916-2009) Советский и российскийфизик-теоретик, академик АН СССР и РАН, доктор физико-математических наук (1942), лауреат Нобелевской премии по физике (2003).
- 92. Лев Андреевич Арцимович (1909-1973) Советский физик, академик АН СССР. Под
- 93. Скачать презентанцию
Слайды и текст этой презентации
Слайд 9Литий
Литий был открыт в 1817 году шведским химиком А. Арфведсоном.
Металлический литий
впервые получил Хемфри Дэви в 1825 году.
был обнаружен в «камнях» (греч. λίθος — камень). Первоначально назывался «литион», современное название было предложено Берцелиусом.Слайд 10Натрий
Натрий был открыт в 1807 году английским химиком Хемфри Дэви.
Название «натрий»
происходит от латинского слова natrium (ср. др.-греч. νίτρον), которое было заимствовано из среднеегипетского языка (nṯr),
где оно означало среди прочего: «сода», «едкий натр».Слайд 11Калий
В 1807 году английский химик Хемфри Дэви электролизом расплава едкого кали (KOH) выделил калий и
назвал его «потассий» (лат. potassium; это название до сих пор употребительно в
английском, французском, испанском, португальском и польском языках).В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium, от араб. аль-кали — поташ).
Слайд 12Рубидий
В 1861 году немецкие учёные Роберт Вильгельм Бунзен и Густав Роберт Кирхгоф, изучая
с помощью спектрального анализа природные алюмосиликаты, обнаружили в них новый элемент.
Название
дано по цвету наиболее характерных красных линий спектра (от лат. rubidus — красный, тёмно-красный). Слайд 13Цезий
Цезий был открыт в 1860 году немецкими учёными Р. В. Бунзеном и Г. Р. Кирхгофом в водах Бад-Дюркхаймского минерального источника в Германии методом оптической спектроскопии.
В
чистом виде цезий впервые был выделен в 1882 году шведским химиком К. Сеттербергом
при электролизе расплава смеси цианида цезия (CsCN) и бария.Своё название цезий получил за наличие двух ярких синих линий в эмиссионном спектре (от лат. caesius — небесно-голубой).
Слайд 14Франций
Был открыт (по его радиоактивности) в 1939 г. Маргаритой Пере, сотрудницей Института радия
в Париже. Она же дала ему в 1964 г. название в честь своей родины — Франции.
Франций —
один из редчайших элементов. Это второй самый редкий элемент в природе, после астата, который постоянно находится в земной коре.Слайд 15БЕРИЛЛИЙ
Бериллий – хрупкий твердый металл светло-серого цвета. При хранении на
воздухе покрывается оксидной пленкой.
Открыт в 1798 г. французским химиком Луи
Никола Вокленом. Название бериллия произошло от названия минерала берилла, которое восходит к названию города Белур (Веллуру) в Южной Индии.
Слайд 16Магний, кальций
Магний – открыт В 1808 году. Английский химик Хемфри Дэви при электролизе слегка
увлажнённой белой магнезии с ртутным катодом получил амальгаму нового металла (она
содержит до 3 % магния), который выделил отгонкой ртути и назвал магнезием.Название элемента происходит от греческого calcis — «мягкий камень». Оно было предложено английским химиком Хэмфри Дэви в 1808 году выделившим металлический кальций электролизом.
Слайд 17Стронций
Стронций обнаружил Адер Кроуфорд в минерале – стронцианите
- SrCO3, найденном близ шотландской
деревни Строншиан, давшей впоследствии название
новому элементу. Слайд 18В 1808 году английский химик Хемфри Дэви электролизом влажного гидроксида бария с ртутным катодом получил амальгаму бария;
после испарения ртути при нагревании он выделил металлический барий.
Слайд 19Получить чистый радий в 1902 году стоило огромного труда. Мария
Кюри трудилась 12 лет, чтобы получить всего 1 г чистого
радия: нужно было несколько вагонов урановой руды, 100 вагонов угля, 100 цистерн воды и 5 вагонов разных химических веществ. Поэтому на начало ХХ в. в мире не было более дорогого металла. За 1 г радия нужно было заплатить больше 200 кг золота. За открытие радия и полония супруги Кюри получили Нобелевскую премию.Слайд 20Хемфри Дэви (1778-1829)
Профессор вслух прочитал письмо и спросил своего
ассистента: "Как вы полагаете, что мне ответить этому студенту?"
Ассистент сказал:
"Возьмите его и поручите ему для начала мыть колбы и пробирки. Если он согласится, то в будущем из него выйдет толк"Однажды профессор Хемфри Дэви получил письмо от одного из студентов - Майкла Фарадея. Он писал, что прослушал курс лекций уважаемого профессора и хотел бы поработать у него в лаборатории Королевского института.
Слайд 23Получение элементов II группы
Be: минерал берил (3 BeO·Al2O3·6 SiO2) вначале
преобразуется в BeF2, который восстанавливается до Be магнием
Ca: электролизом
расплава CaCl2Sr и Ba: электролизом раславов солей или из оксидов восстановлением Al при высокой температуре
Mg: электролизом расплава MgCl2
Слайд 24Характерные свойств s-элементов I и II групп
Металлический характер
Низкая электроотрицательность
Основные оксиды, гидроксиды
Ионные соединения с фиксированной степенью
окисления
Характерная окраска пламени
Слабая тенденция к образованию комплексов
Слайд 25Металлические свойства
Высокая способность к потере электронов и образованию положительно заряженных
ионов
Металлические свойства в обеих группах увеличивается сверху вниз
Слайд 26Электроотрицательность
Слабое притяжение ядром внешних электронов
Высокая электроположительность
Низкая электроотрицательность
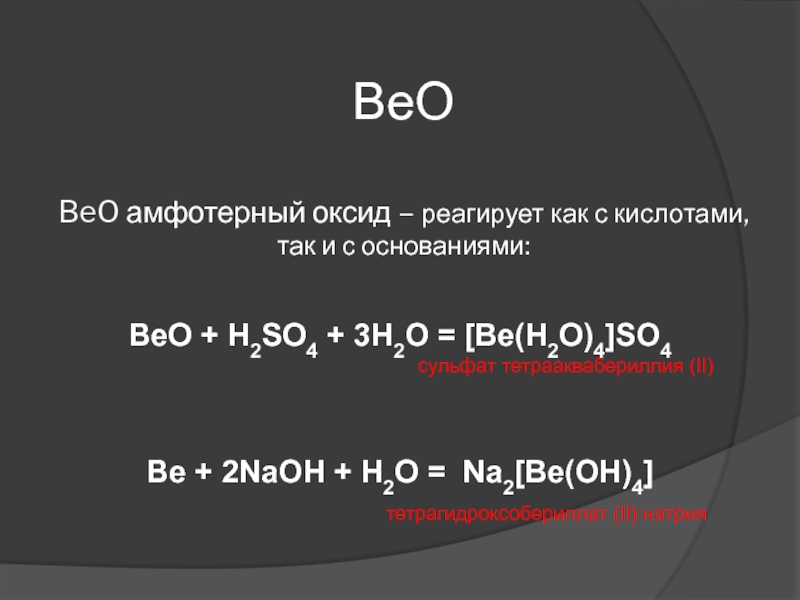
Слайд 28ВеО BeO амфотерный оксид – реагирует как с кислотами, так и
с основаниями:
BeO + H2SO4 + 3H2O = [Be(H2O)4]SO4
сульфат тетрааквабериллия (II)
Be + 2NaOH + H2O = Na2[Be(OH)4] тетрагидроксобериллат (II) натрия
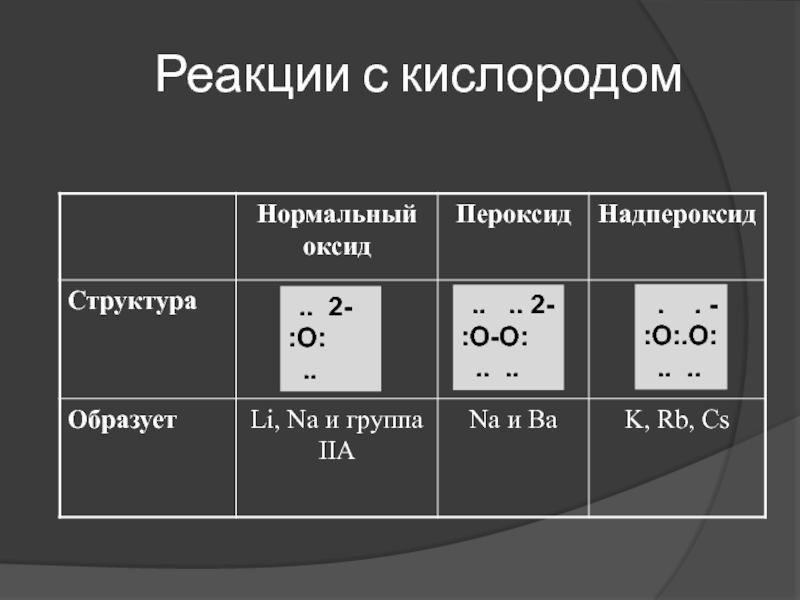
Слайд 29Оксиды, пероксиды, надпероксиды
Реакции с водой:
Оксиды:
O2- + H2O 2OH-
Пероксиды: O22-
+ 2H2O H2O2 + 2OH-Надпероксиды: 2O2- + 2H2O 2OH- + H2O2 + O2
Li не образует
пероксид и надпероксид
Li2O2 Li2O + ½ O2
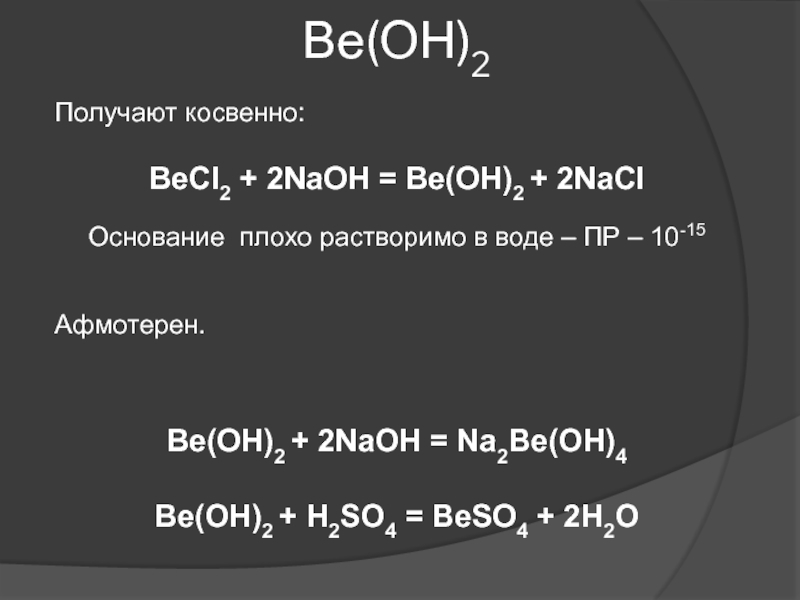
Слайд 31Ве(ОН)2
Ве(ОН)2 + 2NaOH = Na2Be(OH)4
Ве(ОН)2 + H2SO4 = BeSO4 +
2H2O
Получают косвенно:
BeCl2 + 2NaOH = Be(OH)2 + 2NaCl
Основание плохо
растворимо в воде – ПР – 10-15Афмотерен.
Слайд 32Ионные соединения с фиксированной степенью окисления
Группа I: Сильно электроположительные металлы.
Образуют преимущественно
ионные соединения с не металлами,теряя один электрон.Фиксированная степень окисления +1.
Низкое значение 1-го П.И.
Очень высокое значение 2-го П.И.
Группа II: Электроположительные металлы.
Фиксированная степень окисления + 2.
Соединения Be и Mg и обладают некоторыми ковалентными свойствами.
Низкое значение 1-го и 2-го П.И.
Экстремально высокое значение 3-го П.И.
Слайд 33Характерные цвета пламени
Na+ Cl- (г) Na (г) + Cl (г)
Na(г)
Na* (г)
[Ne]3s1 [Ne]3p1
Na*(г) Na(г) +
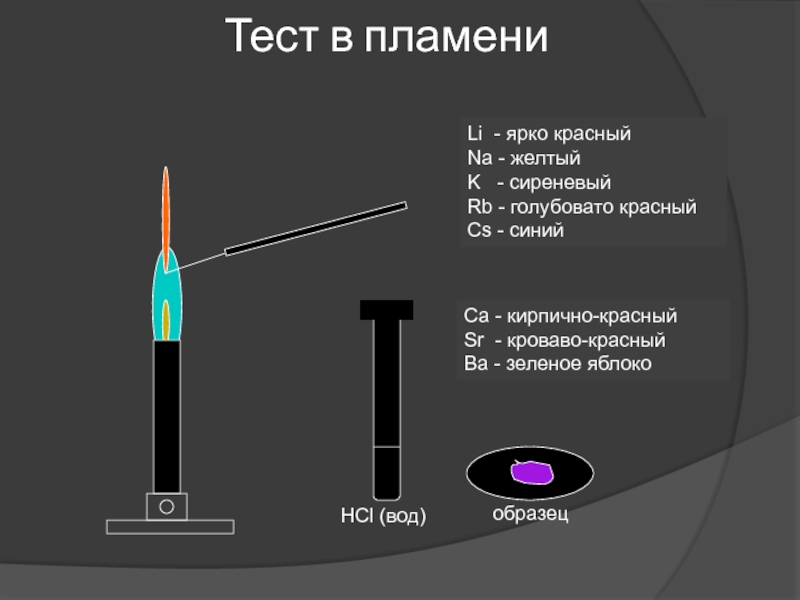
h (589нм, желтый)Слайд 34Тест в пламени
Li - ярко красный
Na - желтый
K -
сиреневый
Rb - голубовато красный
Cs - синий
Ca - кирпично-красный
Sr - кроваво-красный
Ba
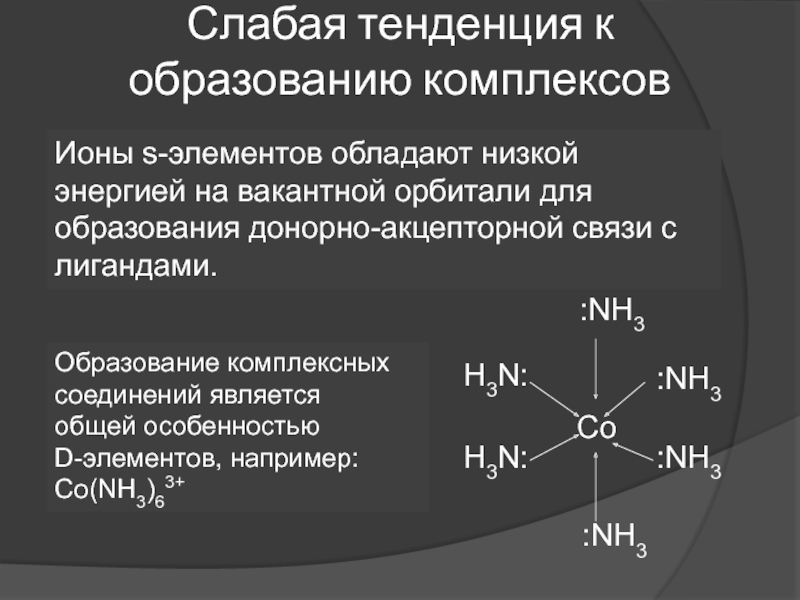
- зеленое яблокоСлайд 36Слабая тенденция к образованию комплексов
Ионы s-элементов обладают низкой энергией на вакантной орбитали
для образования донорно-акцепторной связи с лигандами.
Образование комплексных соединений является общей особенностью
D-элементов, например:
Co(NH3)63+
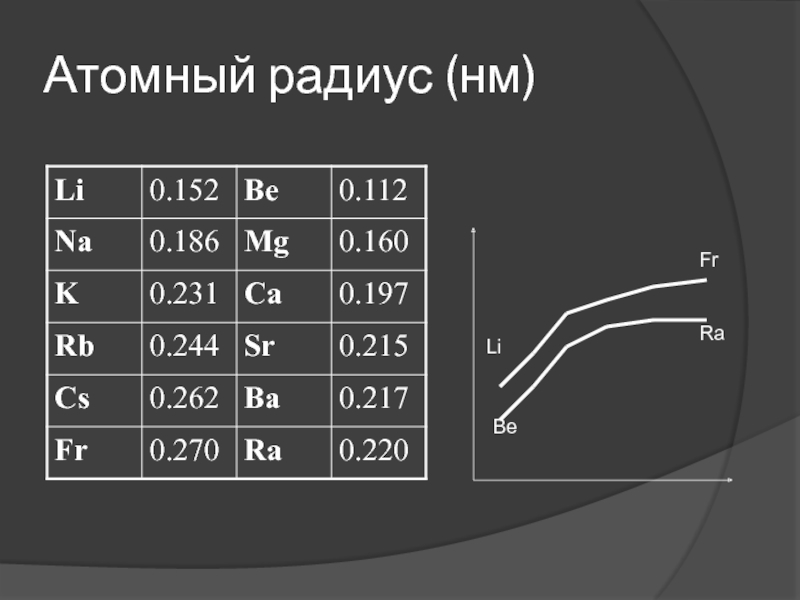
Слайд 37Изменение свойств элементов
Атомный радиус
Энергия (потенциал) ионизации
Энергия гидратации
Температура плавления
Слайд 42Энергия гидратации
Общие тенденции:
1. При переходе вниз в обеих группах, энергия гидратации
уменьшается.
(Когда ионы
увеличиваются, плотность заряда
уменьшается, электростатическое притяжение между
ионами и молекулами воды становится слабее.)
2. Энергия гидратации для ионов металлов 2А группы выше, чем для ионов 1А группы. (катионы 2А группы двузарядные и имеют меньшие размеры)
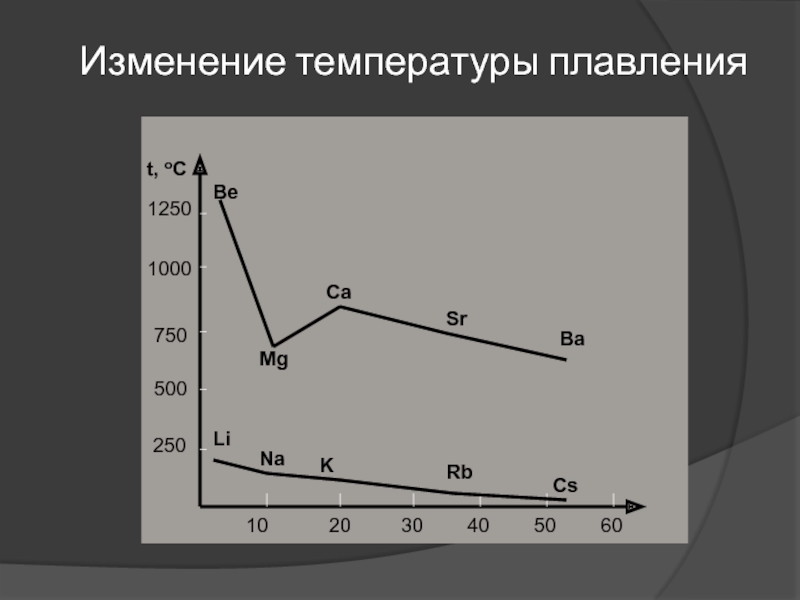
Слайд 44Изменение температуры плавления
Низкие значения tпл обьясняются слабыми металлическими свойствами в
кристаллических решетках.
Металлические связи образуются делокализованными внешними s-электронами, образующими «клей», который
удерживает вместе все ионы.С увеличением размера атома связь слабее.
Прочность металлической связи (ПМС):
число делокализованных e- на 1 атом
ПМС = ________________________________
радиус атома металла
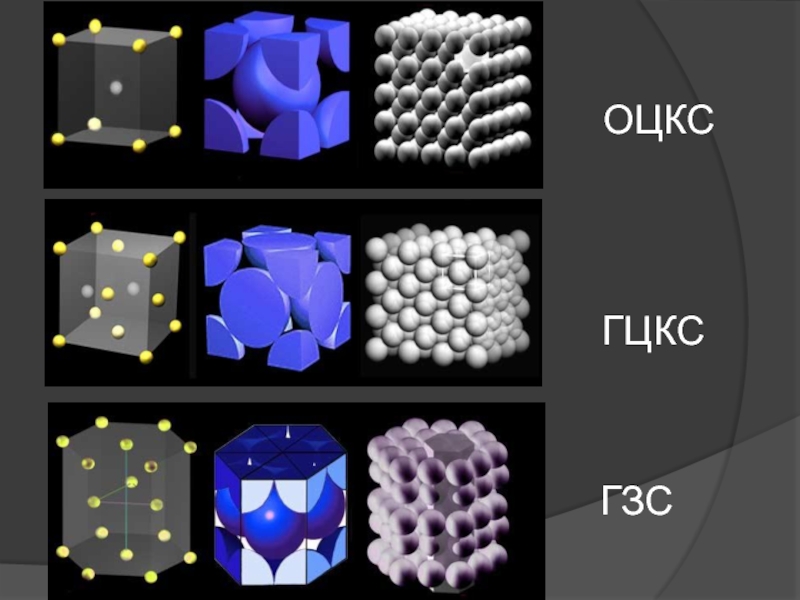
Слайд 46Изменение температуры плавления
ОЦКС – обьемноцентрированная кубическая структура
ГЗС – гексогонально-закрытая структура
ГЦКС
- гранецентрированная кубическая структура
Слайд 48Реакционная способность s-металлов
S-элементы сильные восстановители.
Их восстанавливающая способность увеличивается сверху
вниз в обеих группах.
(С увеличением
размера атома легче отдача внешнего электрона)
Слайд 50Доказательства
Карбонат лития разлагается с выделением СО2
Li2CO3 → Li2O +
CO2
Литий реагирует с азотом при нормальной температуре
6Li + N2 = 2Li3N
Литий – единственный щелочной металл, который образует имид Li2NH. Получают из амида LiNH2:
2LiNH2 = Li2NH + NH3
Гидроксид лития разлагается до оксида
2LiОН → Li2O + Н2O
Слайд 51Реакции с кислородом
S-элементы легко реагируют с кислородом.
Кроме Be и Mg, они должны храниться в
керосине,
чтобы предотвратить контакт с атмосферой.
4Li + O2 = 2Li2O
2Na +
O2 = Na2O2K + O2 = KO2
2Ca + O2 = 2CaO
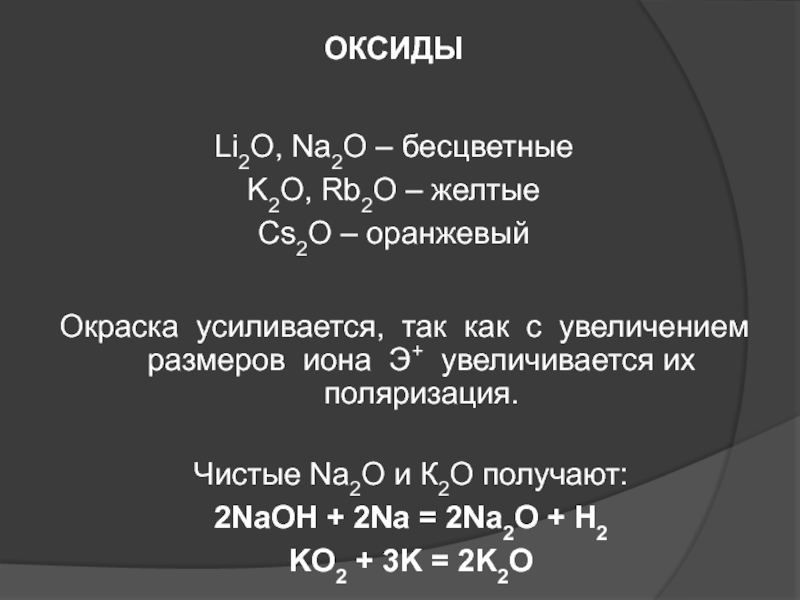
Слайд 53Окраска усиливается, так как с увеличением размеров иона Э+ увеличивается
их поляризация.
ОКСИДЫ
Li2O, Na2O – бесцветные
K2O, Rb2O – желтые
Cs2O –
оранжевыйЧистые Na2O и К2О получают:
2NaOH + 2Na = 2Na2O + H2
KO2 + 3K = 2K2O
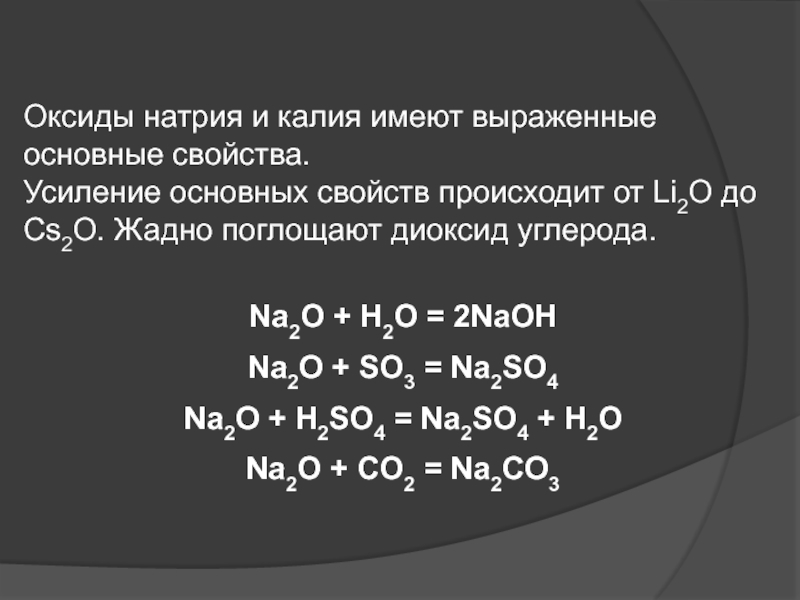
Слайд 54Na2O + H2O = 2NaOH
Na2O + SO3 = Na2SO4
Na2O
+ H2SO4 = Na2SO4 + H2O
Na2O + CO2 = Na2CO3
Оксиды
натрия и калия имеют выраженные основные свойства.Усиление основных свойств происходит от Li2O до Cs2O. Жадно поглощают диоксид углерода.
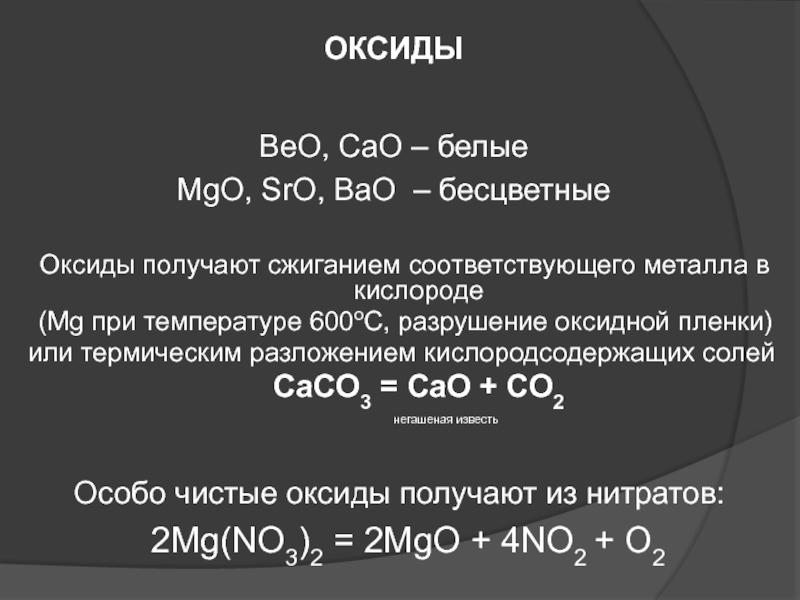
Слайд 55 Оксиды получают сжиганием соответствующего металла в кислороде
(Mg при
температуре 600оС, разрушение оксидной пленки)
или термическим разложением кислородсодержащих солей
CaCO3 = CaO + CO2негашеная известь
ОКСИДЫ
BeO, CaO – белые
MgO, SrO, BaO – бесцветные
Особо чистые оксиды получают из нитратов:
2Mg(NO3)2 = 2MgO + 4NO2 + O2
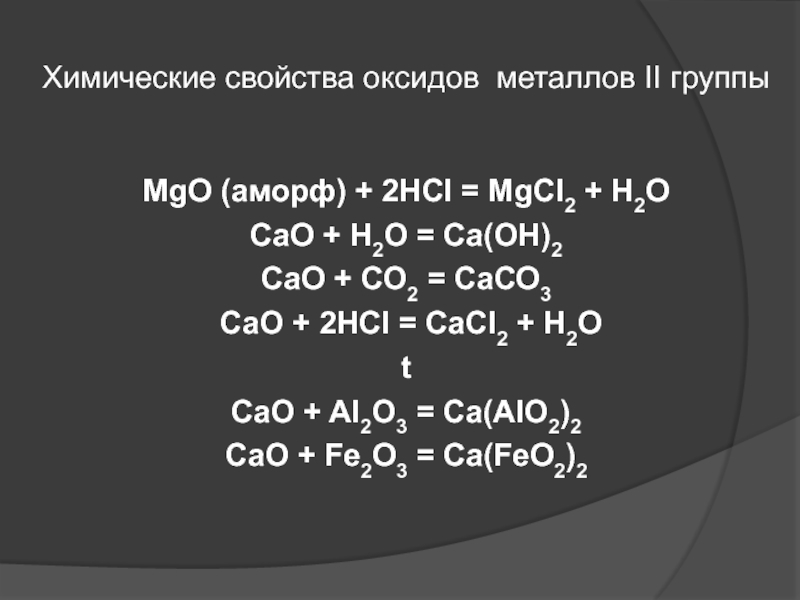
Слайд 56MgO (аморф) + 2HCl = MgCl2 + H2O
СаО + Н2О
= Са(ОН)2
СаО + СО2 = СаСО3
СаО + 2НCl
= CaCl2 + H2Ot
СaO + Al2O3 = Ca(AlO2)2
CaO + Fe2O3 = Ca(FeO2)2
Химические свойства оксидов металлов II группы
Слайд 57
2Na2О2 + 2СО2 = 2Na2СО3+ О2
4КО2 + 2СО2 = 2К2СО3+
3О2
Пероксиды, надпероксиды
Сильные окислители:
5H2O2 + 2KMnO4 + 3H2SO4 →
5O2 + 2MnSO4 + K2SO4 + 8H2O
Na2О2
+ 2Н2О = 2NaOН+ H2О2К2О4 + 2Н2О = КOН+ H2О2 + О2
Применение:
Слайд 59Реакция с водой
M (тв) M+(водн) + e-
H2O (ж) +
e- OH-(водн) + ½ H2
Реакционная способность по отношению к
воде возрастает сверху вниз в группах. Представители 1А группы активнее реагируют с водой по сравнению с металлами 2А группы.
Ве с трудом реагирует даже с паром (Be и Mg образуют оксиды, остальные гидроксиды):
H2O (г) + Be BeO (тв) + H2
Na + H2O = NaOH + H2
Слайд 60Химические свойства оснований
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl
Al(OH)3
+ NaOH = Na[Al(OH)4]
NaOH + HCl = NaCl + H2O
2NaOH
+ CO2 = Na2CO3 + H2O KOH + NH4Cl = KCl + NH3 + H2O
2KOH + FeSO4 = Fe(OH)2 + K2SO4
Слайд 612KOH + Cl2 = KCl + KClO + H2O
6KOH
+ 3S = 2H2S + K2SO3 + 3H2O
3KOH + 4P
+ 3H2O = PH3 + 3KH2PO2 Si + 2NaOH + H2O = Na2SiO3 + 2H2
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
t
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2
В щелочах растворяются некоторые неметаллы и амфотерные металлы:
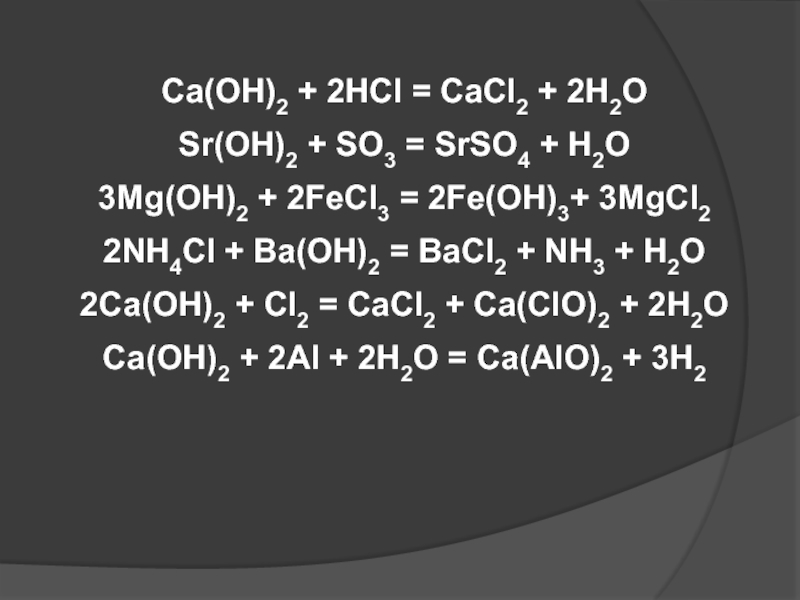
Слайд 62Са(ОН)2 + 2HCl = CaCl2 + 2H2O
Sr(OH)2 + SO3
= SrSO4 + H2O
3Mg(OH)2 + 2FeCl3 = 2Fe(OH)3+ 3MgCl2
2NH4Cl
+ Ba(OH)2 = BaCl2 + NH3 + H2O2Са(ОН)2 + Сl2 = CaCl2 + Ca(ClO)2 + 2H2O
Са(ОН)2 + 2Al + 2H2O = Ca(AlO)2 + 3H2
Слайд 63Реакция с водородом
Все s-элементы за исключением Be
непосредственно реагируют с
водородом:
2Na + H2 2NaH
Ca +
H2 CaH2Be(CH3)2 BeH2 + C2H6
Реакционная способность увеличивается сверху
вниз по группам.
Только в BeH2 и MgH2 ковалентная связь,
в остальных - ионная.
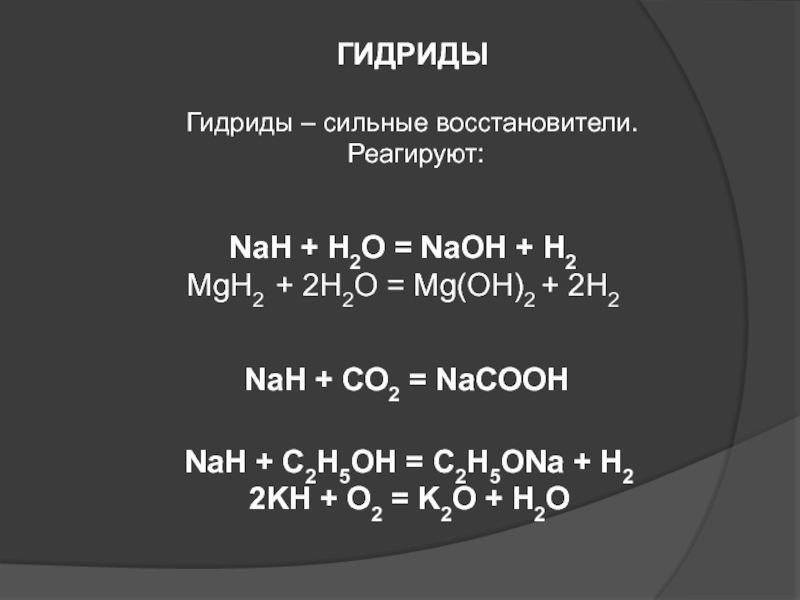
Слайд 64ГИДРИДЫ
Гидриды – сильные восстановители.
Реагируют:
NaH + H2O
= NaOH + H2
MgH2 + 2H2O = Mg(OH)2 + 2H2
NaH
+ CO2 = NaCOOHNaH + C2H5OH = C2H5ONa + H2
2KH + O2 = K2O + H2O
Слайд 652Na + Cl2 = 2NaCl
2K + Br2 = 2KBr
Взаимодействие
с галогенами. Щелочные металлы сгорают в атмосфере хлора и фтора
и легко соединяются с бромом или иодом приобычной температуре.
Слайд 66Щелочные металлы непосредственно соединяются с серой, фосфором, а при нагревании
– с азотом и углеродом.
2Na + S = Na2S
3K +
P = K3P6Na + N2 = 2Na3N
2Na + 2C = Na2C2
Нитриды, фосфиды, карбиды нестойкие и легко гидролизуются:
Li3N + 3H2O = 3LiOH + NH3
Na2C2 + 2H2O = 2NaOH + C2H2
Взаимодействие с другими неметаллами
Слайд 672Na + H3PO4 = Na2HPO4 + H2
2Na + H2SO4(р) =
Na2SO4 + H2
10Na + 12HNO3(р) = 10NaNO3 + N2 +
6H2O8Na + 5H2SO4 (к) = 4Na2SO4 + H2S + 4H2O
Щелочные металлы растворяются в кислотах-неокислителях вытесняя водород и в кислотах-окислителях, глубоко восстанавливая их:
Слайд 68 t
MgCl2 + 2Na = Mg + 2NaCl
t
Al2O3 + 6Na = 2Al + 3Na2O
Щелочные
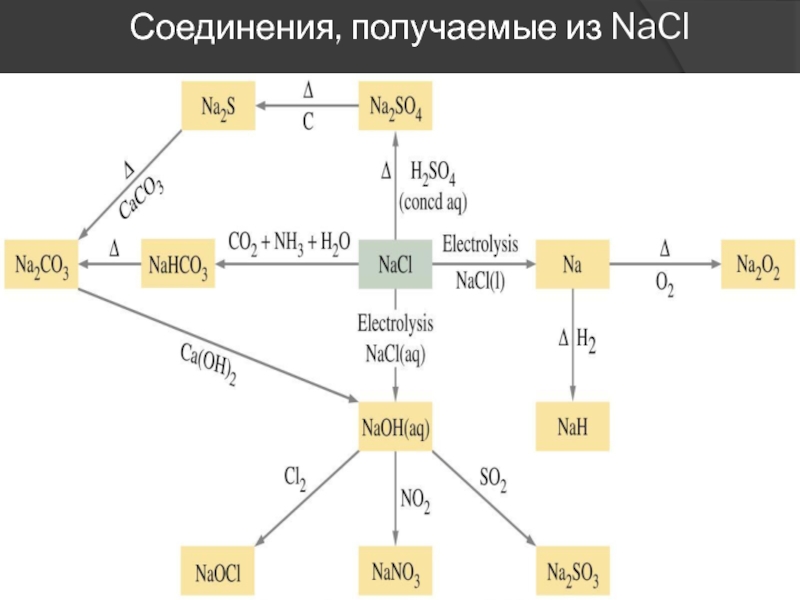
металлы вытесняют из расплавов солей или оксидов менее активные металлы:Слайд 69Практически все соли легкорастворимы
(труднорастворимыми солями являются: перхлорат калия - KClO4,
фторид лития – LiF, фосфат лития – Li3PO4, силикат лития
- Li2SiO3.Хлорид натрия - приправа к пище, сырье для получения многих неорганических соединений, в том числе, соды.
Соли лития, натрия и калия
Слайд 74Сульфат натрия - Na2SO4 и его кристаллическая соль Na2SO4 ×
10H2O -
применяют в производстве стекла и соды, в медицине как
слабительное.Соли калия более дорогие, чем соли натрия и используются как удобрение, т.к. доступного для растений калия в почве недостаточно
(неионообменный калий связан в силикатах и алюмосиликатах).
Слайд 75Применяются следующие калийные удобрения:
1. Сырые соли - используют в размолотом
виде - сильвинит KCl × NaCl, каинит MgSO4 × KCl
× 3H2O, карналлит MgCl2 × KCl × 6H2O и другие.2. Концентрированные соли, получают переработкой сырых солей.
Наиболее часто используют хлорид или сульфат калия, а также нитрат калия (калийную селитру).
3. Древесная и торфяная зола - содержит поташ (К2СО3).
Слайд 76Соли:
Сульфаты – существуют в виде кристаллгидратов:
- эпсомит (горькая соль) - MgSO4∙7H2O
- гипс
- CaSO4∙2H2OПри нагревании до 120оС гипс частично теряет воду и превращается в 2CaSO4∙H2O.
Быстро затвердевает в результате протекания реакции:
2CaSO4∙H2O + 3H2O = 2CaSO4∙2H2O
Сульфат кальция – малорастворимая соль, сульфат магния легко растворяется в воде. При 1100оС сульфаты разлагаются:
2MgSO4 = 2MgO + 2SO2 + O2
Слайд 77 Карбонаты – труднорастворимые соединения.
При прокаливании с
углем карбонаты щелочноземельных металлов образуют карбиды, которые представляют собой соединения
нестехиометрического состава, т.е. не отвечающие правилу формальной валентности:CaCO3 + 3C = CaC2 + CO + CO2
При взаимодействии CaC2 с водой получается ацетилен:
CaC2 + 2H2O = Ca(OH)2 + C2H2
При обжиге карбонатов образуются оксиды:
CaCO3 = CaO + CO2
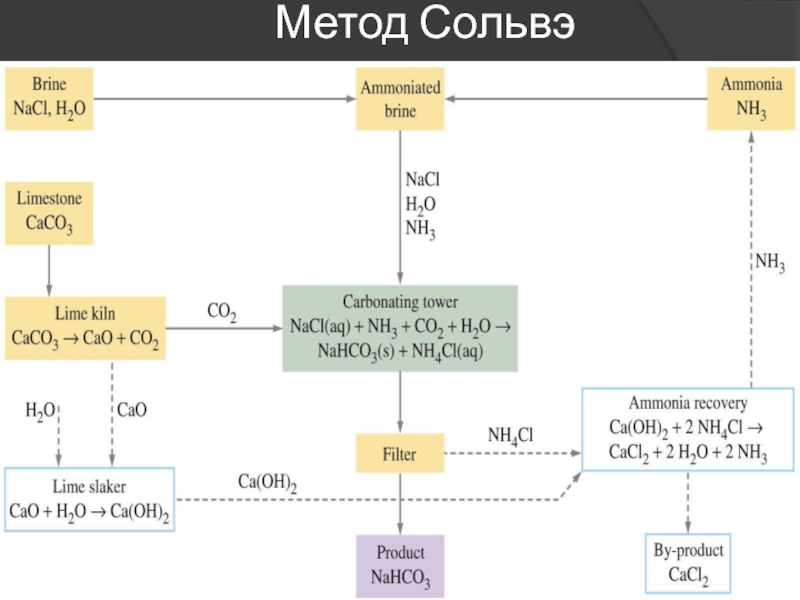
Слайд 78Chapter 20: s-Block Elements
Процесс Доу
EOS
Известняк
Морская вода
Морская вода
Испарение
Растворение
Электролиз
Расплав
Продукт
Производство HCl
Слайд 79Жесткость воды
Обусловлена присутствием в воде катионов Ca+2
и Mg+2.
Суммарная молярная концентрация эквивалентов катионов Ca+2
и Mg+2 называется общей жесткостью. Она складывается из карбонатной (временная) и некарбонатной (постоянная).
Карбонатная жесткость обусловлена присутствием в воде растворимых гидрокарбонатов кальция и магния. Способы ее устранения основаны на выводе катионов Ca2+ и Mg2+ из воды в виде нерастворимых солей:
- кипячение (используется в быту):
Ca(HCO3)2 = CaCO3 + CO2 + H2O
Mg(HCO3)2 = Mg(OH)2 + 2CO2
Слайд 80
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O
Ca(HCO3)2 + Na2CO3 =
CaCO3 + 2NaHCO3
Mg(HCO3)2 + Ca(OH)2 = Mg(OH)2 + CaCO3 +
CO2 + H2OMg(HCO3)2 + Na2CO3 = MgCO3 + 2NaHCO3
- действие известкового молока Ca(OH)2 или соды Na2CO3 (используется в промышленности):
Некарбонатная, или постоянная, жесткость обусловлена
присутствием сульфатов, хлоридов, нитратов и фосфатов
кальция и магния. Постоянная жесткость при кипячении
воды не устраняется. Ее устраняют добавлением соды или фосфата натрия:
CaSO4 + Na2CO3 = CaCO3 + Na2SO4
3CaSO4 + 2Na3PO4 = Ca3(PO4)2 + 3Na2SO4
























![S - элементы Характерные цвета пламениNa+ Cl- (г) Na (г) + Cl (г)Na(г) Na* Характерные цвета пламениNa+ Cl- (г) Na (г) + Cl (г)Na(г) Na* (г)[Ne]3s1 [Ne]3p1Na*(г) ](/img/tmb/4/342725/c9e5ee6da720203d9cd4e808769cd48d-800x.jpg)












![S - элементы Химические свойства основанийAlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl Al(OH)3 + Химические свойства основанийAlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl Al(OH)3 + NaOH = Na[Al(OH)4]NaOH + HCl =](/img/thumbs/faedeef2620fbee19595d9348e9b098e-800x.jpg)