Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Щелочные металлы
Содержание
- 1. Щелочные металлы
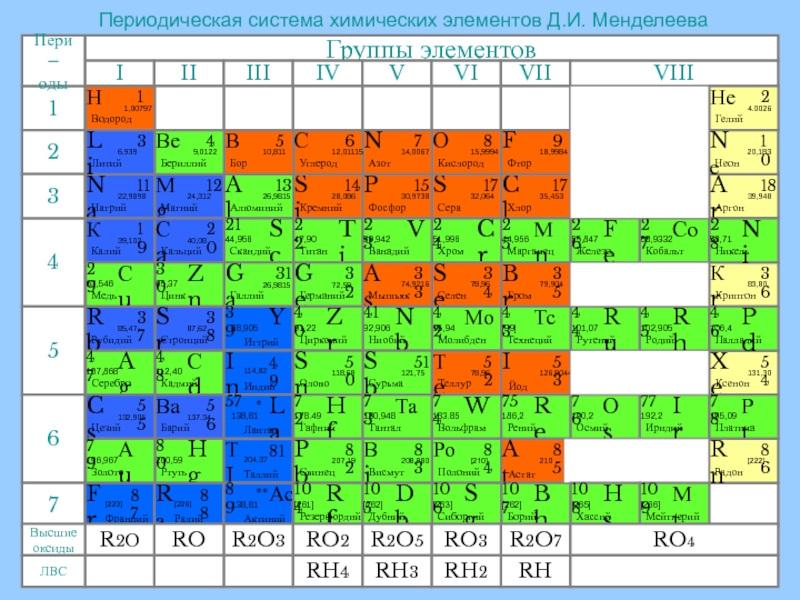
- 2. Периодическая система химических элементов Д.И. Менделеева
- 3. Строение и свойства атомовЩелочные металлы – это
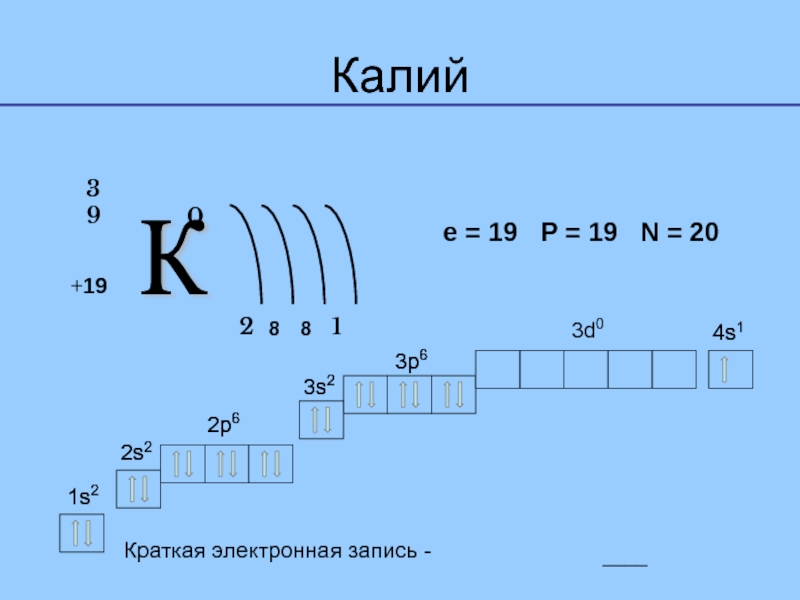
- 4. e = 1939 0Краткая электронная запись - ____1s21s22s22s22p62p63s23s23p63p64s14s13d0Калий
- 5. Щелочные металлы – простые веществаЛитийНатрий
- 6. Щелочные металлыКалийРубидий
- 7. Цезий
- 8. Физические свойстваСеребристо – белые мягкие вещества (режутся
- 9. Химические свойстваА) с простыми веществами 2Li
- 10. Реакция натрия с водой
- 11. ПолучениеЛитий был открыт шведским химиком И. Арфведсоном
- 12. ПолучениеНатрий и калий впервые получены английским физиком
- 13. ПолучениеЙ. Берцелиус предложил назвать элемент №11 натрием
- 14. Скачать презентанцию
Периодическая система химических элементов Д.И. Менделеева
Слайды и текст этой презентации
Слайд 1August 12, 2019
Яковлева Л.А.
Курганская область, Петуховский район, МОУ «Новогеоргиевская СОШ»
Составила
:
Слайд 3Строение и свойства атомов
Щелочные металлы – это элементы главной подгруппы
I группы Периодической системы химических элементов Д.И. Менделеева: литий, натрий,
калий, рубидий, цезий, франций.На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону, находящемся на сравнительно большом удалении от ядра. Они легко отдают этот электрон, поэтому являются сильными восстановителями. Во всех соединениях щелочные металлы проявляют степень окисления +1.
Слайд 8Физические свойства
Серебристо – белые мягкие вещества (режутся ножом), с характерным
блеском на свежесрезанной поверхности. Все они лёгкие и легкоплавкие, причём,
как правило, плотность их возрастает от лития к цезию.Слайд 9Химические свойства
А) с простыми веществами
2Li + Н2 =
2LiН – гидрид лития;
2К + Сl2 = 2КСl
– хлорид калия;2Nа + S = Nа2S – сульфид натрия;
4 Li + О2 = 2Li2О – оксид лития.
б) со сложными веществами
2Nа + 2НОН = 2NаОН + Н2