Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Техническая термодинамика (1 часть)
Содержание
- 1. Техническая термодинамика (1 часть)
- 2. Уравнение МайераЭнтальпияПродифференцируемРазделим наДля 1 кмоля
- 3. ЭнтропияТеплота не является функцией состояния (зависит от
- 4. Приведенная теплота при
- 5. Дж/КЭнтропия – функция состояния термодинамической системы, определяемая
- 6. II закон термодинамикиI закон утверждает, что может
- 7. Закон, позволяющий указать направление теплового потока и
- 8. Математическое выражение II закона термодинамики Оценка степени необратимости (несовершенства)Анализ процессов
- 9. Изменение энтропии для любого термодинамического процесса
- 10. Термодинамические процессы идеальных газовК основным процессам, имеющим
- 11. Кроме того существует группа процессов, являющихся при
- 12. Для всех процессов устанавливается общий метод исследований:1)
- 13. Изохорный процесс1)2)3)4)5)6)7)8)
- 14. Изобарный процесс1)2)3)4)5)6)7)8)
- 15. Изотермный процесс1)2)3)4)5)6)7)8)
- 16. 1) Из уравнений 1 закона термодинамики получимРазделим
- 17. проинтегрируемПосле потенцирования имеемОткуда получаем уравнение адиабатного процесса (адиабаты)где k – показатель адиабаты
- 18. 2)3)4)
- 19. 5)6)7)8)Адиабатный процесс называют изоэнтропным
- 20. Политропный процессНаряду с изобарным, изохорным, изотермическим и
- 21. Перенесем слагаемые с теплоемкостями в правую сторону, вынесем dT за скобки, разделим второе уравнение на первоеобозначим
- 22. проинтегрируемПосле потенцирования имеемОткуда получаем уравнение политропного процесса (политропы)где n – показатель политропы
- 23. Из уравненийНайдем теплоемкость политропного процессаПоказатель политропы и теплоемкость для процессов
- 24. 2)3)4)
- 25. 5)6)7)8)
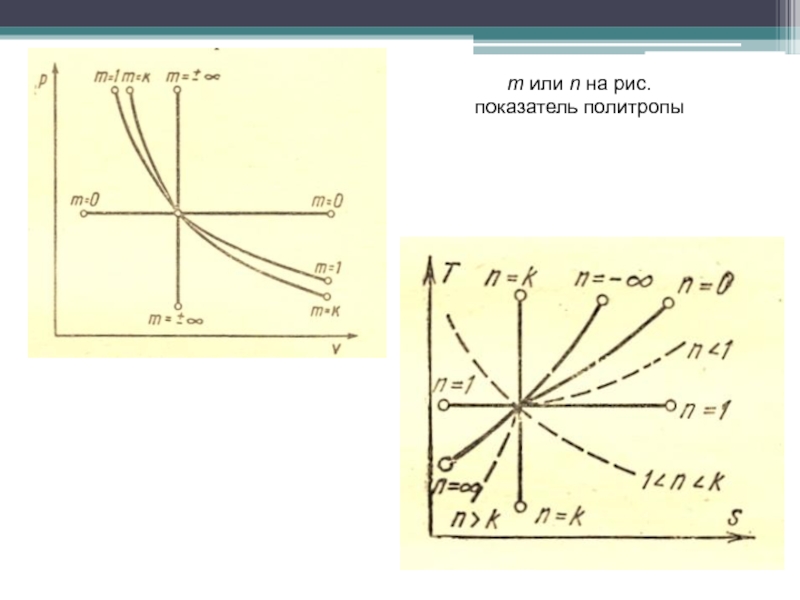
- 26. m или n на рис. показатель политропы
- 27. Скачать презентанцию
Уравнение МайераЭнтальпияПродифференцируемРазделим наДля 1 кмоля
Слайды и текст этой презентации
Слайд 3Энтропия
Теплота не является функцией состояния (зависит от пути процесса)
Умножаем теплоту
на интегрирующий множитель
Слайд 4Приведенная теплота при обратимом изменении состояния
газа полный дифференциал некоторой функции переменных Т и v
Клаузиус назвал
эту функцию энтропией и обозначил s; Дж/(кгК) или Дж/КТаким образом
Слайд 5Дж/К
Энтропия – функция состояния термодинамической системы, определяемая тем, что ее
дифференциал dS при элементарном равновесном (обратимом) процессе, происходящем в этой
системе, равен отношению бесконечно малого количества теплоты Q, сообщенного системе, к термодинамической температуре системыСлайд 6II закон термодинамики
I закон утверждает, что может
Q L
и L
Qне устанавливая условий, при которых возможны эти превращения
I закон не рассматривает вопрос о направлении теплового процесса, а не зная направления нельзя предсказать характер и результат
Слайд 7Закон, позволяющий указать направление теплового потока и устанавливающий максимально возможный
предел превращения Q L в тепловых машинах, представляет собой
II закон термодинамикиПостулат Клаузиуса: Теплота не может переходить от холодного тела к более нагретому сама собой даровым процессом (без компенсации)
Томсон: Не вся теплота, полученная от теплоотдатчика, может перейти в работу, а только некоторая ее часть, а другая часть теплоты должна перейти в теплоприемник
Слайд 8Математическое выражение
II закона термодинамики
Оценка степени необратимости (несовершенства)
Анализ процессов
Слайд 10Термодинамические процессы идеальных газов
К основным процессам, имеющим большое значение как
для теоретических исследований, так и для практических работ, относят
- изохорный
(v-const),- изобарный (p-const),
- изотермический (T-const),
- адиабатный (q=0).
Слайд 11Кроме того существует группа процессов, являющихся при определенных условиях обобщающими
для основных.
Эти процессы называются политропными и характеризуются постоянством теплоемкости в
процессе.Слайд 12Для всех процессов устанавливается общий метод исследований:
1) выводится уравнение кривой
2)
устанавливается взаимосвязь между p, v, T в начале и конце
процесса3) определяется изменение внутренней энергии u
4) вычисляется работа изменения объема l
5) располагаемая (полезная) работа l
6) изменение энтальпии i
7) количество теплоты q
8) изменение энтропии s
Слайд 161) Из уравнений 1 закона термодинамики получим
Разделим второе на первое
уравнение
так как Адиабатный процесс
то
Слайд 17проинтегрируем
После потенцирования имеем
Откуда получаем уравнение адиабатного процесса (адиабаты)
где k –
показатель адиабаты
Слайд 20Политропный процесс
Наряду с изобарным, изохорным, изотермическим и адиабатным процессами можно
представить еще бесконечное множество процессов, у которых имеются другие постоянные
признаки.Всякий процесс идеального газа, в котором теплоемкость является постоянной величиной, называется политропным.
Из определения следует, что если основные термодинамические процессы (изобарный, изохорный, изотермический и адиабатный) протекают при постоянной теплоемкости, то они являются частными случаями политропного.
Для политропного процесса количество теплоты