Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Тема: Ионные уравнения
Содержание
- 1. Тема: Ионные уравнения
- 2. ЦЕЛИ УРОКА1.Повторить основные понятия теории электролитической диссоциации
- 3. СОДЕРЖАНИЕ: 1.Историческая справка2. «Проверь себя»(теоретическая и письменная часть)3. Изучение нового материала4. Выполнение заданий по новому материалу
- 4. Историческая справка.Сванте Август Аррениус (1859-1927г.)Шведский физик и
- 5. Слайд 5
- 6. Проверь себя:ЭлектролитыВещества, проводящие ток в растворах или
- 7. ХИМИЧЕСКИЙ ДИКТАНТ1вариант2 вариант1. Закончите определение:Соли - это
- 8. ОТВЕТЫ:
- 9. Критерии оценок.«5» - нет ошибок«4» - одна
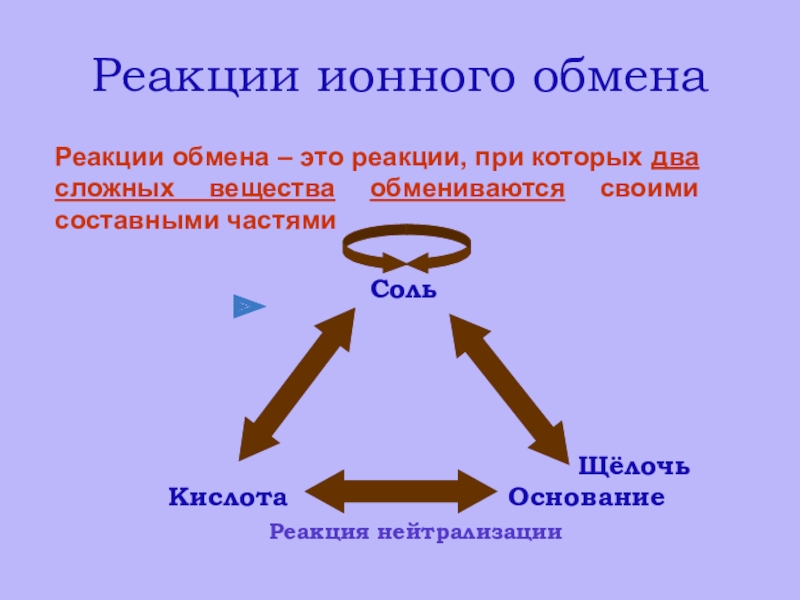
- 10. Реакции ионного обменаРеакции обмена – это реакции, при которых два сложных вещества обмениваются своими составными частями
- 11. РЕАКЦИИ ИОННОГО ОБМЕНА. Реакции между ионами называют ионными
- 12. Алгоритм составления ионных уравнений.3. Исключите из обеих частей
- 13. Задание: Составьте молекулярные и ионные уравнения двух
- 14. Решение задач. Задача№1. Составте молекулярные и ионные
- 15. Задача№2. Составьте молекулярные и полные ионные
- 16. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2ЦЕЛИ УРОКА
1.Повторить основные понятия теории электролитической диссоциации и проверить их
усвоение.
сокращённые ионные уравненияСлайд 3СОДЕРЖАНИЕ:
1.Историческая справка
2. «Проверь себя»(теоретическая и письменная часть)
3. Изучение нового материала
4.
Выполнение заданий по новому материалу
Слайд 4Историческая справка.
Сванте Август Аррениус (1859-1927г.)
Шведский физик и химик, академик Королевской
академии наук.
В1887году сформулировал основные положения теории электролитической диссоциации.
Слайд 6Проверь себя:
Электролиты
Вещества, проводящие ток в растворах или расплавах.
Неэлектролиты
Вещества, которые нерастворимы
в воде,а если растворимы,то электрического тока не проводят.
Электролитическая
диссоциация
Гидратированные ионы
Ионы окруженные
диполями воды.Степень диссоциации
Отношение числа распавшихся на ионы молекул к
общему числу молекул.
Процесс распада электролитов на ионы.
Слайд 7ХИМИЧЕСКИЙ ДИКТАНТ
1вариант
2 вариант
1. Закончите определение:
Соли - это электролиты……
1.Закончите определение:
Кислоты –
это электролиты…
2. Выберите электролиты:
Раствор спирта, раствор гидроксида
натрия, раствор азотной
кислоты, раствор хлорида натрия,
кристаллы сахара.
2.Выберите электролиты:
Раствор сахара, раствор гидроксида
калия, раствор соляной кислоты,
раствор сульфата натрия, озон.
3. Запишите уравнения диссоциации
следующих веществ:
а). хлорида магния
б). гидроксида калия
в). карбоната натрия
3. Запишите уравнения диссоциации
следующих веществ:
а). нитрата цинка
б). гидроксида бария
в). хлорида натрия
Слайд 10Реакции ионного обмена
Реакции обмена – это реакции, при которых два
сложных вещества обмениваются своими составными частями
Слайд 11РЕАКЦИИ ИОННОГО ОБМЕНА.
Реакции между ионами называют ионными реакциями,
а уравнения
– ионными уравнениями.
Ионные реакции протекают только в тех случаях, когда
в результате выделяется газ , осадок или вода.Формулы малодиссоциирующих, нерастворимых и газообразных веществ записывают в молекулярном виде.
Слайд 12Алгоритм составления ионных уравнений.
3. Исключите из обеих частей уравнения одинаковые
ионы и
запишите оставшиеся в сокращенное ионное уравнение.
1. Запишите молекулярное уравнение. Расставьте
коэффициенты.Определите по таблице растворимости электролиты.
Укажите осадки, газы
2NaOH+H2SO4 =
Na2SO4+2H2O
2. Запишите электролиты в виде ионов с учётом коэффициентов и индексов, а уходящие из сферы реакции - в виде молекул.
2Na++2OH-+2H++SO42- = 2Na++SO42-+2H2O
2OH-+2H+=2H2O
OH-+H+=H2O
Данная реакция взаимодействия кислоты с основанием
называется реакцией нейтрализации.
Слайд 13Задание: Составьте молекулярные и ионные уравнения двух других реакций пользуясь
алгоритмом.
CuSO4+2NaOH=Cu(OH)2 +Na2SO4
Cu2++SO42-+2Na++2OH-=Cu(OH)2 +2Na++ SO42-
Cu2++2OH-=Cu(OH)2
Na2CO3+2HCL=2NaCL+CO2 +H2O2Na++CO32-+2H++2CL-=2Na++CO32-+CO2 +H2O
CO32-+2H+=CO2 +H2O
Слайд 14Решение задач. Задача№1. Составте молекулярные и ионные уравнения взаимодействия хлорида железа(III)
с гидроксидом калия, нитратом серебра.
FeCL3+ 3KOH =
FeCL3 + 3AgNO3 =
Fe(OH)3
+ 3KCLFe(NO3)3 + 3AgCL