Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Углерод. Оксиды углерода
Содержание
- 1. Углерод. Оксиды углерода
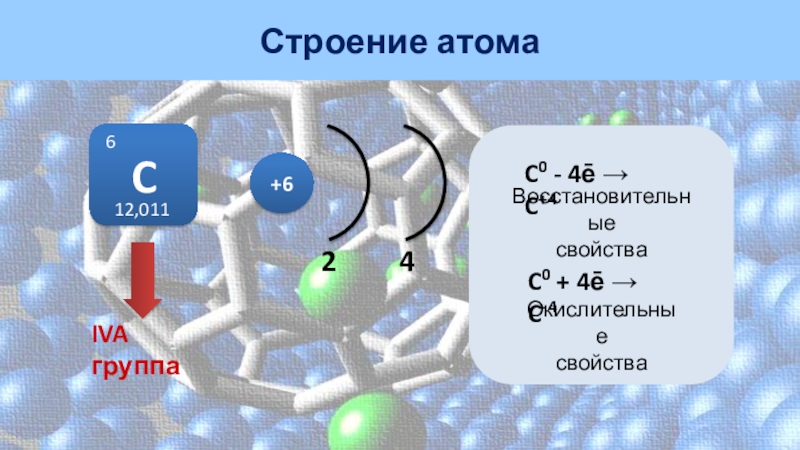
- 2. 24C612,011IVA группаC0 - 4ē → C+4C0 + 4ē → C-4Восстановительные свойстваОкислительные свойстваСтроение атома+6
- 3. Аллотропные модификации углеродаАлмаз – прозрачное кристаллическое вещество.
- 4. Слово «алмаз» происходит от арабского алмас, что
- 5. 1 карат соответствует 0,2 гОгранённые прозрачные алмазы называют бриллиантами.
- 6. Короны царейОрден Святого Андрея Первозванного
- 7. Алмаз «Куллинан» Алмаз «Шах»
- 8. Применение алмазовАлмазы применяют как украшения.Алмазы применяют для
- 9. Аллотропные модификации углеродаГрафит — тёмно-серое, жирное на
- 10. Применение графита12341. электроды2. твёрдые смазки3. замедлители нейтронов в ядерных реакторах4. стержни для карандашей
- 11. Слайд 11
- 12. Сажа и древесный угольДревесный уголь получают при
- 13. Н.Д. ЗелинскийОчистки спирта от сивушных масел.Очистки сахарного
- 14. Реакция с кислородомХимические свойства углеродаС + О2 = СО2tоксид углерода (IV)
- 15. Реакция с кислородомХимические свойства углеродаС +
- 16. Применение углерода
- 17. Нахождение в природеCaCO3CO2
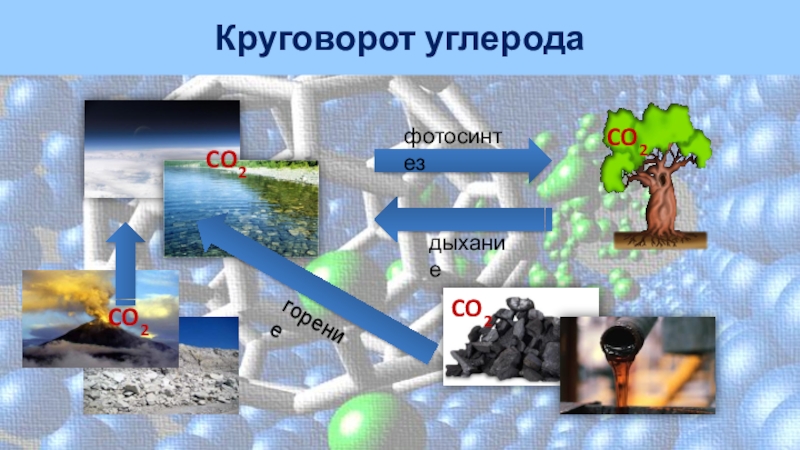
- 18. Круговорот углеродафотосинтездыханиегорениеCO2CO2CO2CO2
- 19. Оксиды углерода
- 20. CO + гемоглобин = карбоксигемоглобинПри вдыхании воздуха,содержащего 0,1 % СО, человек может потерять сознание и умереть.
- 21. Химические свойства оксида углерода (II)Получение СО2С +
- 22. Оксиды углерода
- 23. сухой лёдПри давлении около 60 атм. углекислый
- 24. Химические свойства CO2Реакции со щелочамиCO2 + Ca(OH)2 = CaCO3↓ + H2OкарбонаткальцияКачественная реакция на углекислый газ
- 25. Химические свойства CO2Реакции со щелочамиCO2 + Ca(OH)2
- 26. Получение CO2В промышленностиCaCO3 = CaO + CO2↑tВ лабораторииCaCO3 + 2HCl = CaCl2 + CO2↑ + H2OHClCO2CaCO3
- 27. Применение CO2123451. изготовление шипучих напитков 2. получение
- 28. Выводы Углерод – элемент IVA группы.На внешнем
- 29. В природе углерод встречается в свободном виде
- 30. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3Аллотропные модификации углерода
Алмаз – прозрачное кристаллическое вещество.
Одно из самых
твёрдых веществ в природе.
У алмаза атомная кристаллическая решётка.
Алмаз имеет высокую
светопреломляющую и светоотражающую способности.Слайд 4Слово «алмаз» происходит от арабского алмас, что означает «твердейший», или
от греческого слова адамас – «несокрушимый, непреодолимый».
Слайд 8Применение алмазов
Алмазы применяют как украшения.
Алмазы применяют для изготовления буров, свёрл
и шлифовальных инструментов.
Крупнейшие месторождения алмазов находятся в Южной Африке, в
России алмазы добывают в Якутии.Слайд 9Аллотропные модификации углерода
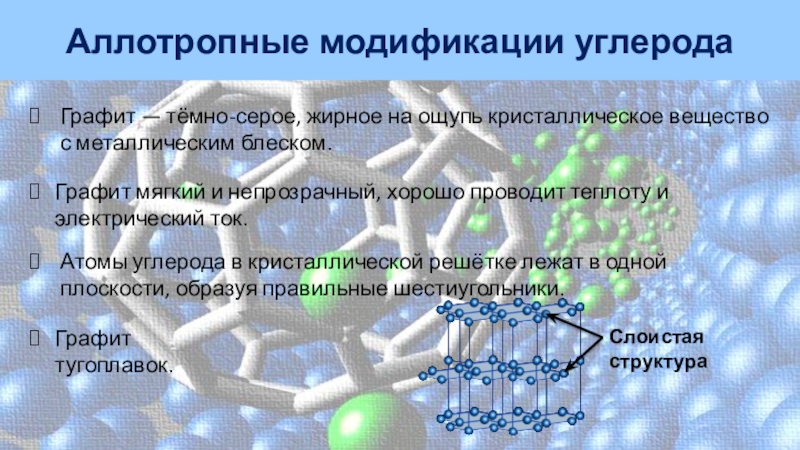
Графит — тёмно-серое, жирное на ощупь кристаллическое вещество
с металлическим блеском.
Графит мягкий и непрозрачный, хорошо проводит теплоту
и электрический ток. Атомы углерода в кристаллической решётке лежат в одной плоскости, образуя правильные шестиугольники.
Графит тугоплавок.
Слоистая структура
Слайд 10Применение графита
1
2
3
4
1. электроды
2. твёрдые смазки
3. замедлители нейтронов
в ядерных реакторах
4.
стержни для
карандашей
Слайд 12Сажа и древесный уголь
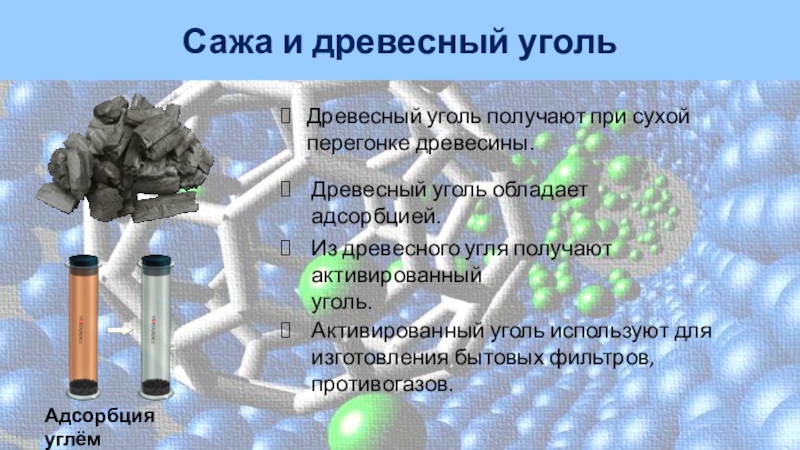
Древесный уголь получают при сухой перегонке древесины.
Древесный
уголь обладает адсорбцией.
Из древесного угля получают активированный
уголь.Активированный уголь используют для изготовления бытовых фильтров, противогазов.
Адсорбция углём
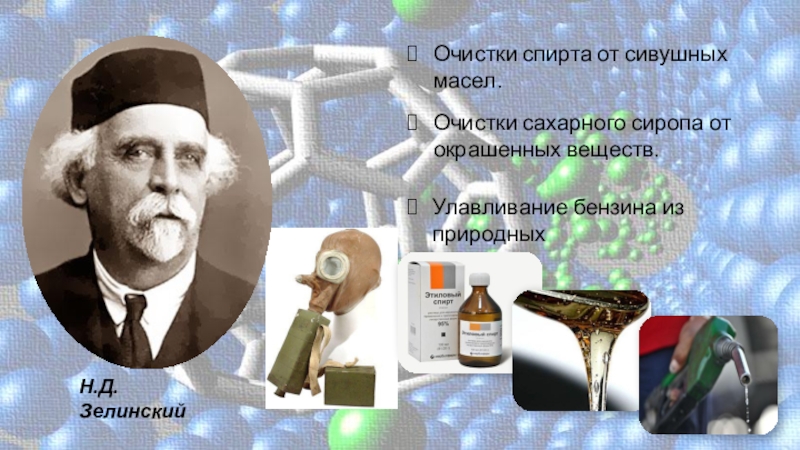
Слайд 13Н.Д. Зелинский
Очистки спирта от сивушных масел.
Очистки сахарного сиропа от
окрашенных веществ.
Улавливание бензина из природных
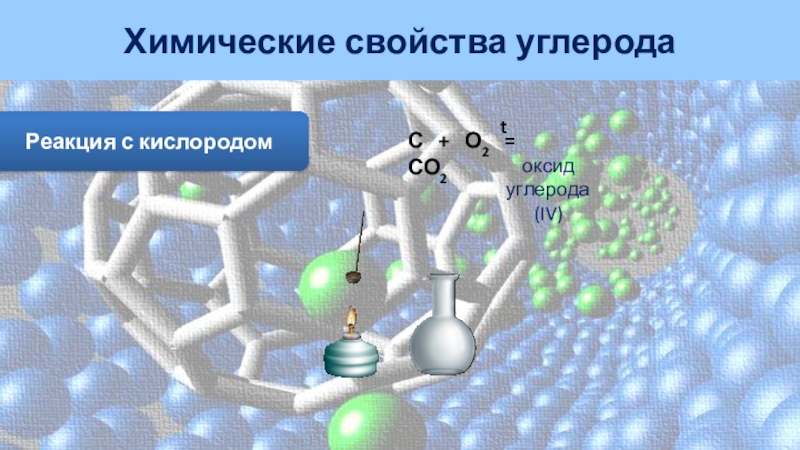
газов.Слайд 15Реакция с кислородом
Химические свойства углерода
С + О2
= СО2
t
0
+4
-2
Восст-ль
Ок-ль
оксид
углерода (IV)
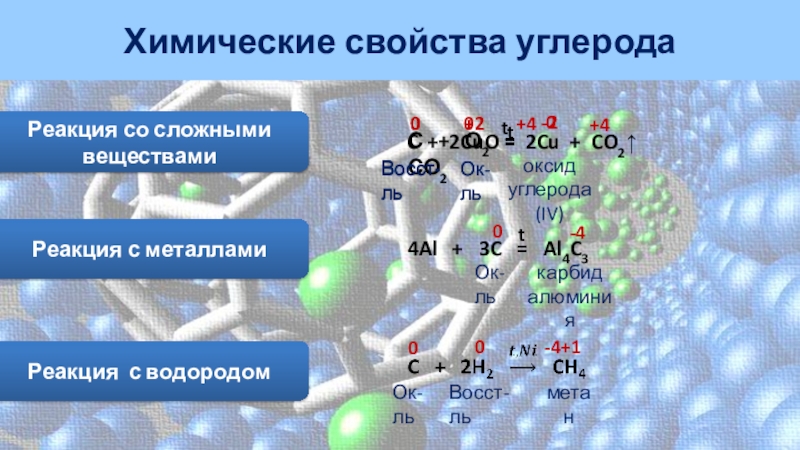
Реакция с металлами
4Al +
3C = Al4C3t
0
-4
Ок-ль
Реакция с водородом
0
0
-4
+1
метан
Восст-ль
Ок-ль
карбид
алюминия
0
Реакция со сложными веществами
C + 2CuO = 2Cu + CO2↑
t
0
+4
0
+2
Восст-ль
Ок-ль
Слайд 20CO + гемоглобин = карбоксигемоглобин
При вдыхании воздуха,
содержащего 0,1 % СО,
человек может потерять
сознание и умереть.
Слайд 21Химические свойства оксида углерода (II)
Получение СО
2С + О2 (нед) =
2СО
+2
Горение в кислороде
Восстановление металлов из оксидов
2CO + O2 = 2CO2
+2
+4
0
-2
Восст-ль
Ок-ль
2ē
Fe2O3
+ 3CO = 2Fe + 3CO2↑t
+3
+2
+4
0
2ē
Восст-ль
Ок-ль
t
t
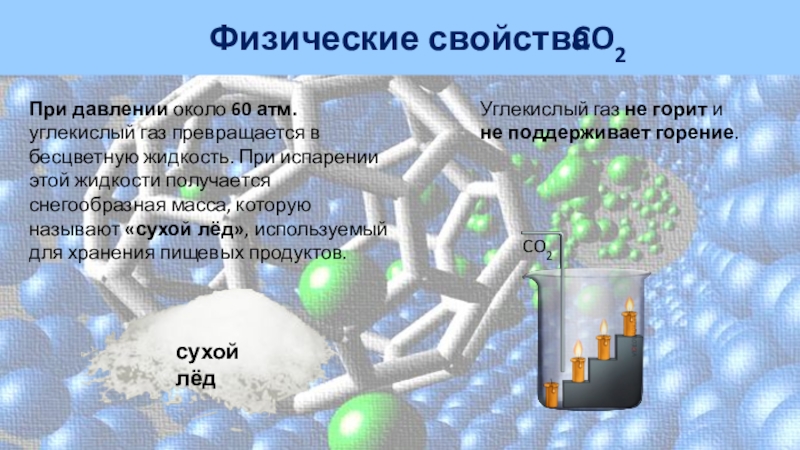
Слайд 23сухой лёд
При давлении около 60 атм. углекислый газ превращается в
бесцветную жидкость. При испарении этой жидкости получается снегообразная масса, которую
называют «сухой лёд», используемый для хранения пищевых продуктов.CO2
Углекислый газ не горит и
не поддерживает горение.
Физические свойства
CO2
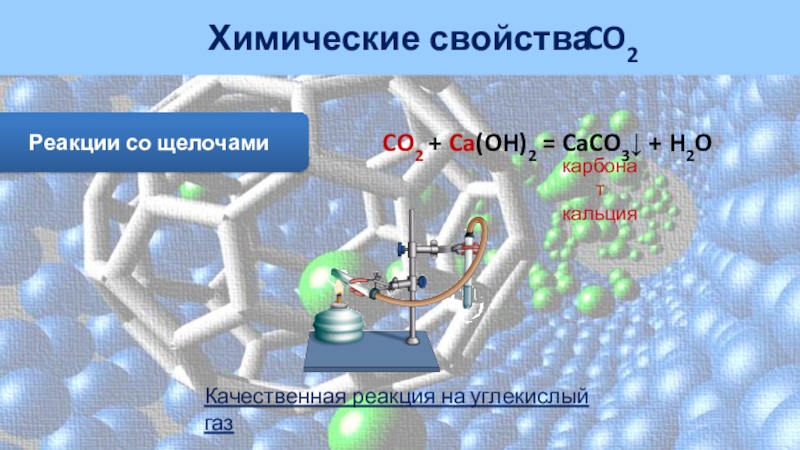
Слайд 24Химические свойства
CO2
Реакции со щелочами
CO2 + Ca(OH)2 = CaCO3↓ +
H2O
карбонат
кальция
Качественная реакция на углекислый газ
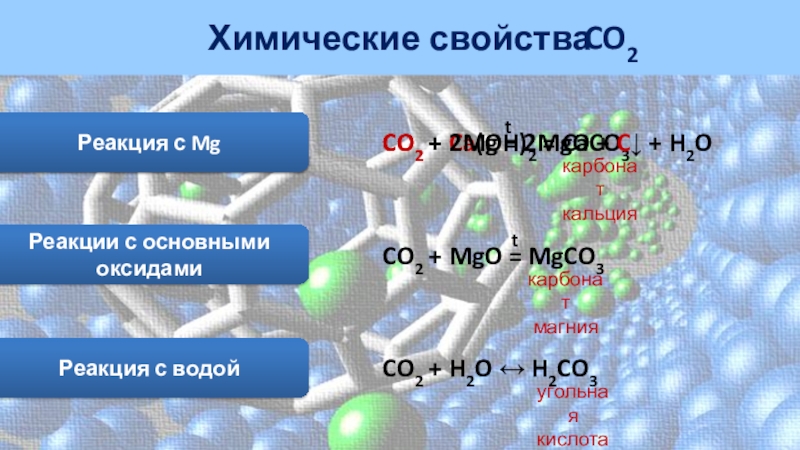
Слайд 25Химические свойства
CO2
Реакции со щелочами
CO2 + Ca(OH)2 = CaCO3↓ +
H2O
карбонат
кальция
Реакции с основными оксидами
CO2 + MgO = MgCO3
t
карбонат
магния
Реакция с водой
CO2
+ H2O ↔ H2CO3угольная
кислота
Реакция с Mg
CO2 + 2Mg = 2MgO + C
t
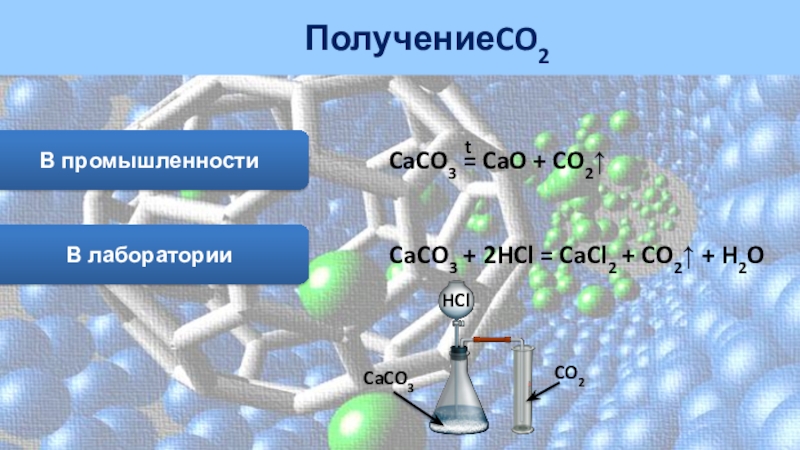
Слайд 26Получение
CO2
В промышленности
CaCO3 = CaO + CO2↑
t
В лаборатории
CaCO3 + 2HCl
= CaCl2 + CO2↑ + H2O
HCl
CO2
CaCO3
Слайд 27Применение
CO2
1
2
3
4
5
1. изготовление шипучих напитков
2. получение соды
3. создание «дыма»
на сцене
4. для хранения мороженого
5. в пенных огнетушителях
Слайд 28Выводы
Углерод – элемент IVA группы.
На внешнем энергетическом уровне у
углерода 4 электрона.
Для углерода характерны степени окисления -4, +2 и
+4. В реакциях с кислородом и оксидами металлов углерод проявляет восстановительные свойства, а в реакциях с металлами, водородом – окислительные свойства.
Наиболее известными аллотропными модификациями углерода являются алмаз и графит.
Слайд 29В природе углерод встречается в свободном виде и в виде
соединений, главным образом в виде карбонатов.
Углерод образует два оксида –
оксид углерода (II) и оксид углерода (IV). По химическим свойствам это несолеобразующий (СО) и кислотный оксид (СО2).
Углерод и его соединения находят широкое применение во многих областях народного хозяйства.