Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Уральский государственный аграрный университет д.х.н., проф. Хонина Татьяна
Содержание
- 1. Уральский государственный аграрный университет д.х.н., проф. Хонина Татьяна
- 2. План лекции (ч.1)Основные типы химической связи, механизм их образования и свойства: ковалентная,ионная, металлическая, водородная 2
- 3. Под химической связью
- 4. Ковалентная химическая связь это связь, возникающая между атомами
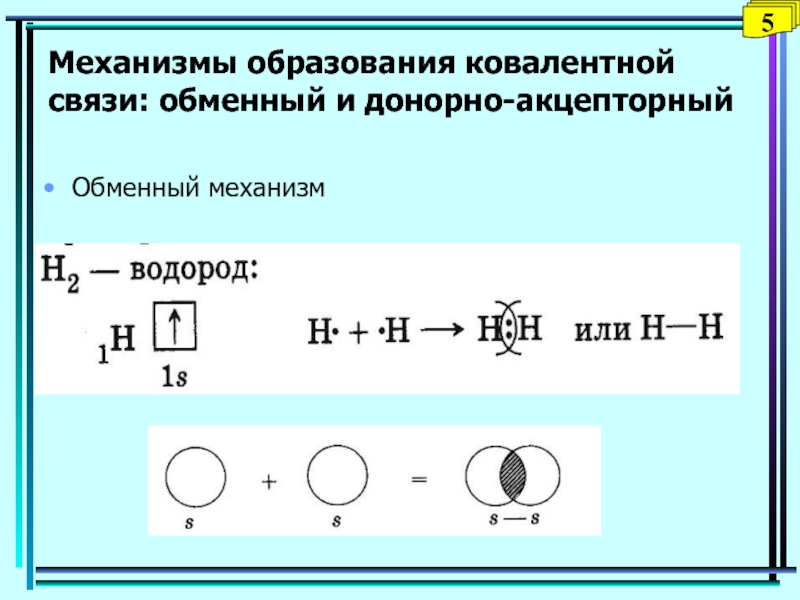
- 5. Обменный механизм5Механизмы образования ковалентной связи: обменный и донорно-акцепторный
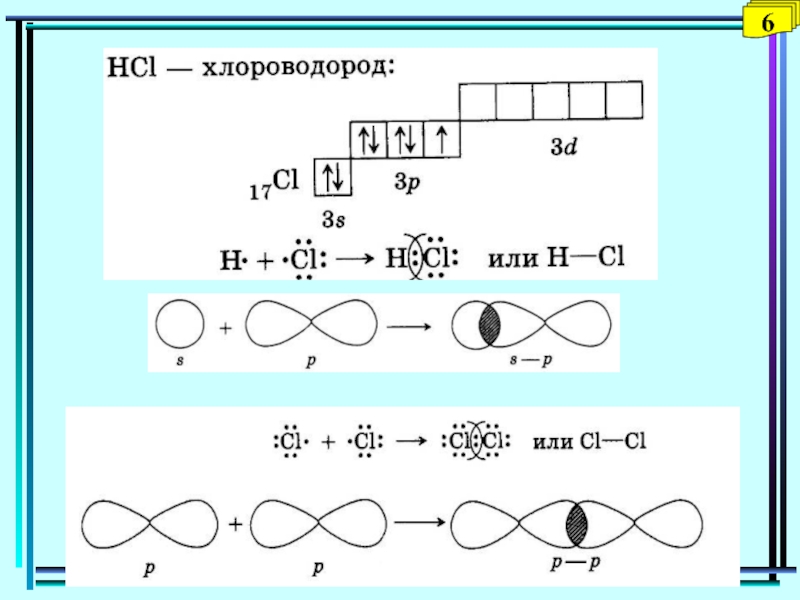
- 6. 6
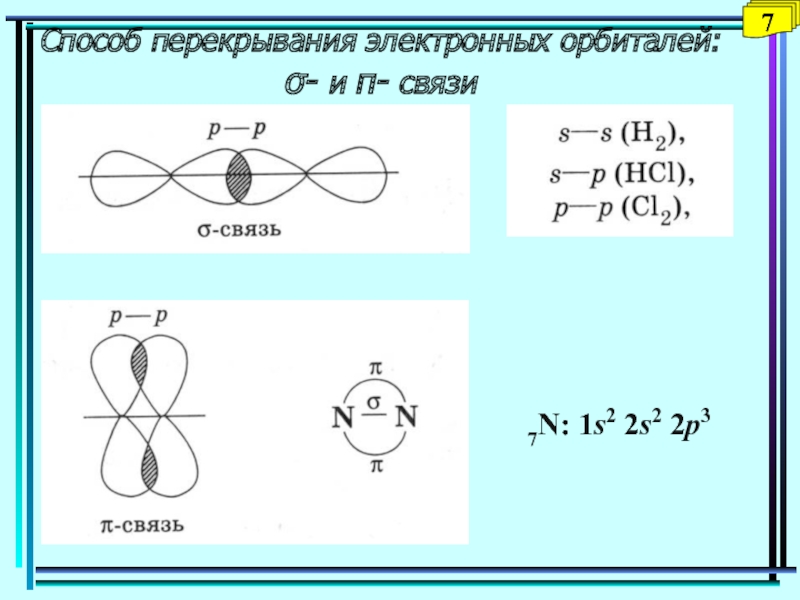
- 7. Способ перекрывания электронных орбиталей: - и - связи77N: 1s2 2s2 2p3
- 8. Полярность ковалентной связистепень смещенности общих электронных пар
- 9. Кратность ковалентной связичисло общих электронных пар, связывающих атомы 9
- 10. Донорно-акцепторный механизм10Определение валентности:Валентность – способность атома к
- 11. Гибридизация атомных орбиталейГибридизация – это выравнивание (усреднение)
- 12. Примеры гибридизации (sp)4Be: [He]2s24Be*: [He]2s12p1s-АО + p-АО = 2sp-АО 124Be: 1s2 2s2BeF29F: 1s2 2s2 2p5
- 13. Примеры гибридизации (sp2)5B: [He]2s22p15B*: [He]2s12p2s-АО + 2p-АО
- 14. Примеры гибридизации (sp3) 6С: [He]2s22p26С*: [He]2s12p3s-АО + 3p-АО = 4sp3-АО Тетраэдр146С: 1s2 2s2 2p2
- 15. Ионная химическая связьэто связь, образовавшаяся за счет
- 16. Водородная связьХимическая связь между положительно поляризованными атомами
- 17. Металлическая связьсвязь в металлах и сплавах, которую
- 18. Основные классы неорганических соединенийЛ-2,ч.2
- 19. План лекции (ч.2) 1.Классификация неорганических веществ. 2.
- 20. ВеществаПростые- молекулы которых состоят из атомов одного
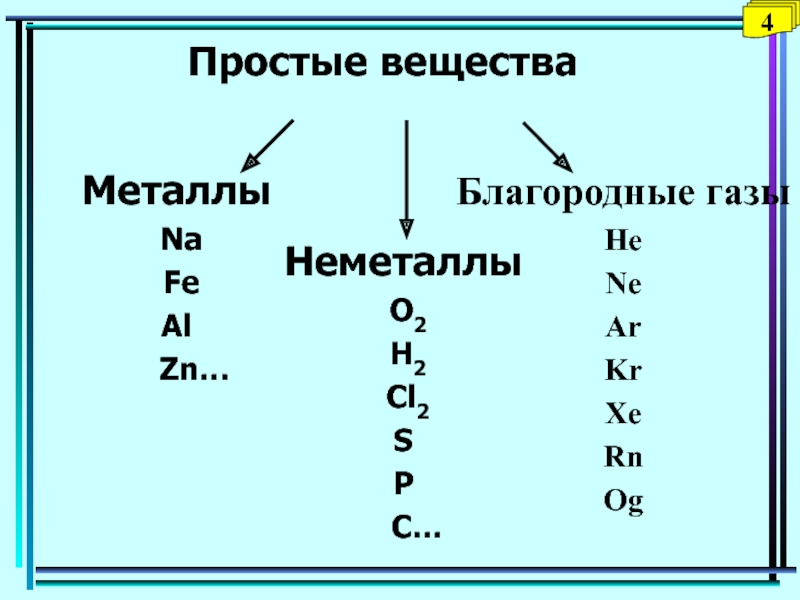
- 21. Благородные газыHeNeArKrXeRnОgПростые веществаМеталлы Na FeAl Zn… Неметаллы O2 H2 Cl2SP C…4
- 22. Сложные неорганические вещества1. Оксиды(Гидроксиды)4.Соли2. Основания(основные гидроксиды)3. Кислоты(кислотные гидроксиды)5
- 23. Несолеобразующие(СO, NO, N2O) СолеобразующиеКислотныеОсновныеАмфотерныеОксиды ЭхОIIy6
- 24. Основные оксиды-оксиды металлов со степенью окисления +1, +2Na2O Li2O K2OMgO CaO BaOCrO FeO NiO7
- 25. Кислотные оксидыОксиды неметаллов: SO2
- 26. Амфотерные оксидыZnOAl2O3Fe2O3Cr2O3CuOBeOPbO29
- 27. Способы получения оксидов1. Взаимодействие простых веществ
- 28. 11
- 29. Основания Ме(ОН)xПо растворимости в водеПо силе Растворимые
- 30. Соответствие оснований и оксидовNa2O – NaOHLi2O
- 31. Амфотерные гидроксидыZn(OH)2 H2ZnO2Al(OH)3
- 32. Методы получения оснований1. Взаимодействие щелочных и щелочноземельных
- 33. Химические свойства оснований1. Реакции с кислотами (нейтрализация)
- 34. Кислоты (Нх Ас)HNO3 – азотнаяHNO2 – азотистаяH2SO4
- 35. Кислоты По содержанию кислорода По основности По
- 36. Соответствие кислот и оксидовSO2
- 37. Методы получения кислот1. Взаимодействие водорода с неметаллами,
- 38. Общие химические свойства кислотРеакции обмена: HCl +NaOH
- 39. Соли Мex (AC)у (норм.)Нормальные (средние) NaCl, Na2SO4, Na3PO4Кислые NaHSO4, Na2HPO4, NaH2PO4Основные MgOHCl, Al(OH)2NO3Двойные (смешанные) KAl(SO4)2, Fe(NH4)2(SO4)2Комплексные Na2[Zn(OH)4], K3[Fe(CN)6]22
- 40. Методы получения солей1. Взаимодействие металла с неметаллом:↑2Na
- 41. Химические свойства солей1. Взаимодействие c металлами:
- 42. Генетическая связь между классами неорганических соединенийЭлемент –
- 43. Литература Кафедра химии УрГАУ/ ВКонтактеVk.com/club86527277 Тел кафедры: 221-41-03 1.
- 44. 33Вопросы к экзамену по общей и неорганической
- 45. 34Вопросы к экзамену (продолжение)9. Основные законы химии:
- 46. Лекция для самостоятельной работы
- 47. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Уральский государственный
аграрный университет
д.х.н., проф. Хонина Татьяна Григорьевна
ч.1. Химическая связь
и ее типы
2)Слайд 2План лекции (ч.1)
Основные типы химической связи, механизм их образования и
свойства:
ковалентная,
ионная,
металлическая,
водородная
2
Слайд 3 Под химической связью понимают такое взаимодействие атомов, которое связывает их
в молекулы,
ионы, радикалы, кристаллы
3
Слайд 4Ковалентная химическая связь
это связь, возникающая между атомами за счет образования
общих электронных пар
4
Параметры и свойства ковалентной связи
Энергия связи характеризует
прочность химической связи.Длина связи – расстояние между ядрами атомов, образующих связь.
Насыщаемость. Способность атомов образовывать ограниченное число валентных связей. В соответствии с принципом Паули на перекрываемых орбиталях могут присутствовать не более двух электронов с противоположными спинами.
Направленность. Перекрываемые орбитали должны иметь одинаковую симметрию относительно межъядерной оси (вдоль σ-связей). Совокупность направленных, строго ориентированных в пространстве σ-связей создает структуру химической частицы.
Полярность связи характеризует смещение связующего электронного облака в сторону более ЭО элемента
Образование кратных связей при дополнительном перекрывании атомных орбиталей (-связи).
Гибридизация - выравнивание электронных орбиталей по форме и энергии
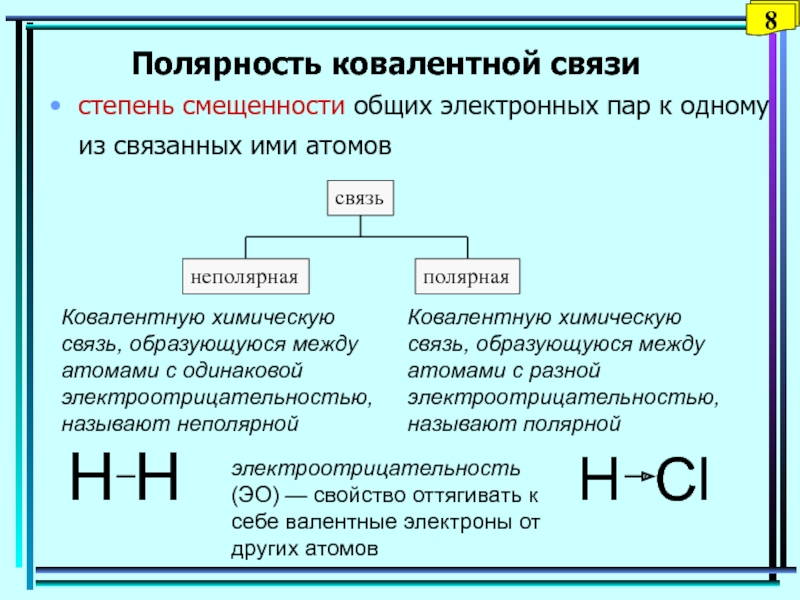
Слайд 8Полярность ковалентной связи
степень смещенности общих электронных пар к одному из
связанных ими атомов
электроотрицательность (ЭО) — свойство оттягивать к себе
валентные электроны от других атомовКовалентную химическую связь, образующуюся между атомами с одинаковой электроотрицательностью, называют неполярной
Ковалентную химическую связь, образующуюся между атомами с разной электроотрицательностью, называют полярной
H H
H Сl
8
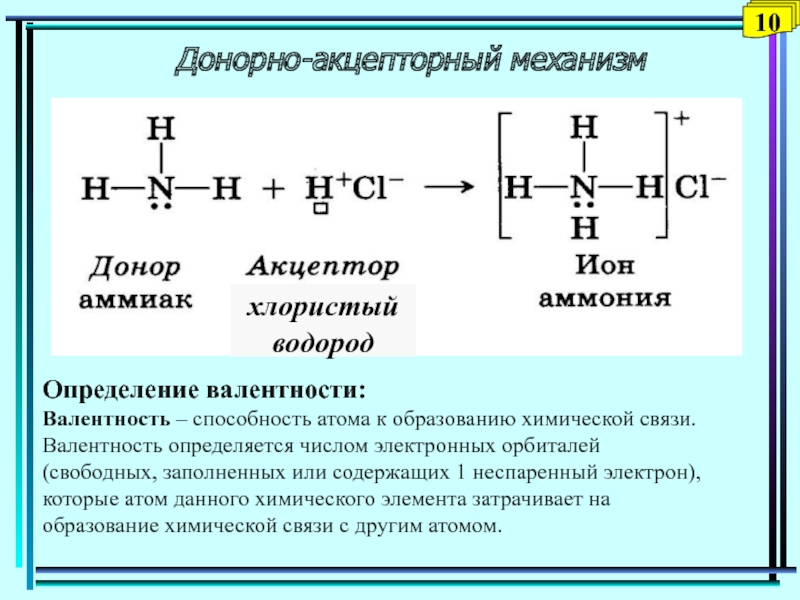
Слайд 10Донорно-акцепторный механизм
10
Определение валентности:
Валентность – способность атома к образованию химической связи.
Валентность определяется числом электронных орбиталей (свободных, заполненных или содержащих 1
неспаренный электрон), которые атом данного химического элемента затрачивает на образование химической связи с другим атомом.Слайд 11Гибридизация атомных орбиталей
Гибридизация – это выравнивание (усреднение) энергетических и геометрических
характеристик атомных орбиталей разных подуровней при образовании химических связей.
В
результате появляются гибридные орбитали, которые ориентируются в пространстве таким образом, чтобы расположенные на них электронные пары (или неспаренные электроны) были максимально удалены друг от друга.11
Слайд 12Примеры гибридизации (sp)
4Be: [He]2s2
4Be*: [He]2s12p1
s-АО + p-АО = 2sp-АО
12
4Be:
1s2 2s2
BeF2
9F: 1s2 2s2 2p5
Слайд 13Примеры гибридизации (sp2)
5B: [He]2s22p1
5B*: [He]2s12p2
s-АО + 2p-АО = 3sp2-АО
Плоский
треугольник
13
5B: 1s2 2s2 2p1
9F: 1s2 2s2 2p5
Слайд 14Примеры гибридизации (sp3)
6С: [He]2s22p2
6С*: [He]2s12p3
s-АО + 3p-АО = 4sp3-АО
Тетраэдр
14
6С: 1s2 2s2 2p2
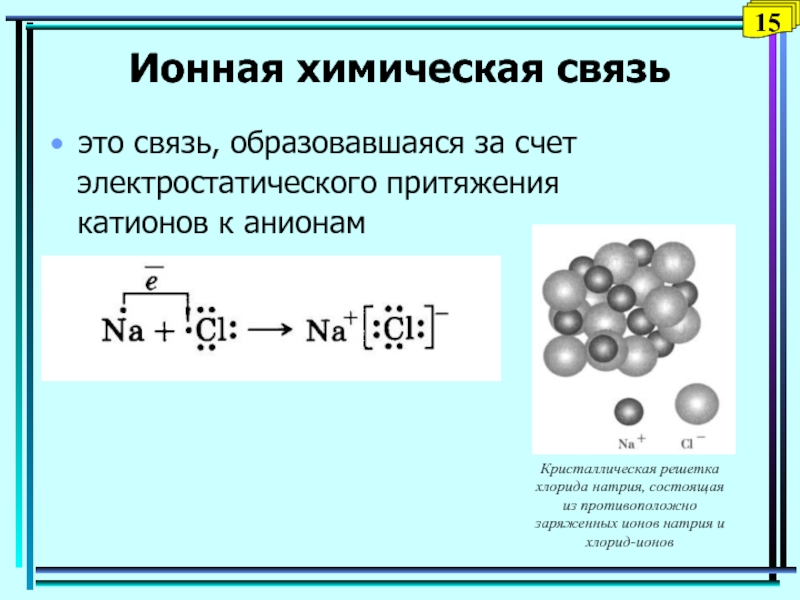
Слайд 15Ионная химическая связь
это связь, образовавшаяся за счет
электростатического
притяжения
катионов к анионам
15
Кристаллическая решетка хлорида натрия,
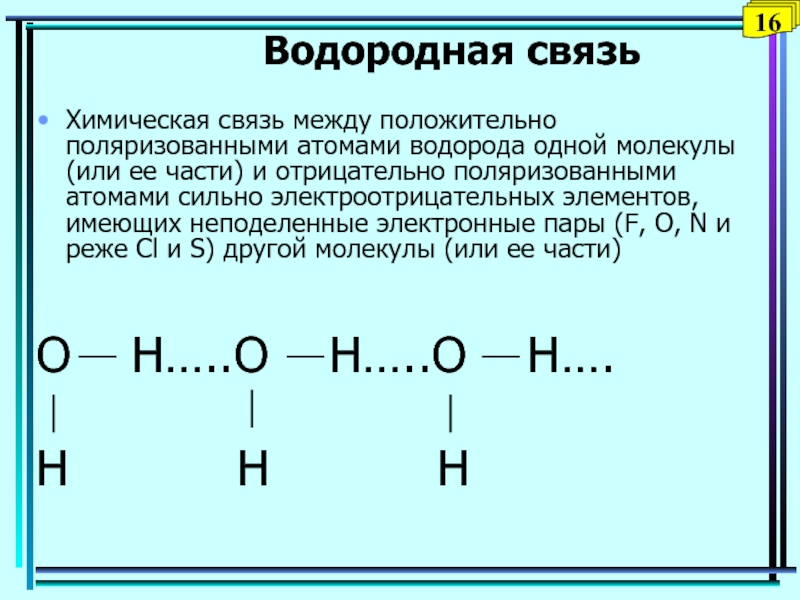
состоящая из противоположно заряженных ионов натрия и хлорид-ионовСлайд 16Водородная связь
Химическая связь между положительно поляризованными атомами водорода одной молекулы
(или ее части) и отрицательно поляризованными атомами сильно электроотрицательных элементов,
имеющих неподеленные электронные пары (F, О, N и реже Сl и S) другой молекулы (или ее части)O H…..O H…..O H….
H H H
16
Слайд 17Металлическая связь
связь в металлах и сплавах, которую выполняют относительно свободные
электроны между ионами металлов в металлической кристаллической решетке
о п+М — пе М
Схема образования металлической связи:
.
17
Слайд 19План лекции (ч.2)
1.Классификация неорганических веществ.
2. Оксиды, их классификация,
получение, свойства.
3. Кислоты, их классификация, получение, свойства.
Кислоты-окислители.
4. Основания, их классификация, получение, свойства.
5. Соли, их классификация, получение, свойства.
2
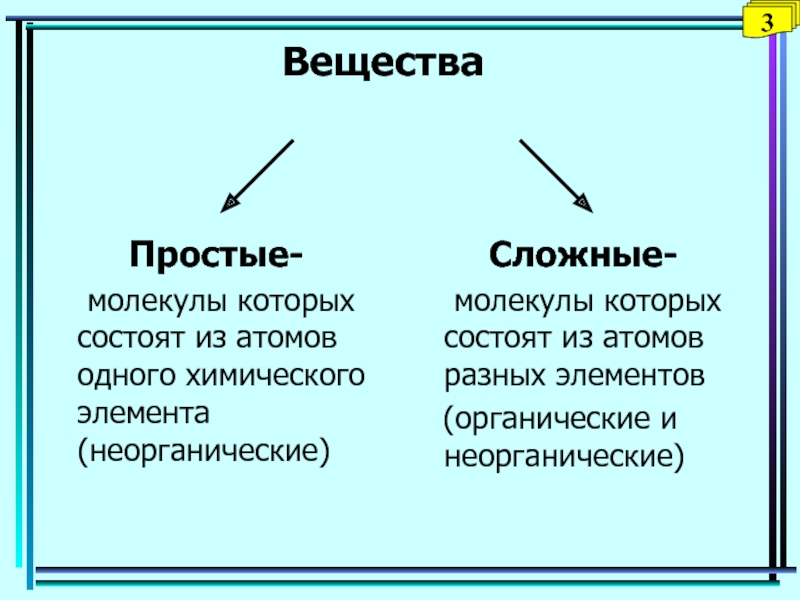
Слайд 20Вещества
Простые-
молекулы которых состоят из атомов одного химического элемента (неорганические)
Сложные-
молекулы
которых состоят из атомов разных элементов
(органические и неорганические)
3
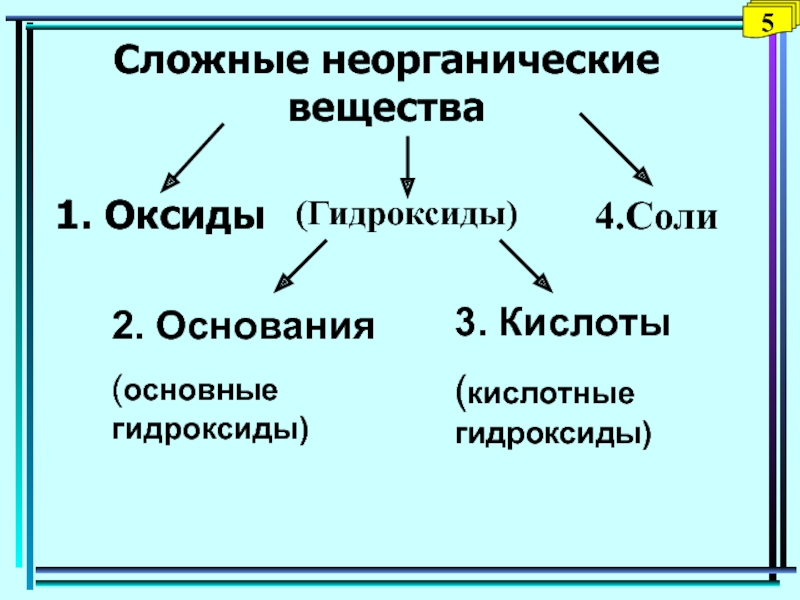
Слайд 22Сложные неорганические вещества
1. Оксиды
(Гидроксиды)
4.Соли
2. Основания
(основные гидроксиды)
3. Кислоты
(кислотные гидроксиды)
5
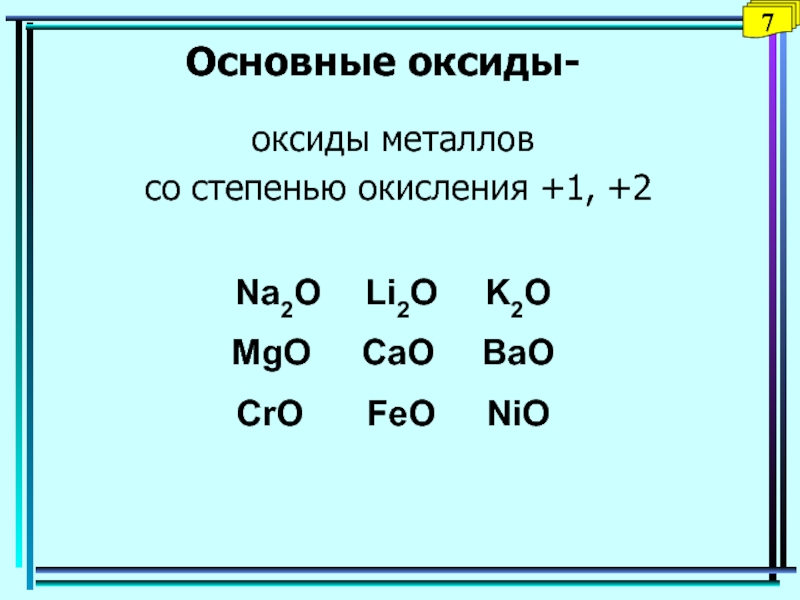
Слайд 24Основные оксиды-
оксиды металлов
со степенью окисления +1, +2
Na2O Li2O K2O
MgO
CaO BaO
CrO FeO NiO
7
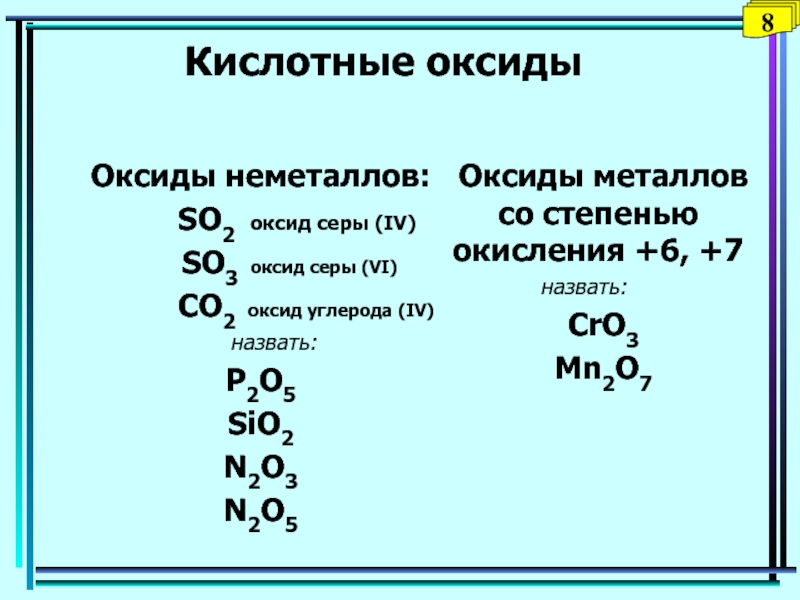
Слайд 25Кислотные оксиды
Оксиды неметаллов:
SO2 оксид серы (IV)
SO3 оксид серы (VI)
CO2 оксид углерода (IV)назвать:
P2O5
SiO2
N2O3
N2O5
Оксиды металлов со степенью окисления +6, +7
назвать:
СrO3
Mn2O7
8
Слайд 27Способы получения оксидов
1. Взаимодействие простых веществ с кислородом:
4P
+ 5O2 = 2P2O5
2. Горение бинарных соединений в
кислороде: 4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑
3. Термическое разложение гидроксидов:
2Al(OH)3 = Al2O3 + 3H2O
4. Термическое разложение солей кислородсодержащих кислот:
CaCO3 = CaO + CO2↑
2Cu(NO3 )2 = 2CuO + 4NO2↑ + O2↑
2FeSO4 = Fe2O3 + SO2 ↑ + SO3 ↑
10
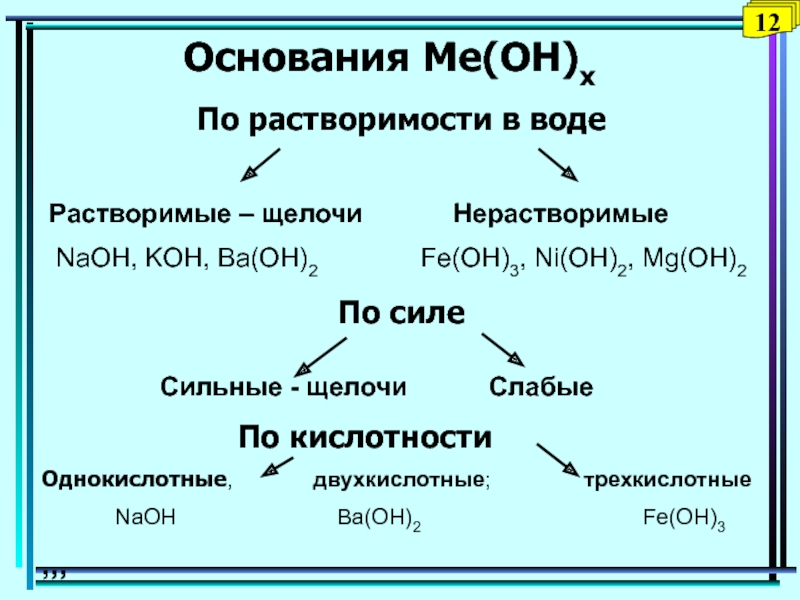
Слайд 29Основания Ме(ОН)x
По растворимости в воде
По силе
Растворимые – щелочи
Нерастворимые
NaOH, KOH, Ba(OH)2
Fe(OH)3, Ni(OH)2, Mg(OH)2 Сильные - щелочи Слабые
По кислотности
Однокислотные, двухкислотные; трехкислотные
NaOH Ba(OH)2 Fe(OH)3
,,,
12
Слайд 30Соответствие оснований и оксидов
Na2O – NaOH
Li2O
– LiOH
K2O
– KOHMgO – Mg(OH)2
CaO – Ca(OH)2
BaO – Ba(OH)2
CrO – Cr(OH)2
FeO – Fe(OH)2
13
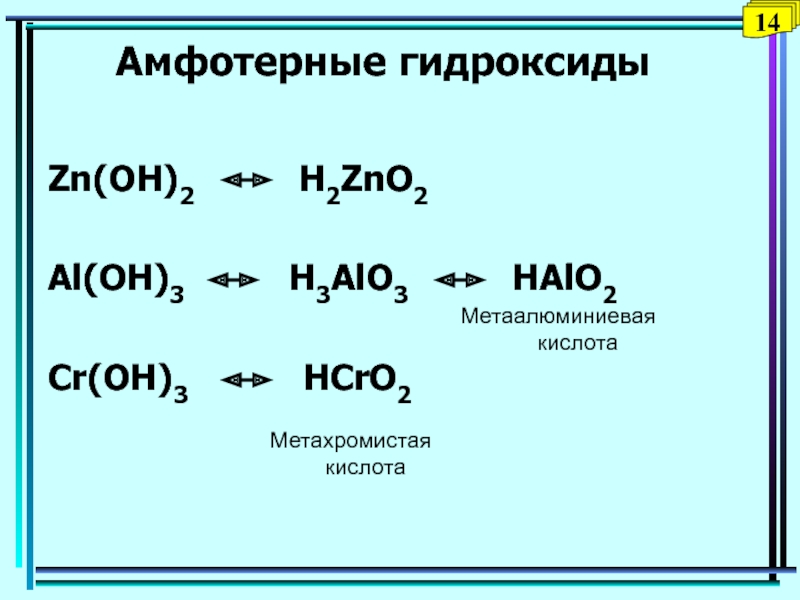
Слайд 31Амфотерные гидроксиды
Zn(OH)2 H2ZnO2
Al(OH)3
H3AlO3 HAlO2
Cr(OH)3
HCrO2Метаалюминиевая
кислота
Метахромистая
кислота
14
Слайд 32Методы получения оснований
1. Взаимодействие щелочных и щелочноземельных металлов с водой:
2Li + 2H2O = 2LiOH + H2 ↑
Sr +
2H2O = Sr(OH)2 + H2↑2. Растворение оксидов щелочных и щелочноземельных металлов в воде:
Na2O + H2O = 2NaOH
BaO + H2O = Ba(OH)2
3. Осаждение из растворов солей:
2KOH + MgSO4 = Mg(OH)2↓ + K2SO4
получение амфотерных гидроксидов:
3NH4OH + AlCl3 = Al(OH)3↓ + 3NH4Cl
2NaOH + ZnCl2 = Zn(OH)2↓ + 2NaCl
4. Электролиз водных растворов солей:
2NaCl + 2H2O = 2NaOH + H2↑ + Cl2↑
15
Слайд 33Химические свойства оснований
1. Реакции с кислотами (нейтрализация) и кислотными оксидами:
Cu(OH)2
+ H2SO4 = CuSO4 + 2H2O
NaOH + CO2 = NaHCO3
2. Обменные реакции щелочей с солями: 2NaOH + FeCl2 = Fe(OH)2↓ 2NaCl
CuSO4 + 2KOH = Cu(OH)2↓ + K2SO4
3. Реакции c амфотерными гидроксидами и оксидами:
NaOH + Zn(OH)2 = Na2ZnO2 + 2H2O
2NaOH + ZnO = Na2ZnO2 + H2O
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
4. Термическое разложение нерастворимых оснований:
Cu(OH)2 = СuO + H2O
16
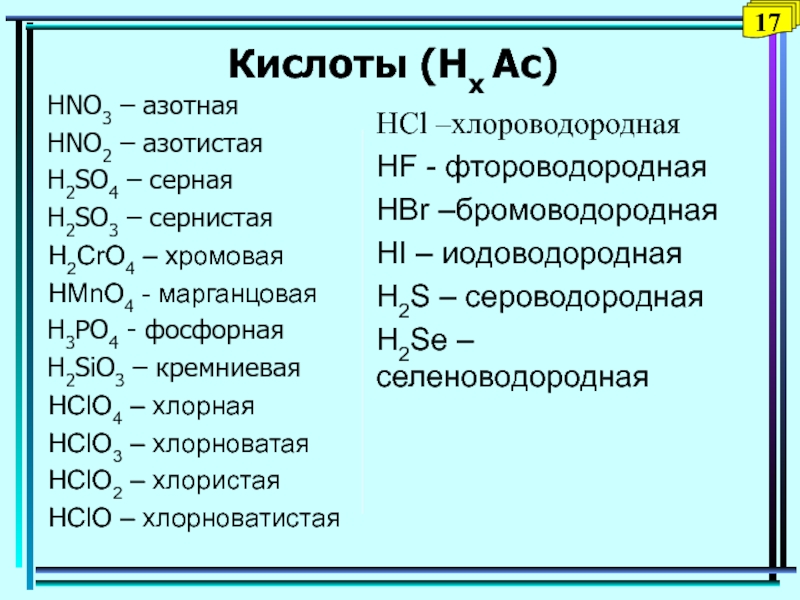
Слайд 34Кислоты (Нх Ас)
HNO3 – азотная
HNO2 – азотистая
H2SO4 – серная
H2SO3 –
сернистая
H2CrO4 – хромовая
HMnO4 - марганцовая
H3PO4 - фосфорная
H2SiO3 – кремниевая
HClO4 –
хлорнаяHClO3 – хлорноватая
HClO2 – хлористая
HClO – хлорноватистая
HCl –хлороводородная
HF - фтороводородная
HBr –бромоводородная
HI – иодоводородная
H2S – сероводородная
H2Sе – селеноводородная
17
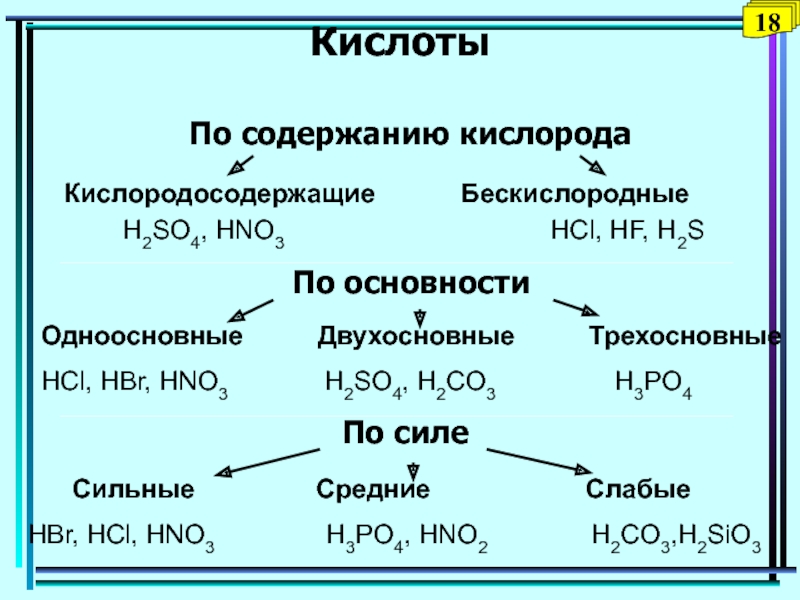
Слайд 35Кислоты
По содержанию кислорода
По основности
По силе
Кислородосодержащие
Бескислородные
H2SO4, HNO3
HCl, HF, H2SОдноосновные Двухосновные Трехосновные
HCl, HBr, HNO3 H2SO4, H2CO3 H3PO4
Сильные Средние Слабые
HBr, HCl, HNO3 H3PO4, HNO2 H2CO3,H2SiO3
18
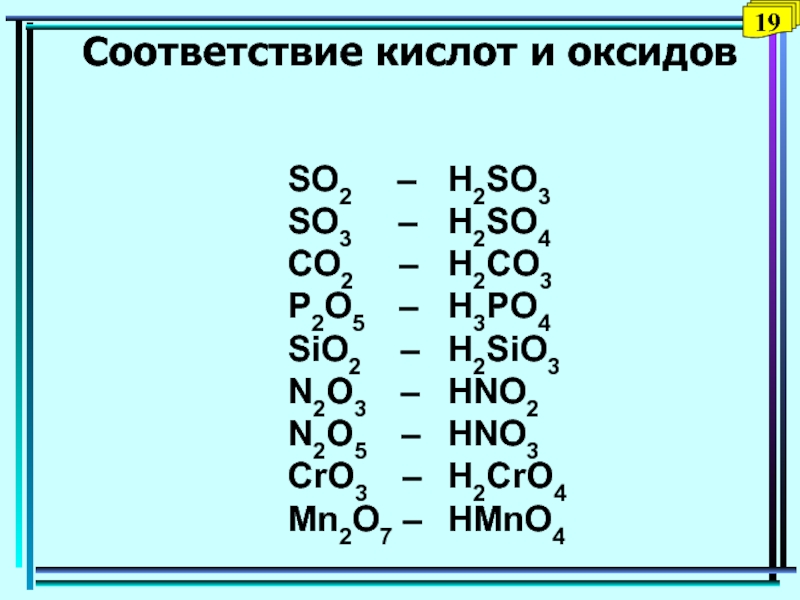
Слайд 36Соответствие кислот и оксидов
SO2
– H2SO3
SO3 –
H2SO4CO2 – H2CO3
P2O5 – H3PO4
SiO2 – H2SiO3
N2O3 – HNO2
N2O5 – HNO3
СrO3 – H2CrO4
Mn2O7 – HMnO4
19
Слайд 37Методы получения кислот
1. Взаимодействие водорода с неметаллами, с последующим растворением
галогенводорода в воде:
H2 + S= H2S
H2 + Cl2= HCl
2. Реакции
кислотных оксидов с водой:SO3 + H2O = H2SO4
3. Взаимодействие солей с кислотами:
NaCN + HCl = NaCl + HCN (вытеснение более сильной кислотой)
NaCl + H2SO4(конц.) = NaHSO4 + HCl↑ (вытеснение менее летучей
кислотой)
AgNO3 + HCl = AgCl↓ + HNO3 (образование осадка)
3. Окисление неметаллов азотной кислотой:
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO↑
S + 2HNO3(конц.) = H2SO4 + 2NO↑
.
20
Слайд 38Общие химические свойства кислот
Реакции обмена:
HCl +NaOH = NaCl
+ H2O (с растворимым основанием)
H2SO4 +Cu(OH)2(тв.) = CuSO4(раствор) + 2H2O
(с нерастворимым основанием) H2SO4 + CuO = CuSO4 + H2O (с основным оксидом)
H2SO4 + ZnO = ZnSO4 + H2O (с амфотерным оксидом)
H2SO4+ BaCl2 = BaSO4↓ + 2HCl (с солью с выпадением осадка)
H2SO4 +Na2SO3 = Na2SO4 + SO2↑ + H2O (с солью с выделением газа)
2. Реакции с металлами с выделением водорода:
Zn + H2SO4 (разб.) = ZnSO4 + H2↑
Mg + 2HCl = MgCl2 + H2↑
3. Окислительно-восстановительные реакции:
4HCl + MnO2 = MnCl2 + Cl2 + 2H2O кислота-восстановитель
2H2SO4 (конц.) + Cu = CuSO4 + SO2 + 2H2O кислота-окислитель
2H2S + H2SO3 = 3S↓ + 3H2O одна кислота-восстановитель
другая-окислитель
21
Слайд 39Соли Мex (AC)у (норм.)
Нормальные (средние)
NaCl, Na2SO4, Na3PO4
Кислые
NaHSO4, Na2HPO4, NaH2PO4
Основные
MgOHCl,
Al(OH)2NO3
Двойные (смешанные)
KAl(SO4)2, Fe(NH4)2(SO4)2
Комплексные
Na2[Zn(OH)4], K3[Fe(CN)6]
22
Слайд 40Методы получения солей
1. Взаимодействие металла с неметаллом:↑
2Na + Cl2 =
2NaCl
2. Взаимодействие двух оксидов:
Na2O + SO3 = Na2SO4
3. Взаимодействие
основных оксидов с кислотами:FeO + 2HCl = FeCl2+H2O
4. Взаимодействие кислотных оксидов с основаниями:
CO2+2KOH = K2СO3+H2O
5. Взаимодействие кислот с основаниями (р. нейтрализации):
HCl + KOH = KCl +H2O
6. Взаимодействие кислот с солями:
CaCO3 + 2HCl = CaCl2+CO2↑+H2O
7. Взаимодействие оснований с солями:
MgSO4 + 2KOH = Mg(OH)2↓ + K2SO4
8. Взаимодействие двух солей:
K2S + ZnCl2=ZnS ↓+2 KCl
9. Взаимодействие металла с кислотами: Zn + 2HCl = ZnCl2+H2↑
10. Взаимодействие металла с солями: Fe+CuSO4=Cu+FeSO4
23
Слайд 41Химические свойства солей
1. Взаимодействие c металлами:
Zn+CuSO4=Cu+ZnSO4
2. Взаимодействие cо
щелочами
СuSO4 + 2KOH = Cu(OH)2↓ + K2SO4
3. Взаимодействие с кислотами:
CaCO3
+ 2HCl = CaCl2+CO2↑+H2O 4. Взаимодействие двух солей:
Na2SO4 +BaCl2 = BaSO4↓+ NaCl
K2S + ZnCl2 = ZnS ↓+2 KCl
5. Разложение при нагревании:
CaCO3= CaO +CO2↑
24
Слайд 42Генетическая связь между классами неорганических соединений
Элемент – Оксид –
–
Основание (кислота) – Соль
Fe Fe2O3 Fe2(SO4)3
Fe(OH)3Fe(OH)(NO3)2 Fe(NO3)3 Fe
25
Слайд 43Литература
Кафедра химии УрГАУ/ ВКонтакте
Vk.com/club86527277
Тел кафедры: 221-41-03
1. О.С. Габриелян и
др. Химия. Учебное пособие/.
М.: Академия, 2012.
2. И.К. Циткович. Курс
аналитической химии. – Изд. “Лань”, 2007.
3. И.И. Грандберг. Н.Л. Нам. Органическая химия.-
Дрова, 2009.
Дополнительная:
Г.П. Хомченко, И.К. Циткович. Неорганическая
химия. – М.. Высшая школа, 2009.
Методические указания для самостоятельной работы
32
Слайд 4433
Вопросы к экзамену
по общей и неорганической химии
1. Понятия: материя,
вещество. Предмет науки химия
2. Качественная и количественная характеристика состава атомов
3.
Строение электронных оболочек атомов. Квантовые числа. Энергетические уровни и подуровни, атомные электронные орбитали4. Правила составления электронных формул и схем строения электронных оболочек атомов (принцип минимальной энергии, правила Клечковского, Хунда, принцип Паули)
5. Периодический закон Д.И. Менделеева. Сущность периодического закона. Строение периодической системы
6. Семейства s-, p-, d- и f-элементов
7. Основные типы химической связи (ковалентная, ионная, металлическая), механизм их образования и свойства
8. Классы сложных неорганических соединений. Состав, номенклатура, химические свойства и реакции оксидов, кислот, оснований и солей
Слайд 4534
Вопросы к экзамену (продолжение)
9. Основные законы химии: закон сохранения массы
вещества, закон постоянства состава вещества, закон Авогадро и два следствия
из него. Применение этих законов для вычисления состава, массы и объема веществ10. Основы термохимии. Тепловой эффект химической реакции, изменение энтальпии химической реакции. Закон Гесса. Пример расчета изменения энтальпии реакции
11. Понятия скорости гомогенной и гетерогенной реакций. Зависимость скорости химической реакции от концентрации реагирующих веществ, давления, температуры. Закон действия масс, правило Вант-Гоффа.
12. Сущность химического равновесия и условие его наступления. Константа химического равновесия. Определение направления смещение химического равновесия в соответствии с принципом Ле Шателье.
13. Понятие раствор. Типы растворов. Способы выражения состава (концентрации) растворов
14. Теория электролитической диссоциации. Степень и константа диссоциации. Сильные и слабые электролиты
15. Диссоциация воды, ионное произведение воды. Водородный показатель. Шкала рН растворов
16. Реакции ионного обмена, условия их протекания. Порядок составления ионных уравнений
17. Гидролиз солей
18. Сущность окислительно-восстановительных реакций и условие их протекания. Степени окисления атомов и порядок их определения. Составление уравнений окислительно-восстановительных реакции на основе метода электронного баланса
19. Комплексные соединения металлов, их состав и поведение (устойчивость) в растворах. Константа нестойкости комплексных ионов.
21. Химия биогенных элементов. Понятие о микроэлементах.






![Уральский государственный
аграрный университет
д.х.н., проф. Хонина Татьяна Примеры гибридизации (sp)4Be: [He]2s24Be*: [He]2s12p1s-АО + p-АО = 2sp-АО 124Be: 1s2 2s2BeF29F: 1s2 2s2 2p5 Примеры гибридизации (sp)4Be: [He]2s24Be*: [He]2s12p1s-АО + p-АО = 2sp-АО 124Be: 1s2 2s2BeF29F: 1s2 2s2 2p5](/img/thumbs/91301ec938e10b5a482a8080a0f11d87-800x.jpg)
![Уральский государственный
аграрный университет
д.х.н., проф. Хонина Татьяна Примеры гибридизации (sp2)5B: [He]2s22p15B*: [He]2s12p2s-АО + 2p-АО = 3sp2-АО Плоский треугольник135B: Примеры гибридизации (sp2)5B: [He]2s22p15B*: [He]2s12p2s-АО + 2p-АО = 3sp2-АО Плоский треугольник135B: 1s2 2s2 2p19F: 1s2 2s2 2p5](/img/thumbs/5b439fc950a9b18268976c54f5dc76dc-800x.jpg)
![Уральский государственный
аграрный университет
д.х.н., проф. Хонина Татьяна Примеры гибридизации (sp3) 6С: [He]2s22p26С*: [He]2s12p3s-АО + 3p-АО = 4sp3-АО Тетраэдр146С: 1s2 2s2 2p2 Примеры гибридизации (sp3) 6С: [He]2s22p26С*: [He]2s12p3s-АО + 3p-АО = 4sp3-АО Тетраэдр146С: 1s2 2s2 2p2](/img/thumbs/fb049261bb8da59265cc013c65c4801e-800x.jpg)












![Уральский государственный
аграрный университет
д.х.н., проф. Хонина Татьяна Соли Мex (AC)у (норм.)Нормальные (средние) NaCl, Na2SO4, Na3PO4Кислые NaHSO4, Na2HPO4, NaH2PO4Основные MgOHCl, Al(OH)2NO3Двойные (смешанные) KAl(SO4)2, Fe(NH4)2(SO4)2Комплексные Na2[Zn(OH)4], K3[Fe(CN)6]22 Соли Мex (AC)у (норм.)Нормальные (средние) NaCl, Na2SO4, Na3PO4Кислые NaHSO4, Na2HPO4, NaH2PO4Основные MgOHCl, Al(OH)2NO3Двойные (смешанные) KAl(SO4)2, Fe(NH4)2(SO4)2Комплексные Na2[Zn(OH)4], K3[Fe(CN)6]22](/img/thumbs/663d96bd8e339e7adc8b84810333d1c5-800x.jpg)