Слайд 1
ВВЕДЕНИЕ В ТИТРИМЕТРИЧЕСКИЙ АНАЛИЗ.
КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ
Выполнила:Жандарбек М
2016
Слайд 2План
1. Титриметрические методы
2. Классификация титриметрических методов анализа
3. Титрованные (стандартные)
растворы
4. Способы и методы титрования
5. Сущность кислотно-основного титрования
6. Первичные стандарты
метода кислотно-основного титрования
7. рН-индикаторы
8. Способы подбора индикаторов
Слайд 3Закон эквивалентов
СМэ1 ∙ V1 = СМэ2 ∙ V2 ,
где
СМэ – молярная концентрация эквивалента;
V – объем.
Слайд 4 Фактор эквивалентности fэ
2NaOH + H2СO3 ↔ Na2СO3 + 2H2O
fэ(H2СO3)
= ½.
NaOH + H2СO3 ↔ NaНСO3 + H2O
fэ(H2СO3) =
1.
Слайд 5Молярной массой эквивалента вещества называют массу одного моля эквивалента этого
вещества, равную произведению фактора эквивалентности на молярную массу вещества.
Мэ =
fэ ∙ М
Мэ(H2СO3) = fэ(H2СO3) ∙ М(H2СO3) = 1/2 ∙ 106,0 = 53,00 г/моль;
Мэ(H2СO3) = fэ(H2СO3) ∙ М(H2СO3) = 1 ∙ 106,0 = 106,0 г/моль.
Слайд 6Классификация титриметрических методов анализа
1. Кислотно-основное титрование – основано на реакции
переноса ионов водорода от одной реагирующей частицы к другой в
растворе:
НА + В ↔ ВН+ + А-
ацидиметрию (ацидиметрическое титрование) – определение веществ титрованием стандартным раствором кислоты (Н3О+);
алкалиметрию (алкалиметрическое титрование) – определение веществ титрованием стандартным раствором сильного основания (ОН-);
протолитометрию (титрование в неводных средах).
Слайд 7 2. Окислительно-восстановительное титрование (редокс-метрия) – основано на реакции переноса электронов
от восстановителя к окислителю:
Ох1 + Red2 ↔ Red1 + Ox2
оксидиметрические методы (титрование раствором окислителя): перманганатометрия, иодатометрия, дихроматометрия, бромо- и броматометрия, цериметрия, йодхлорметрия и др.;
редуктометрические методы (титрование раствором восстановителя): аскорбинометрия, титанометрия, феррометрия и др.
Слайд 8 3. Осадительное титрование – основано на реакции образования малорастворимых соединений:
nКm+ + mАn- ↔ КnАm
Различают: аргентометрию, меркурометрию, тиоцианатометрию и др.
4. Комплексиметрическое титрование – основано на реакции образования слабодиссоциирующего растворимого комплекса:
М + nL ↔ [M(L)n]
Различают: комплексонометрию, меркуриметрию, фториметрию.
Слайд 9 Способ приготовленного титра
Т – титр раствора, г/мл;
а – масса
навески вещества, г;
Vк – вместимость мерной колбы, мл;
СМэ – молярная
концентрация эквивалента раствора;
Мэ' – миллимолярная масса эквивалента вещества.
Слайд 11 Навеску установочного вещества для приготовления определенного объема V раствора с
молярной концентрацией СМ или молярной концентрацией эквивалента СМэ рассчитывают по
формулам:
Для твердых веществ:
Для растворов:
С% - процентная концентрация вещества в исходном растворе.
Слайд 12Прямое титрование
CH3COOH + NaOH ↔ CH3COONa + H2O
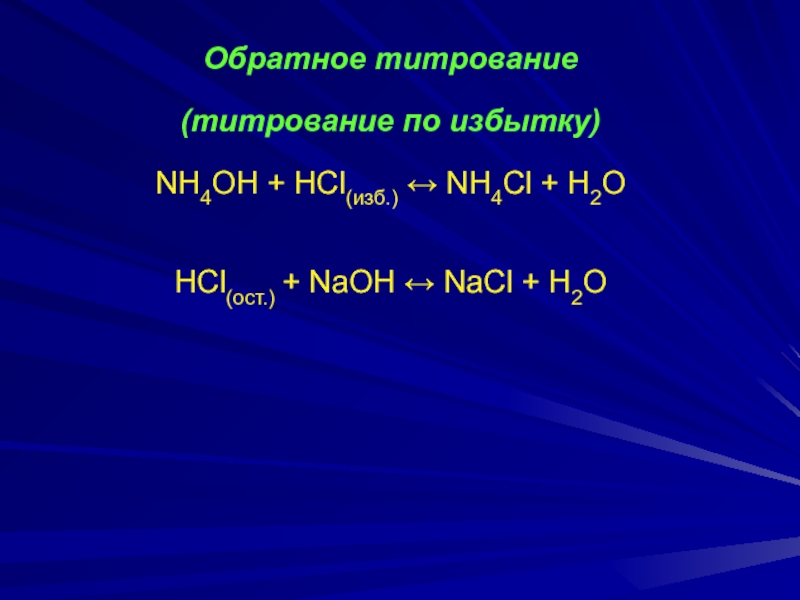
Слайд 13Обратное титрование
(титрование по избытку)
NH4ОH + HCl(изб.) ↔ NH4Cl
+ H2O
HCl(ост.) + NaOH ↔ NaCl + H2O
Слайд 14 Заместительное титрование
Например, методом алкалиметрии способом прямого титрования Н3PO4 титруется
только по 1 и 2 ступеням. Для того, чтобы оттитровать
Н3PO4 по 3 ступеням используют способ заместительного титрования:
2H3PO4 + 3CaCl2(изб.) ⇄ Ca3(PO4)2↓ + 6HCl
HCl + NaOH ⇄ HCl + H2O
Слайд 15Различают:
метод пипетирования;
метод отдельных навесок.
Слайд 16
Сущность кислотно-основного титрования
В основе метода кислотно-основного титрования лежат реакции, связанные
с переносом ионов водорода между веществами, проявляющими кислотно-основные свойства.
НА +
В ↔ НВ+ + А-
а1 b2 а2 b1
Слайд 17 Титранты метода КОТ
В методе ацидиметрии в качестве
титрантов применяют 0,01-1 М растворы кислот (HCl, H2SO4, HNO3, HClO4),
в методе алкалиметрии – 0,01-1 М растворы щелочей (NaOH, KOH, Ba(OH)2).
Слайд 18Тетраборат натрия декагидрат, бура (Na2B4O7 ∙10H2O)
B4O72- + 2H+ + 5H2O
⇄ 4H3BO3
fэ (Na2B4O7 . 10H2O) = ½
индикатор – метиловый красный,
метиловый оранжевый
Слайд 19Карбонат натрия (Na2CO3)
CO32- + 2H+ ⇄ H2CO3
fэ (Na2CO3) = ½
индикатор
– метиловый красный, метиловый оранжевый
CO32- + H+ ⇄ HCO3 –
fэ
(Na2CO3) = 1
индикатор – фенолфталеин
Слайд 20Щaвeлeвaя киcлотa H2C2O4·2 H2O
H2C2O4 + 2OH- ⇄ C2O4 2- +
2H2О
fэ (H2C2O4) = ½
индикатор – фенолфталеин
Янтарная кислота
H2C4H4O4
H2C4H4O4 + 2OH- ⇄ C4H4O42-
fэ (H2C4H4O4) = ½
индикатор – фенолфталеин
Слайд 21
Бeнзoйнaя киcлoтa C6 H5 COOH
C6H5COOH + OH- ⇄
C6Н5СОО- + H2О
fэ (C6H5COOH ) = 1
индикатор – фенолфталеин
Сaлицилoвaя киcлoтa
C6H4(OH)COOH
fэ (C6H4(ОН)COOH ) = 1
индикатор – фенолфталеин
Слайд 23HCl + NaOH ↔ NaCl + H2O
H+ + OH- ↔
H2O
CH3COOH + NaOH ↔ CH3COONa + H2O
CH3COOH + OH- ↔
CH3COO- + H2O
NH4ОH + HCl ↔ NH4Cl + H2O
NH4ОH + H+ ↔ NH4+ + H2O
Слайд 24Для построения кривой титрования рассчитывают:
рН исходного раствора,
рН в момент
полунейтрализации,
рН в начале скачка титрования (анализируемый раствор недотитрован на
0,1%),
рН в точке эквивалентности,
рН в конце скачка титрования (анализируемый раствор перетитрован на 0,1%).
Слайд 25
С визуальным фиксированием конечной точки титрования (КТТ) можно оттитровать вещества,
у которых Ка, Кb ≥ 5·10-8
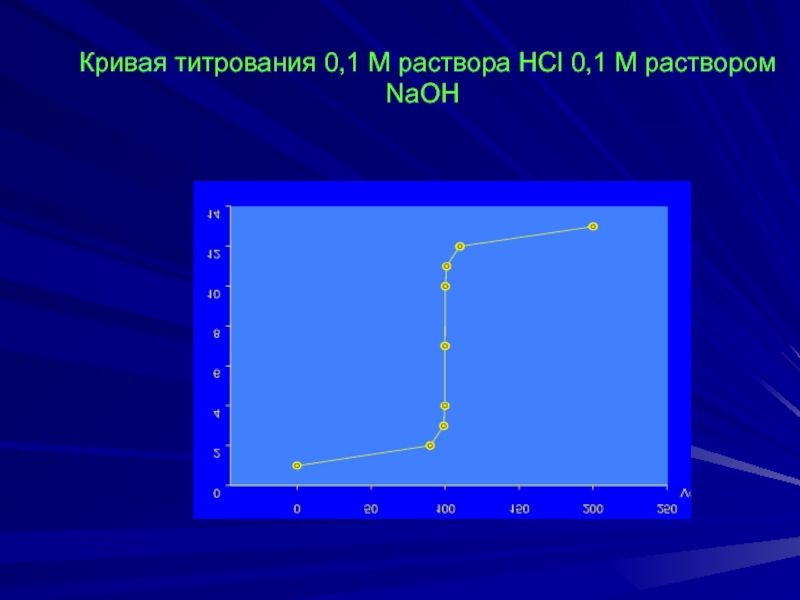
Слайд 26 Кривая титрования 0,1 М раствора HCl 0,1 М раствором NaOH
Слайд 27 Кривая титрования раствора HCl раствором NaOH:
1 – 1 М
растворы, 2 – 0,1 М растворы,
3 – 0,01 М
растворы, 4 – 0,001 М растворы
Слайд 28
Кривая титрования 0,1 М раствора CH3COOH 0,1 М раствором
NaOH
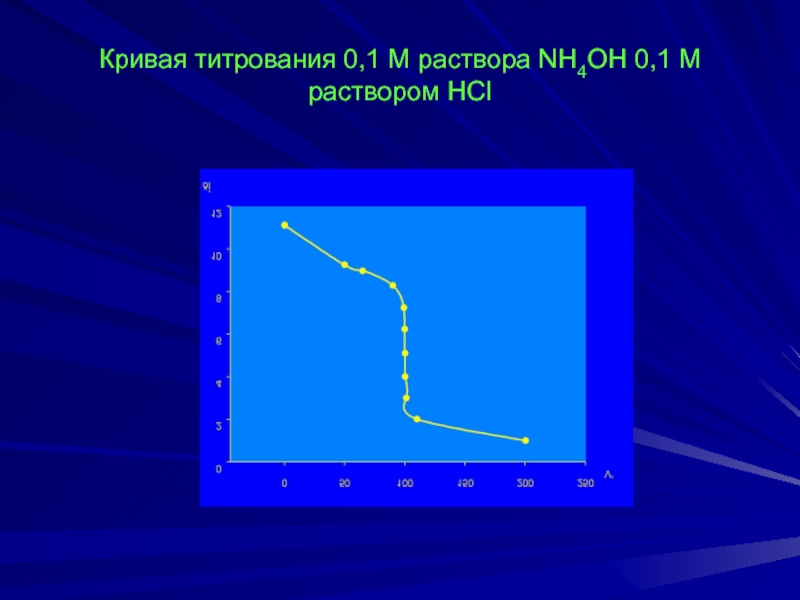
Слайд 29Кривая титрования 0,1 М раствора NH4OH 0,1 М раствором HCl