Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
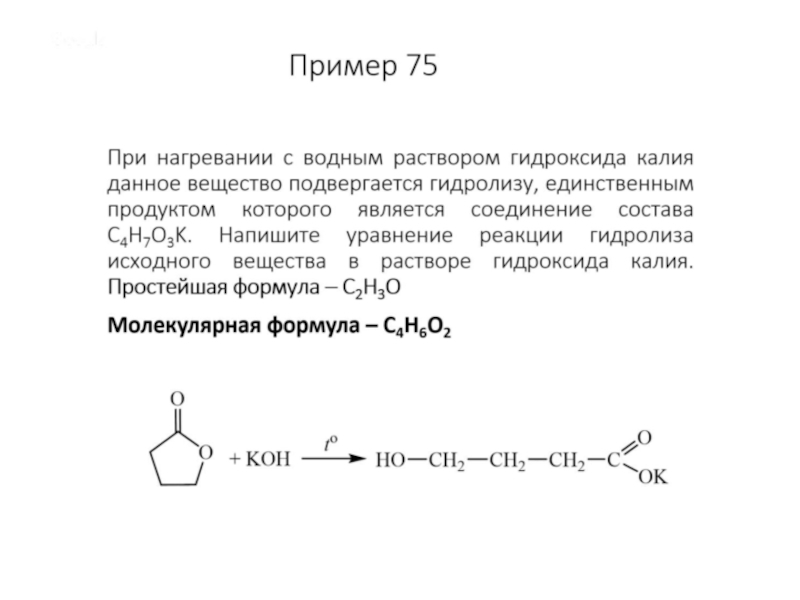
Задачи 34
Содержание
- 1. Задачи 34
- 2. Задачи 34
- 3. m (NaOH) = 240 г* 0,1 =
- 4. 000,40,20,42х + х = 0,63х = 0,6Х
- 5. m (NaOH)ост = 40 г* 0,4 моль
- 6. n (Mg(NO3)2) = 44,4 г : 148г/моль
- 7. 0,30,240000,240,480,120,240,484х + х = 0,65х = 0,6Х
- 8. m (ZnSO4) исх= 483 г* 0,2 =
- 9. m р-ра кон. = m р-ра нач
- 10. 0,10,100,60,4нед0,2m (KOH)ост = 56* 0,2 = 11,2
- 11. m (FeSO4) исх= 532 г* 0,2 =
- 12. m см. Ме. кон. = m см.
- 13. нед0,42,20,41,60,60m (NaOH)ост = 40* 0,6 = 24
- 14. Слайд 14
- 15. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3m (NaOH) = 240 г* 0,1 = 24 г
n (NaOH)
= 24 г : 40г/моль = 0,6 моль
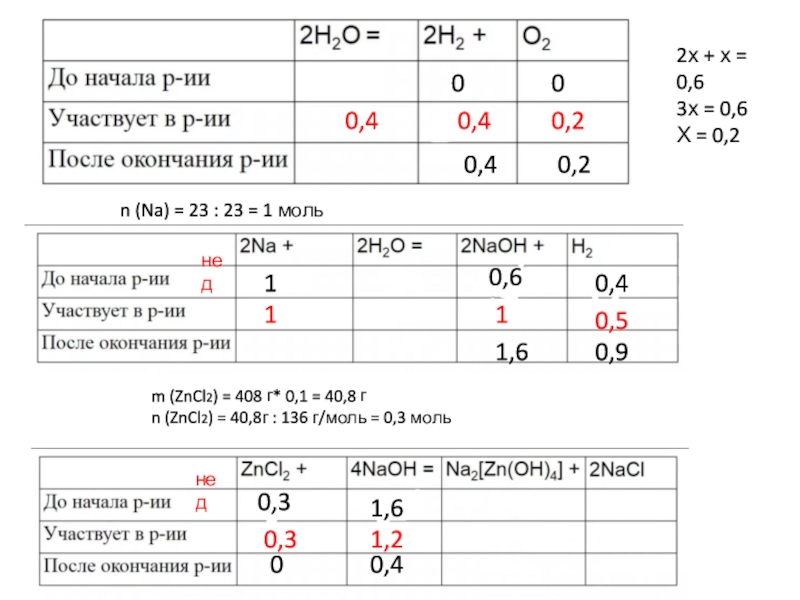
13,44 л : 22,4 л/моль = 0,6 мольСлайд 40
0
0,4
0,2
0,4
2х + х = 0,6
3х = 0,6
Х = 0,2
0,4
0,2
n (Na)
= 23 : 23 = 1 моль
1
1
0,6
1
0,4
0,5
0,9
1,6
нед
m (ZnCl2) = 408
г* 0,1 = 40,8 гn (ZnCl2) = 40,8г : 136 г/моль = 0,3 моль
0,3
1,6
нед
0,3
0
1,2
0,4
Слайд 5m (NaOH)ост = 40 г* 0,4 моль = 16 г
m
кон.р-ра = 240 – 1,8 – 6,4 + 23 +
408 = 662,8 гm (H2) всего = 0,9 моль * 2 г/моль = 1,8 г
m (О2) всего = 0,2 моль * 32 г/моль = 6,4 г
W (NaOH) = 16 : 662,8 = 0,0241 = 2,41%
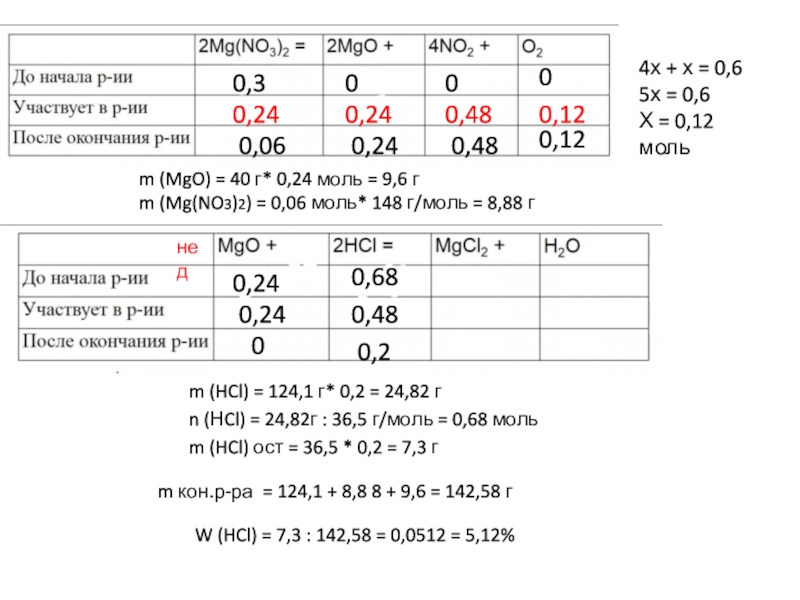
Слайд 70,3
0,24
0
0
0
0,24
0,48
0,12
0,24
0,48
4х + х = 0,6
5х = 0,6
Х = 0,12 моль
0,06
0,12
m
(MgO) = 40 г* 0,24 моль = 9,6 г
m (Mg(NO3)2)
= 0,06 моль* 148 г/моль = 8,88 г0,24
0,68
нед
m (HCl) = 124,1 г* 0,2 = 24,82 г
n (НCl) = 24,82г : 36,5 г/моль = 0,68 моль
m (HCl) ост = 36,5 * 0,2 = 7,3 г
0,24
0,48
0
0,2
m кон.р-ра = 124,1 + 8,8 8 + 9,6 = 142,58 г
W (HCl) = 7,3 : 142,58 = 0,0512 = 5,12%
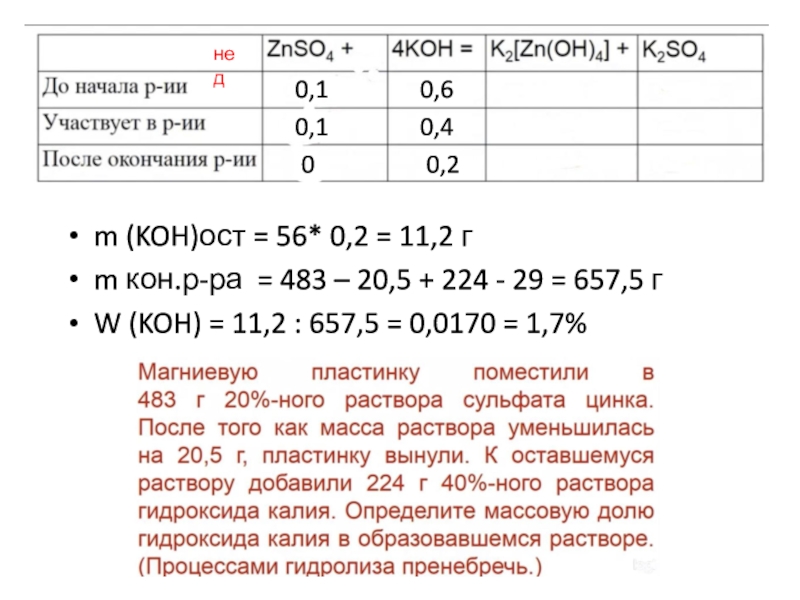
Слайд 8m (ZnSO4) исх= 483 г* 0,2 = 96,6 г
n (ZnSO4)
исх = 96,6 г : 161г/моль = 0,6 моль
m (KOH)
исх = 224 г * 0,4 = 89,6 гn (KOH) исх = 89,6 : 56 = 1,6 моль
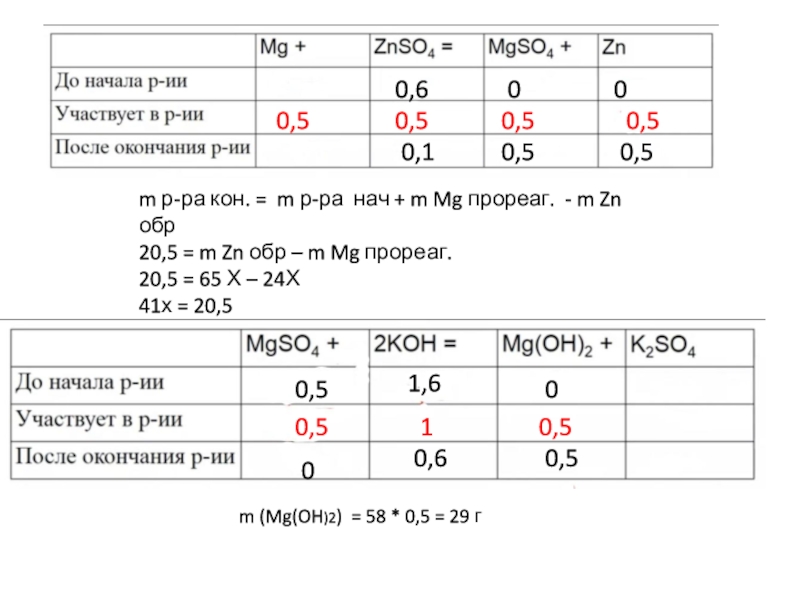
Слайд 9m р-ра кон. = m р-ра нач + m Mg
прореаг. - m Zn обр
20,5 = m Zn обр –
m Mg прореаг.20,5 = 65 Х – 24Х
41х = 20,5
Х = 0,5 моль
0,5
0,5
0,5
0,5
0,6
0,1
0,5
0,5
0
0
1
1,6
0
0,5
0,5
0,5
0
0,6
0,5
m (Mg(OH)2) = 58 * 0,5 = 29 г
Слайд 100,1
0,1
0
0,6
0,4
нед
0,2
m (KOH)ост = 56* 0,2 = 11,2 г
m кон.р-ра =
483 – 20,5 + 224 - 29 = 657,5 г
W (KOH) = 11,2 : 657,5 = 0,0170 = 1,7%
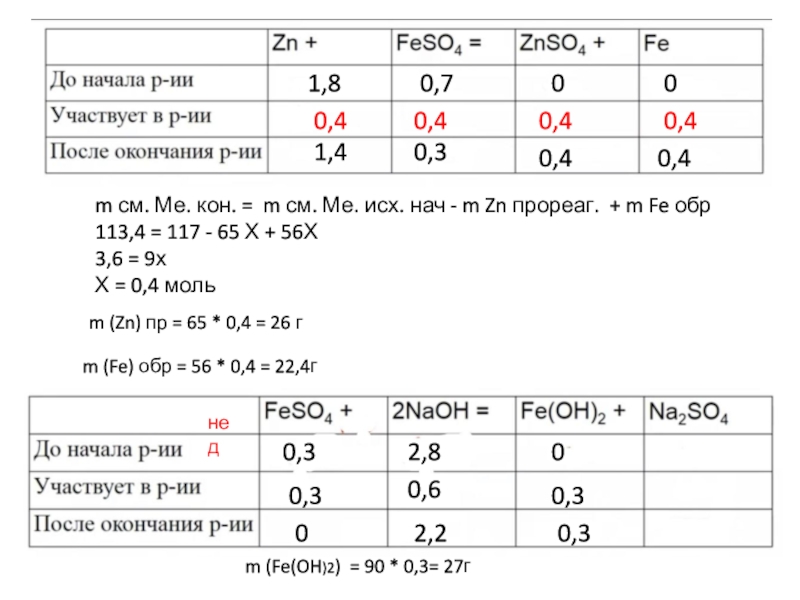
Слайд 11m (FeSO4) исх= 532 г* 0,2 = 106,4 г
n (FeSO4)
исх = 106,4 г : 152г/моль = 0,7 моль
n (Zn)
= 117 : 65 = 1,8 мольm (NaOH) исх = 280 г * 0,4 = 112 г
n (NaOH) исх = 112/40 = 2,8 моль
Слайд 12m см. Ме. кон. = m см. Ме. исх. нач
- m Zn прореаг. + m Fe обр
113,4 = 117
- 65 Х + 56Х3,6 = 9х
Х = 0,4 моль
0,4
0,4
0,4
0,4
1,8
0,7
0
0
1,4
0,3
0,4
0,4
m (Zn) пр = 65 * 0,4 = 26 г
m (Fe) обр = 56 * 0,4 = 22,4г
0,3
нед
0,3
2,8
0,6
0
2,2
0,3
0
0,3
m (Fe(OH)2) = 90 * 0,3= 27г
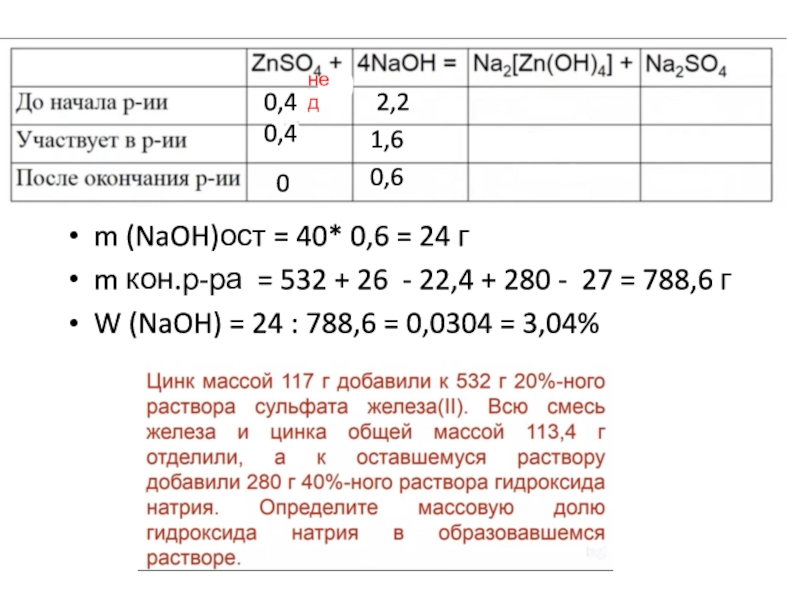
Слайд 13нед
0,4
2,2
0,4
1,6
0,6
0
m (NaOH)ост = 40* 0,6 = 24 г
m кон.р-ра =
532 + 26 - 22,4 + 280 - 27 =
788,6 гW (NaOH) = 24 : 788,6 = 0,0304 = 3,04%