Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
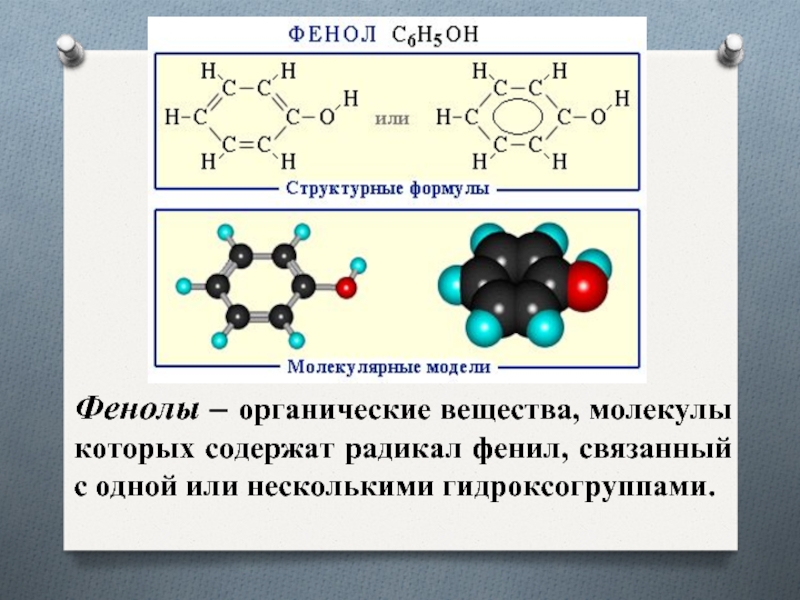
Фенолы
Содержание
- 1. Фенолы
- 2. План: ФенолыКлассификация феноловНоменклатураСтроение молекулыФизические свойства фенолаХимические свойства фенолаПолучение феноловПрименение фенолаГенетическая связь
- 3. Фенолы – органические вещества, молекулы которых содержат радикал фенил, связанный с одной или несколькими гидроксогруппами.
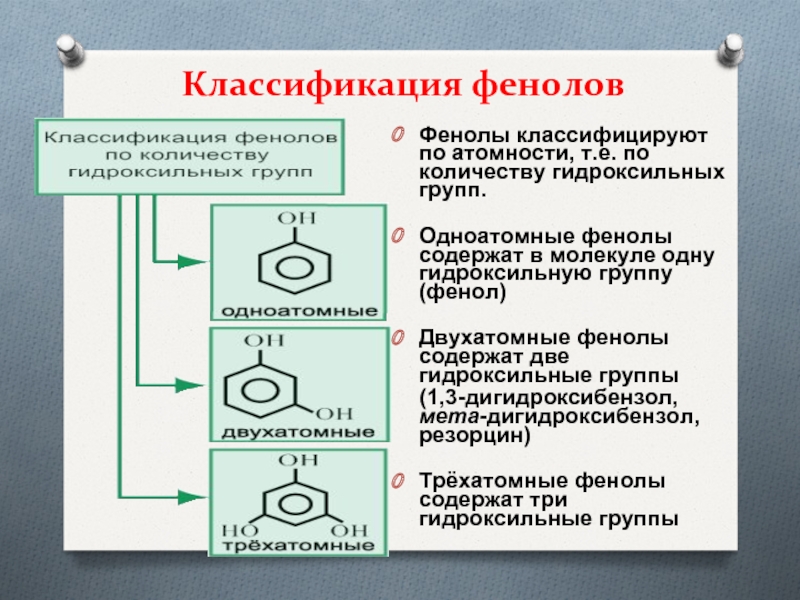
- 4. Классификация феноловФенолы классифицируют по атомности, т.е. по
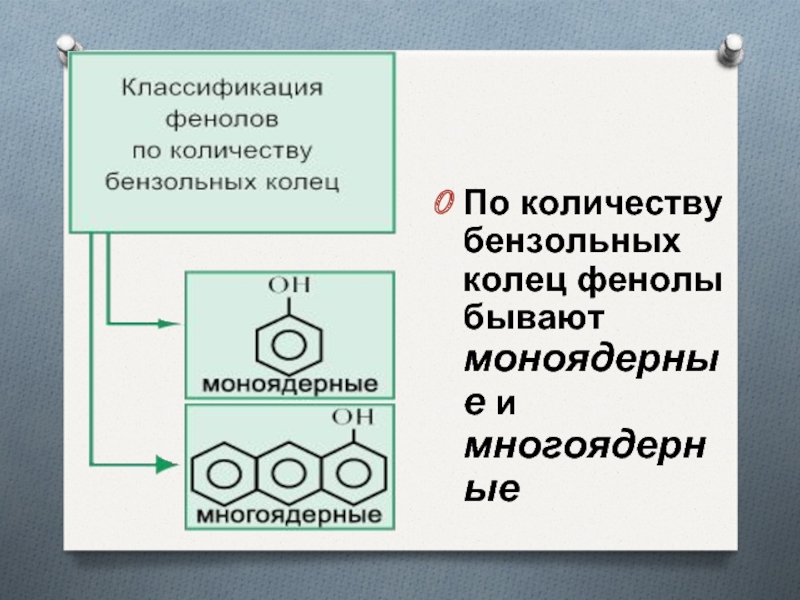
- 5. По количеству бензольных колец фенолы бывают моноядерные и многоядерные
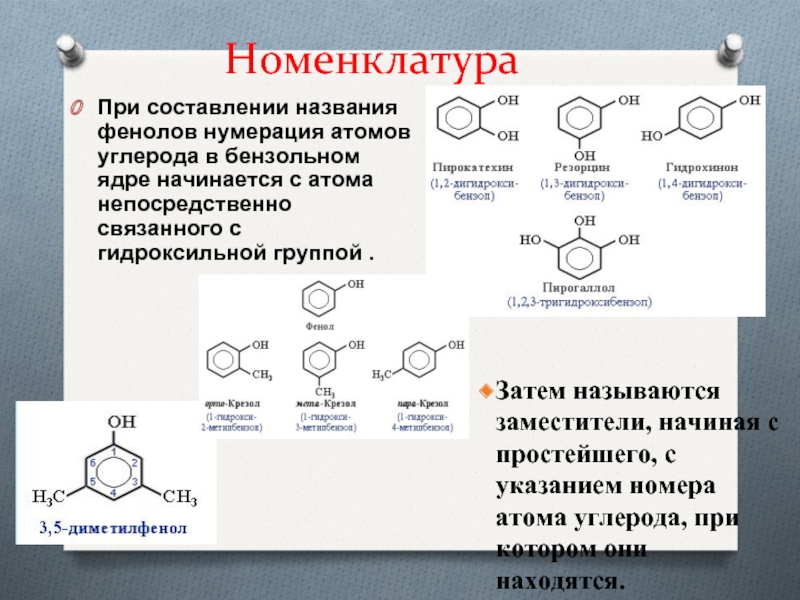
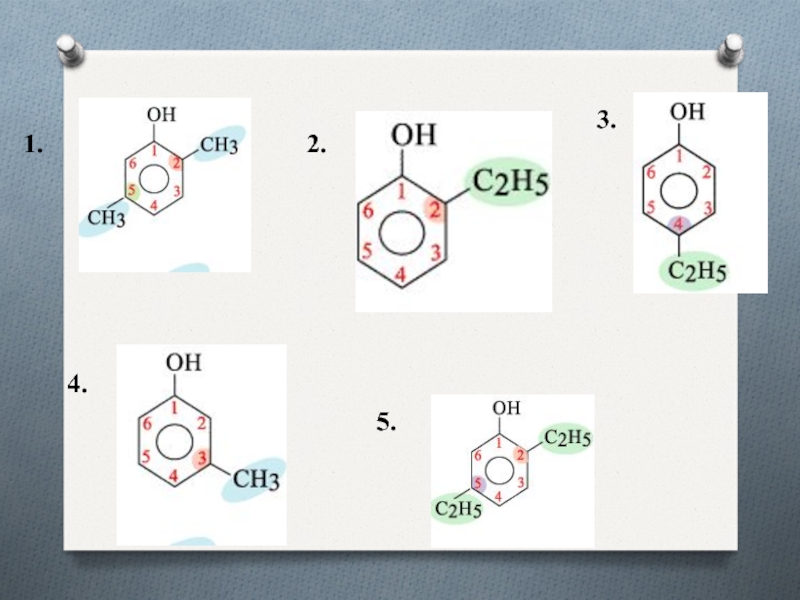
- 6. НоменклатураПри составлении названия фенолов нумерация атомов углерода
- 7. 1.2.3.4.5.
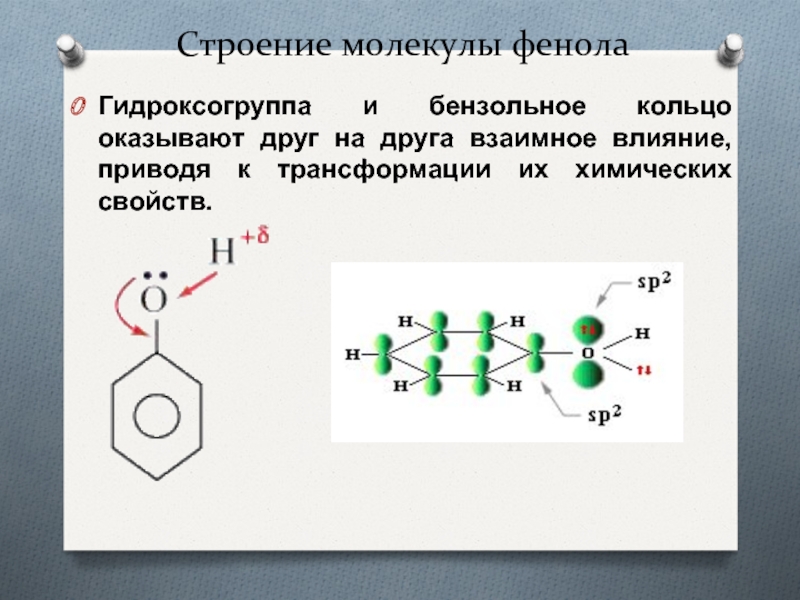
- 8. Строение молекулы фенолаГидроксогруппа и бензольное кольцо оказывают
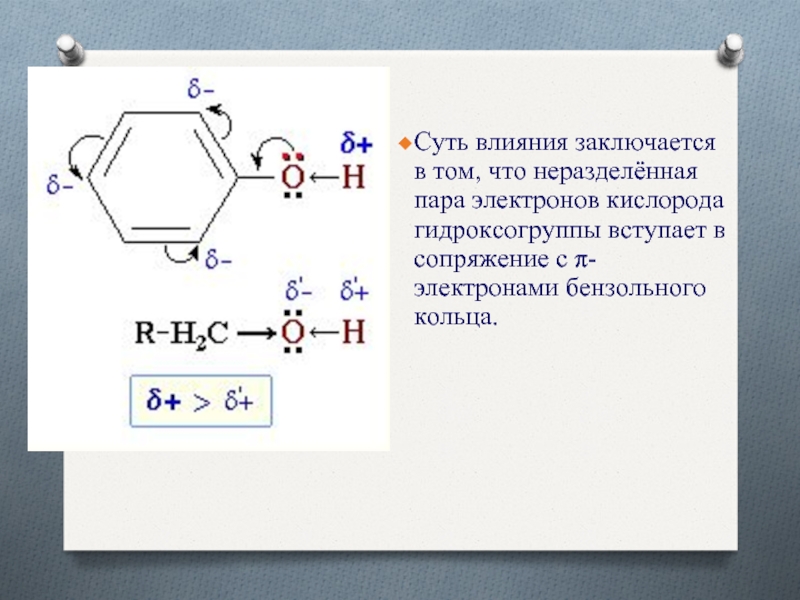
- 9. Суть влияния заключается в том, что неразделённая
- 10. Физические свойства фенолаФенол - твёрдое бесцветное кристаллическое
- 11. Фенол ядовит! При попадании на кожу вызывает ожоги поэтому с фенолом необходимо обращаться осторожно!
- 12. Химические свойства фенолаХимические свойства фенола обусловлены наличием в его молекулегидроксильной группыбензольного ядра
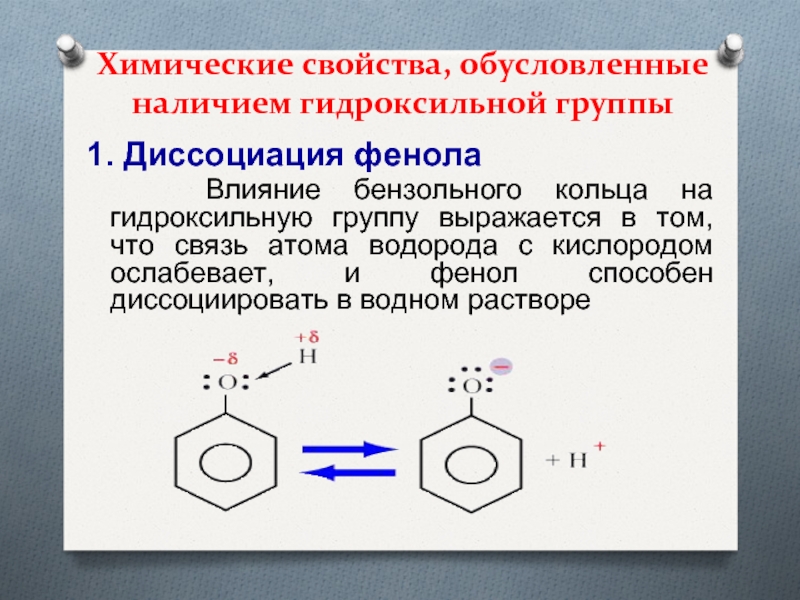
- 13. Химические свойства, обусловленные наличием гидроксильной группы1. Диссоциация
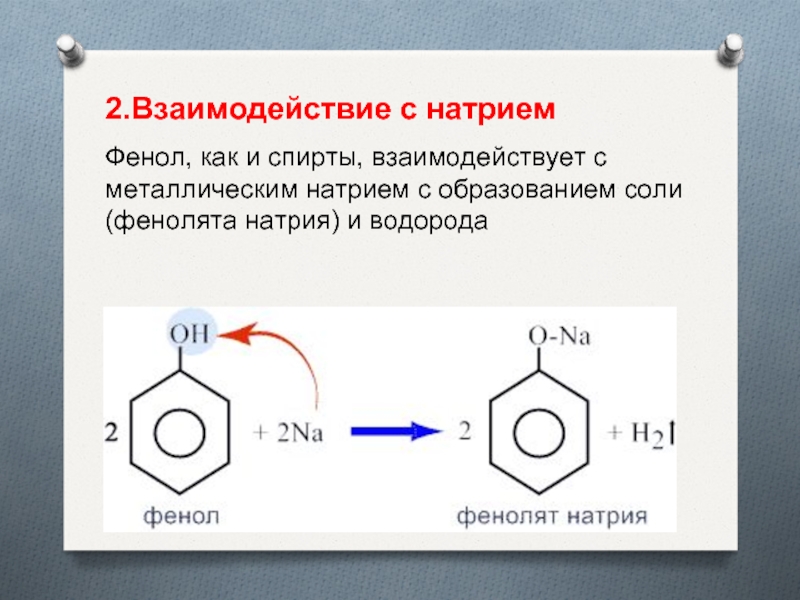
- 14. 2.Взаимодействие с натриемФенол, как и спирты, взаимодействует
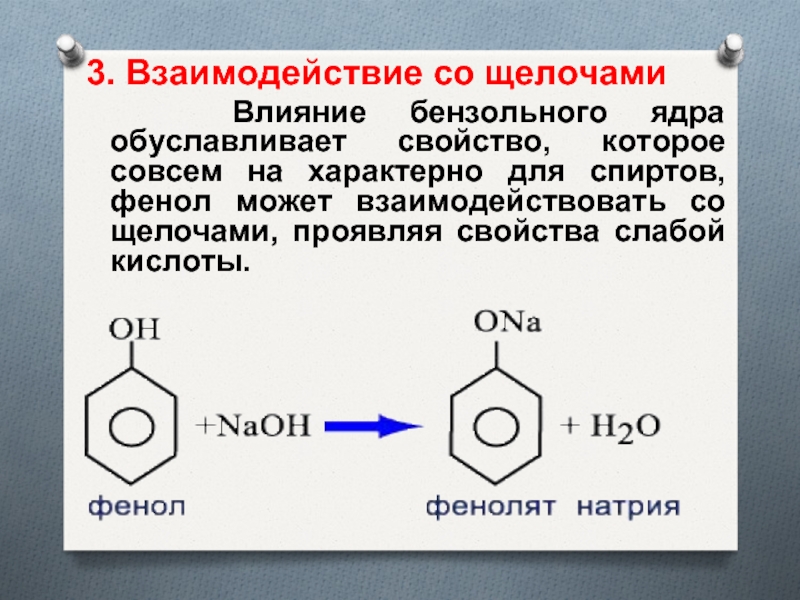
- 15. 3. Взаимодействие со щелочами Влияние
- 16. Слайд 16
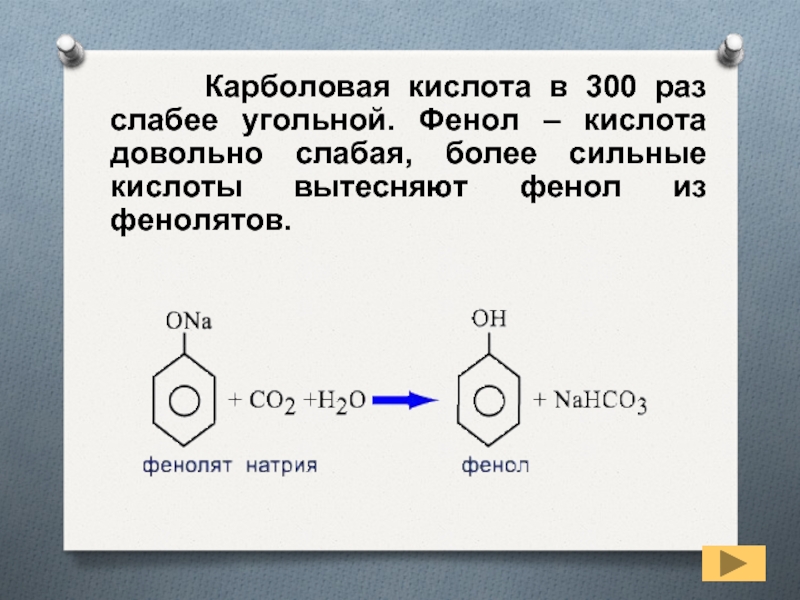
- 17. Карболовая кислота в
- 18. Химические свойства, обусловленные наличием бензольного ядра
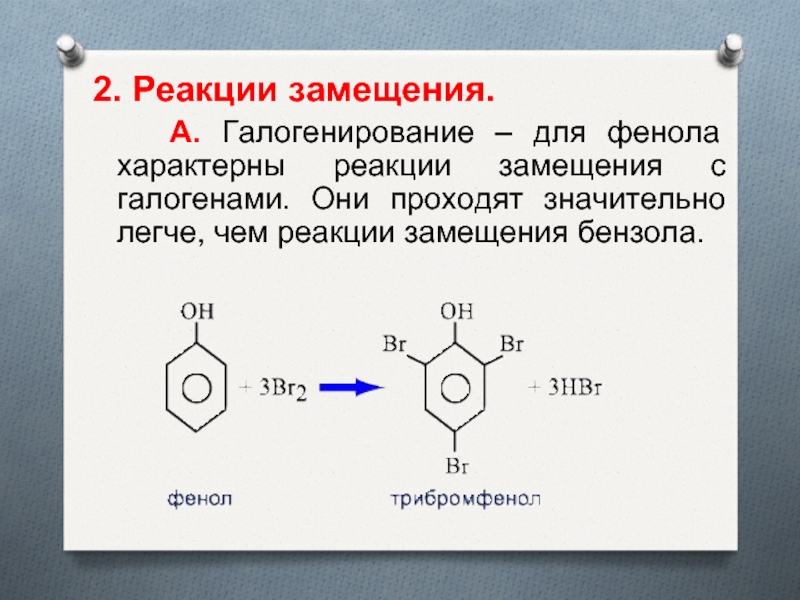
- 19. 2. Реакции замещения. А. Галогенирование –
- 20. Слайд 20
- 21. Б. Нитрование фенола Нитрование фенола также происходит легче, чем нитрование бензола.
- 22. В результате полного нитрования фенола образуется 2,4,6-тринитрофенол (пикриновая кислота) –взрывчатое вещество.
- 23. 3. Реакции гидрирования При нагревании в
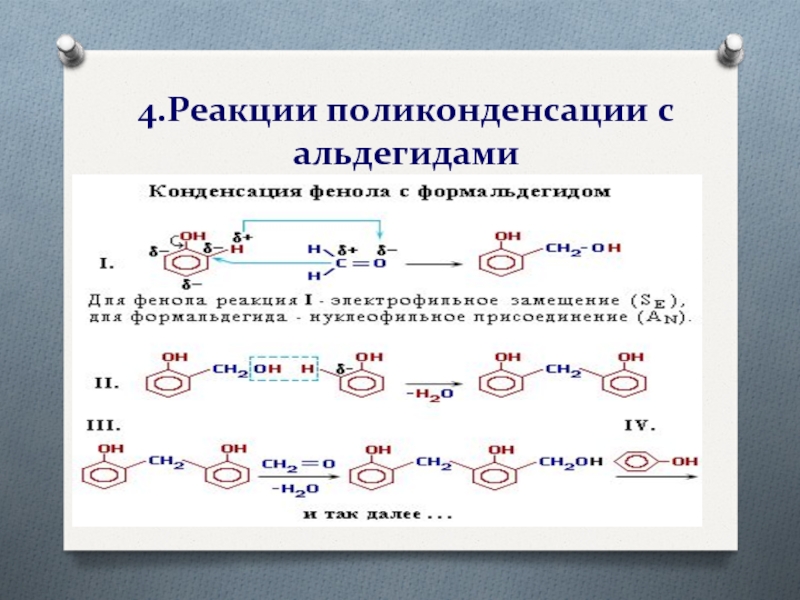
- 24. 4.Реакции поликонденсации с альдегидами
- 25. 5. Качественная реакция на фенол
- 26. Слайд 26
- 27. Получение фенола 1. Фенол выделяют из каменноугольной смолы. 2. Синтез фенола из бензола
- 28. Применение фенола.Фенол применяют для производства фенолформальдегидных пластмасс,
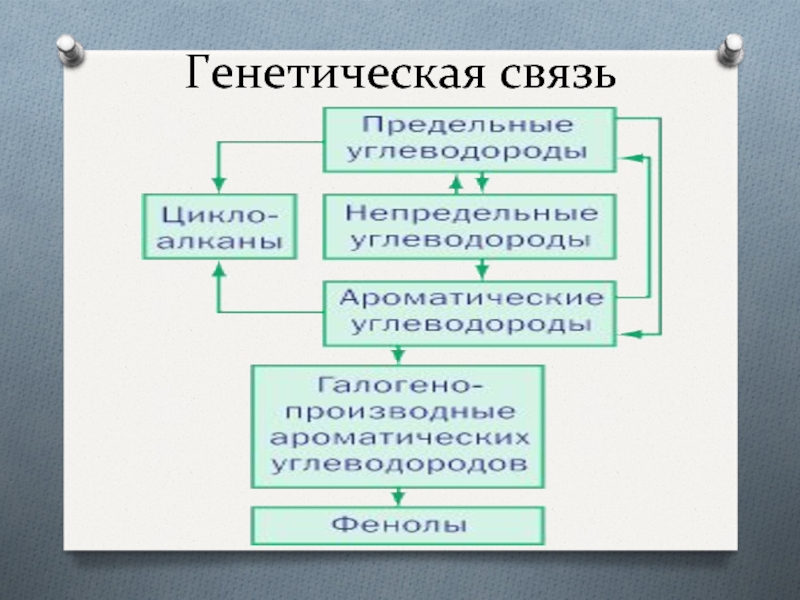
- 29. Генетическая связь
- 30. Скачать презентанцию
План: ФенолыКлассификация феноловНоменклатураСтроение молекулыФизические свойства фенолаХимические свойства фенолаПолучение феноловПрименение фенолаГенетическая связь
Слайды и текст этой презентации
Слайд 2План:
Фенолы
Классификация фенолов
Номенклатура
Строение молекулы
Физические свойства фенола
Химические свойства фенола
Получение фенолов
Применение фенола
Генетическая
связь
Слайд 3Фенолы – органические вещества, молекулы которых содержат радикал фенил, связанный
с одной или несколькими гидроксогруппами.
Слайд 4Классификация фенолов
Фенолы классифицируют по атомности, т.е. по количеству гидроксильных групп.
Одноатомные фенолы содержат в молекуле одну гидроксильную группу (фенол)
Двухатомные фенолы
содержат две гидроксильные группы (1,3-дигидроксибензол, мета-дигидроксибензол, резорцин)
Трёхатомные фенолы содержат три гидроксильные группы
Слайд 6Номенклатура
При составлении названия фенолов нумерация атомов углерода в бензольном ядре
начинается с атома непосредственно связанного с гидроксильной группой .
Затем
называются заместители, начиная с простейшего, с указанием номера атома углерода, при котором они находятся.Слайд 8Строение молекулы фенола
Гидроксогруппа и бензольное кольцо оказывают друг на друга
взаимное влияние, приводя к трансформации их химических свойств.
Слайд 9
Суть влияния заключается в том, что неразделённая пара электронов кислорода
гидроксогруппы вступает в сопряжение с π-электронами бензольного кольца.
Слайд 10Физические свойства фенола
Фенол - твёрдое бесцветное кристаллическое вещество. Вследствие частичного
окисления на воздухе он бывает окрашен в розовый цвет. Его
температура плавления +42ºС, температура кипения +181ºС. Фенол обладает резким характерным запахом. В холодной воде он мало растворим, но уже при 70 ºС растворяется в любых отношениях.Слайд 11Фенол ядовит! При попадании на кожу вызывает ожоги поэтому с
фенолом необходимо обращаться осторожно!
Слайд 12Химические свойства фенола
Химические свойства фенола обусловлены наличием в его молекуле
гидроксильной
группы
бензольного ядра
Слайд 13Химические свойства, обусловленные наличием гидроксильной группы
1. Диссоциация фенола
Влияние
бензольного кольца на гидроксильную группу выражается в том, что связь
атома водорода с кислородом ослабевает, и фенол способен диссоциировать в водном раствореСлайд 142.Взаимодействие с натрием
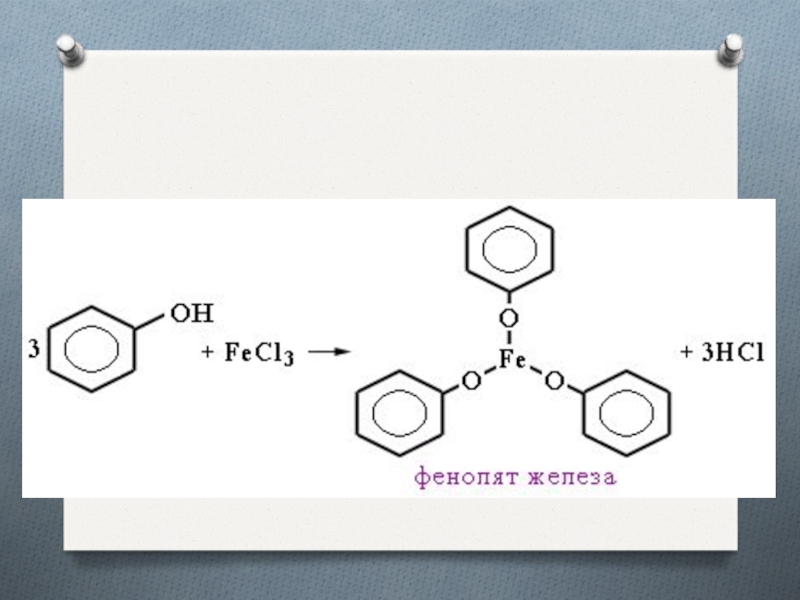
Фенол, как и спирты, взаимодействует с металлическим натрием
с образованием соли (фенолята натрия) и водорода
Слайд 153. Взаимодействие со щелочами
Влияние бензольного ядра обуславливает
свойство, которое совсем на характерно для спиртов, фенол может взаимодействовать
со щелочами, проявляя свойства слабой кислоты.Слайд 17
Карболовая кислота в 300 раз слабее
угольной. Фенол – кислота довольно слабая, более сильные кислоты вытесняют
фенол из фенолятов.
Слайд 18Химические свойства, обусловленные наличием бензольного ядра
Отличия от
ароматических углеводородов:
1. Реакции окисления
Фенол окисляется кислородом воздуха, приобретая фиолетовую
окраску.Слайд 192. Реакции замещения.
А. Галогенирование – для фенола характерны
реакции замещения с галогенами. Они проходят значительно легче, чем реакции
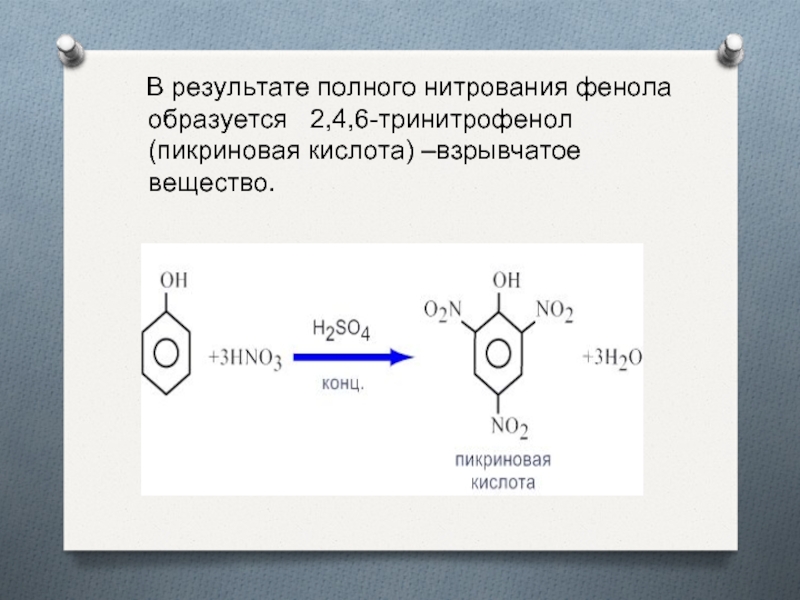
замещения бензола.Слайд 22 В результате полного нитрования фенола образуется 2,4,6-тринитрофенол
(пикриновая кислота) –взрывчатое вещество.
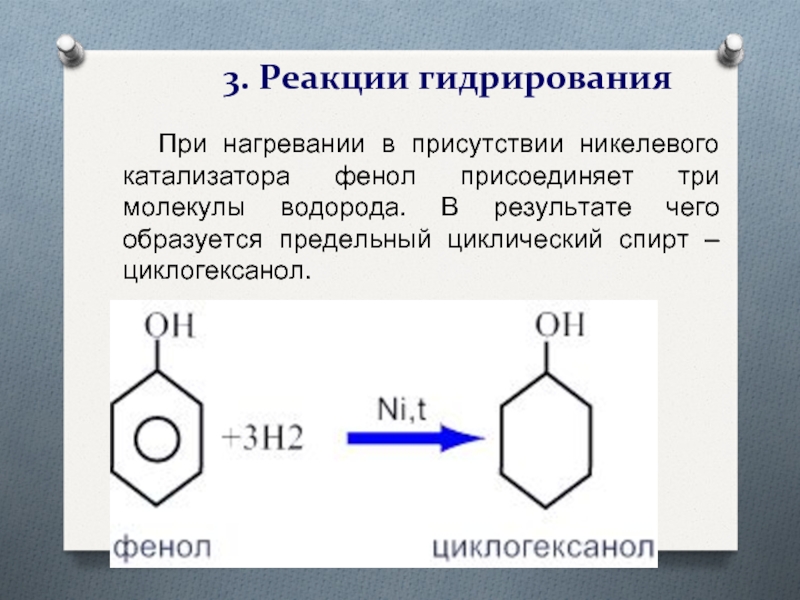
Слайд 233. Реакции гидрирования
При нагревании в присутствии никелевого катализатора
фенол присоединяет три молекулы водорода. В результате чего образуется предельный
циклический спирт – циклогексанол.Слайд 28Применение фенола.
Фенол применяют для производства фенолформальдегидных пластмасс, синтетического волокна капролактам,
красителей, лекарств, взрывчатых веществ и других продуктов.
Теги