Слайд 2СТРОЕНИЕ БЕЛКОВ
Белки — высокомолекулярные органические соединения, состоящие из остатков α-аминокислот.
В
состав белков входят углерод, водород, азот, кислород, сера. Часть белков
образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь.
Белки обладают большой молекулярной массой: яичный альбумин — 36 000, гемоглобин — 152 000, миозин — 500 000. Для сравнения: молекулярная масса спирта — 46, уксусной кислоты — 60, бензола — 78.
Слайд 3АМИНОКИСЛОТНЫЙ СОСТАВ БЕЛКОВ
Белки — непериодические полимеры, мономерами которых являются α-аминокислоты.
Обычно в качестве мономеров белков называют 20 видов α-аминокислот, хотя
в клетках и тканях их обнаружено свыше 170.
В зависимости от того, могут ли аминокислоты синтезироваться в организме человека и других животных, различают: заменимые аминокислоты — могут синтезироваться; незаменимые аминокислоты — не могут синтезироваться. Незаменимые аминокислоты должны поступать в организм вместе с пищей. Растения синтезируют все виды аминокислот.
Слайд 4АМИНОКИСЛОТНЫЙ СОСТАВ БЕЛКОВ
В зависимости от аминокислотного состава, белки бывают:
полноценными
— содержат весь набор аминокислот;
неполноценными — какие-то аминокислоты в их
составе отсутствуют. Если белки состоят только из аминокислот, их называют простыми. Если белки содержат помимо аминокислот еще и неаминокислотный компонент (простетическую группу), их называют сложными. Простетическая группа может быть представлена металлами (металлопротеины), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины).
Слайд 5АМИНОКИСЛОТНЫЙ СОСТАВ БЕЛКОВ
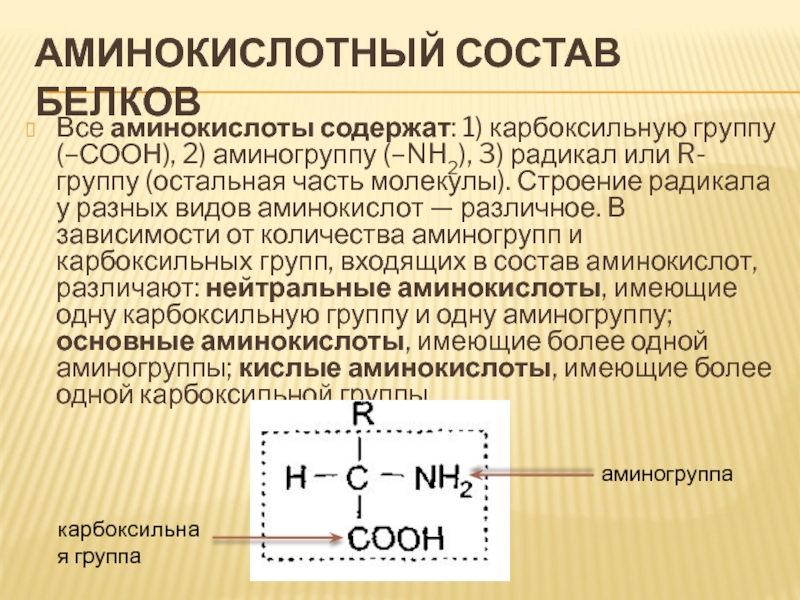
Все аминокислоты содержат: 1) карбоксильную группу (–СООН), 2)
аминогруппу (–NH2), 3) радикал или R-группу (остальная часть молекулы). Строение
радикала у разных видов аминокислот — различное. В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают: нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу; основные аминокислоты, имеющие более одной аминогруппы; кислые аминокислоты, имеющие более одной карбоксильной группы.
аминогруппа
карбоксильная группа
Слайд 6ПЕПТИДНАЯ СВЯЗЬ
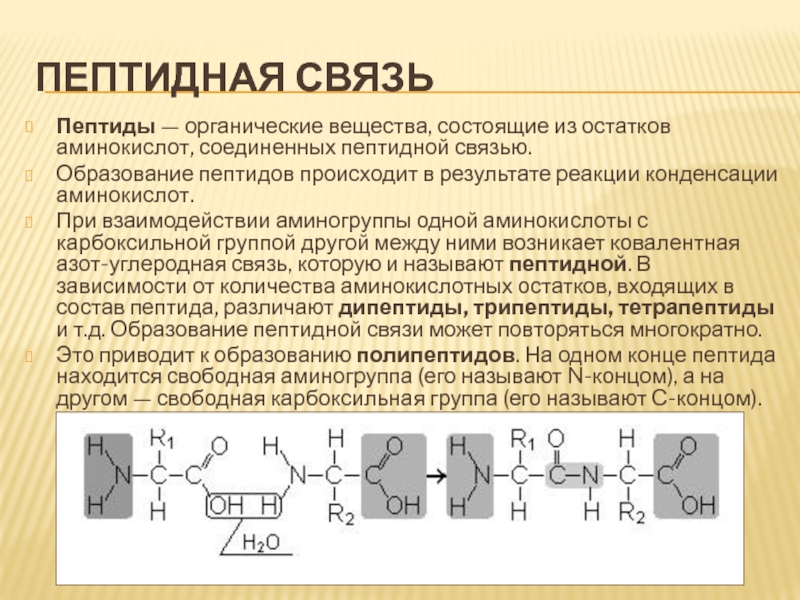
Пептиды — органические вещества, состоящие из остатков аминокислот, соединенных
пептидной связью.
Образование пептидов происходит в результате реакции конденсации аминокислот.
При
взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой между ними возникает ковалентная азот-углеродная связь, которую и называют пептидной. В зависимости от количества аминокислотных остатков, входящих в состав пептида, различают дипептиды, трипептиды, тетрапептиды и т.д. Образование пептидной связи может повторяться многократно.
Это приводит к образованию полипептидов. На одном конце пептида находится свободная аминогруппа (его называют N-концом), а на другом — свободная карбоксильная группа (его называют С-концом).
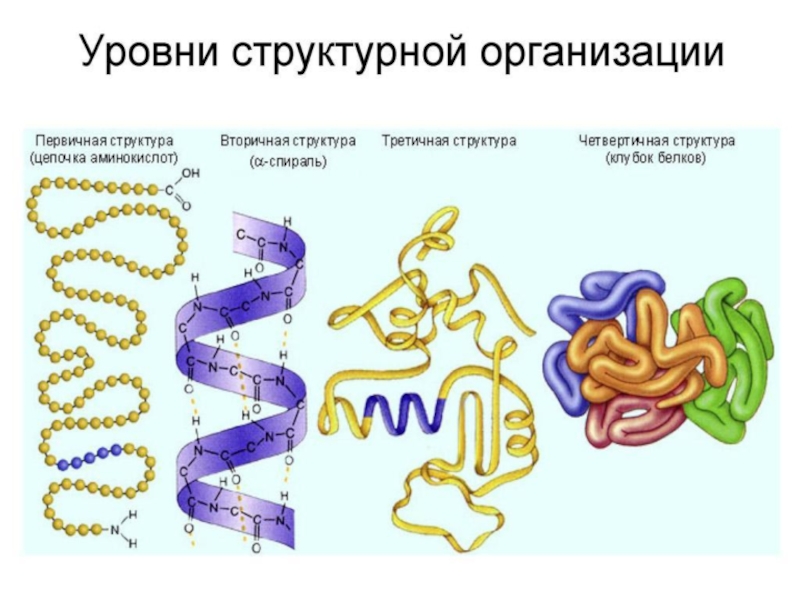
Слайд 7ПРОСТРАНСТВЕННАЯ ОРГАНИЗАЦИЯ БЕЛКОВЫХ МОЛЕКУЛ
Выполнение белками определенных специфических функций зависит от
пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать
белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Выделяют 4 уровня пространственной организации белков: первичный, вторичный, третичный и четвертичный.
Слайд 9ПЕРВИЧНАЯ СТРУКТУРА БЕЛКА
Это последовательность расположения аминокислотных остатков в полипептидной
цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная.
Если молекула
белка состоит всего из 10 аминокислотных остатков, то число теоретически возможных вариантов белковых молекул, отличающихся порядком чередования аминокислот, — 1020. Имея 20 аминокислот, можно составить из них еще большее количество разнообразных комбинаций. В организме человека обнаружено порядка десяти тысяч различных белков, которые отличаются как друг от друга, так и от белков других организмов.
Слайд 10ВТОРИЧНАЯ СТРУКТУРА
Это упорядоченное свертывание полипептидной цепи в спираль (имеет
вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между
карбоксильными группами и аминогруппами.
Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).
Слайд 11ТРЕТИЧНАЯ СТРУКТУРА
укладка полипептидных цепей в глобулы, возникающая в результате
возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий
между радикалами аминокислотных остатков.
Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина.
На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.
Слайд 12ЧЕТВЕРТИЧНАЯ СТРУКТУРА
Она характерна для сложных белков, молекулы которых образованы
двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным,
гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи.
Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо.
Слайд 13СВОЙСТВА БЕЛКОВ
Белки сочетают в себе основные и кислотные свойства, определяемые
радикалами аминокислот: чем больше кислых аминокислот в белке, тем ярче
выражены его кислотные свойства.
Способность отдавать и присоединять Н+ определяют буферные свойства белков; один из самых мощных буферов — гемоглобин в эритроцитах, поддерживающий рН крови на постоянном уровне.
Есть белки растворимые (фибриноген), есть нерастворимые, выполняющие механические функции (фиброин, кератин, коллаген).
Есть белки активные в химическом отношении (ферменты), есть химически неактивные, устойчивые к воздействию различных условий внешней среды и крайне неустойчивые.
Слайд 14СВОЙСТВА БЕЛКОВ
Внешние факторы (нагревание, ультрафиолетовое излучение, тяжелые металлы и их
соли, изменения рН, радиация, обезвоживание) могут вызывать нарушение структурной организации
молекулы белка.
Процесс утраты трехмерной конформации, присущей данной молекуле белка, называют денатурацией. Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка. Первоначально рвутся наиболее слабые связи, а при ужесточении условий и более сильные. Поэтому сначала утрачивается четвертичная, затем третичная и вторичная структуры. Изменение пространственной конфигурации приводит к изменению свойств белка и, как следствие, делает невозможным выполнение белком свойственных ему биологических функций.
Если денатурация не сопровождается разрушением первичной структуры, то она может быть обратимой, в этом случае происходит самовосстановление свойственной белку конформации. Такой денатурации подвергаются, например, рецепторные белки мембраны.
Процесс восстановления структуры белка после денатурации называется ренатурацией. Если восстановление пространственной конфигурации белка невозможно, то денатурация называется необратимой.