Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Атомная физика
Содержание
- 1. Атомная физика
- 2. Атомная физикаАтомная физика на стыке XIX и
- 3. Строение атома (Резерфорда)Резерфорд Эрнест (1871-1937)-великий английский
- 4. Схема строения атомаРезерфорд предложил свою схему строения
- 5. Модель атома водорода по Бору Нильс Бор
- 6. Теория строения атома по БоруИспользуемая В 1913
- 7. Квантовые постулаты Бора Н.Бор выдвинул
- 8. Первый и второй постулаты Бора1 постулат Бора
- 9. Испускание и поглощение света атомамиАтомы могут самопроизвольно
- 10. Лазеры Слово “лазер” представляет собой аббревиатуру английской
- 11. Устройство рубинового лазераЛазер состоит из трех основных
- 12. Конец XIX века демонстрировал наличие теории, удовлетворяющей
- 13. Положительно заряженная часть атома была открыта
- 14. Эта модель атома легко объясняет явление отклонения
- 15. Постулаты Бора заключаются в следующем: Электрон
- 16. Особенностью индуцированного излучения является то, что
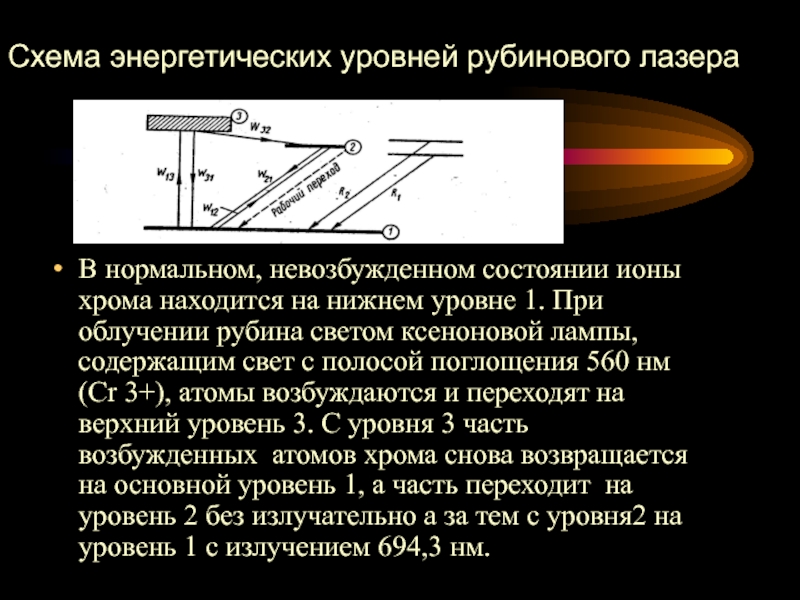
- 17. В нормальном, невозбужденном состоянии ионы хрома находится
- 18. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Содержание
Атомная физика
1.Строение атома (Резерфода)
2.Модель атома водорода по Бору
3.Квантовые постулаты Бора
4.Испускание
и поглощение света атомами
Слайд 2Атомная физика
Атомная физика на стыке XIX и ХХ вв. в
науке свершились открытия, заставившие заколебаться сложившуюся картину мира. Представлениям, основанным
на классической механике, суждено было уступить место новой, остающейся до сих пор во многом не завершенной картине мира.Слайд 3 Строение атома (Резерфорда)
Резерфорд Эрнест (1871-1937)-великий английский физик, уроженец Новой
Зеландии.Своими экспериментальными открытиями Резерфорд заложил основы современного учения о строении
атома и радиоактивности.Слайд 4Схема строения атома
Резерфорд предложил свою схему строения атома: в центре
атома находится положительное ядро, вокруг которого по разным орбиталям вращаются
отрицательные электроны. Центростремительные силы, возникающие при их вращении удерживают их на своих орбиталях и не дают им улететь.Слайд 5Модель атома водорода по Бору
Нильс Бор родился 7 октября
1885 г. в Копенгагене. В 1903 г. Нильс поступает в
Копенгагенский университет. В 1907 г. ему присуждается золотая медаль Королевской Датской академии за экспериментальное исследование поверхностного натяжения жидкостей. В 1909 г. Бор получает степень магистра наук, а затем в феврале 1911 г. - докторскую степень.Слайд 6Теория строения атома по Бору
Используемая В 1913 г. Бор предложил
сою теорию строения атома, в которой ему удалось с большим
искусством согласовать спектральные явления с ядерной моделью атома, применив к последней так называемую квантовую теорию излучения, введенную в науку немецким ученым-физиком Планком.Слайд 7Квантовые постулаты Бора
Н.Бор выдвинул два постулата –
атомная система может находится только в некоторых определенных состояниях, в
которых не происходит излучения света, хотя движение происходит ускоренное, и при переходе из одного состояния в другое происходит или поглощение, или испускание кванта по закону , где постоянная Планка.Слайд 8Первый и второй постулаты Бора
1 постулат Бора гласит: атомная система
может находиться только в особых стационарных, или квантовых, состояниях каждому
из которых соответствует определенная энергия En; в стационарном состоянии атом не излучает.2 постулат Бора гласит: излучение света происходит при переходе атома из стационарного состояния с большей энергией Er в стационарное состояние с меньшей энергией En. Энергия излученного фотона равна разности энергий стационарных состояний.
33 постулат Бора гласит: из всех возможных орбит, стоционарое состояние соответствует только тем для которых момент количества движения электрона кратен постоянной Планка.
Слайд 9Испускание и поглощение света атомами
Атомы могут самопроизвольно испускать кванты света,
при этом оно проходит некогерентно (т.к. каждый атом излучает независимо
от других) и называется спонтанным. Переход электрона с верхнего уровня на нижний может происходит под влиянием внешнего электромагнитного поля с частотой, равной частоте перехода. Такое излучение называют вынужденным (индуцированным).Слайд 10Лазеры
Слово “лазер” представляет собой аббревиатуру английской фразы “Light Amplification
by Stimulated Emission of Radiation”, переводимой как усиление света в
результате вынужденного (индуцированного) излучения. Гипотеза о существовании индуцированного излучения была высказана в 1917 г. А Эйнштейном. Советские ученые Н.Г. Басов и А.М. Прохоров и независимо от них американский физик Ч. Таунс использовали явление индуцированного излучения для создания микроволнового генератора радиоволн с длинной волны =1,27 см.Слайд 11Устройство рубинового лазера
Лазер состоит из трех основных частей: активного (рабочего)
вещества, резонансной системы, представляющей две параллельные пластины с нанесенными на
них отражающими покрытиями, и системы возбуждения (накачки), в качестве которой обычно используется ксеноновая лампа-вспышка с источником питания .Слайд 12Конец XIX века демонстрировал наличие теории, удовлетворяющей практическим потребностям. Явления
электромагнетизма использовались в осветительных и силовых устройствах. Термодинамические концепции привели
к созданию двигателя внутреннего сгорания и химических установок, Электромагнитная теория вызвала к жизни радио. Область физики, занимавшаяся изучением электрических разрядов, проводившиеся с электрическими разрядами в вакууме опыты привели к интересным результатам, а электротехническая промышленность обнаружила потребность в совершенствовании вакуумной техники. Все это усилило интерес к исследованиям в этой области физики.Первым результатом усиления этого интереса было открытие У.Круксом катодных лучей, которые он назвал лучистой формой материи. Д.Стоней назвал катодные лучи электронами, Ж.Перрен обнаружил у них отрицательный заряд, а Д.Томсон измерил их скорость. Следующим шагом было совершено непредвиденное открытие К.Рентгеном - обнаружение Х-лучей (получивших название рентгеновских), исходивших из катодно-лучевой разрядной трубки. Это открытие, помимо практических перспектив, имело важное значение для других областей физики. Первая модель атома, предложенная В.Томсоном и затем Д.Томсоном, включала шарообразное облако положительного заряда, внутри которого находятся электроны, расположенные в этом облаке концентрическими кольцами. Данная модель просуществовала недолго. Но это был первый шаг в раскрытии структуры атома. Следующие модели атома появились уже в ХХ веке (модель Э.Резерфорда и модель Н.Бора).
Слайд 13 Положительно заряженная часть атома была открыта в 1911 г.
Резерфордом при исследовании движения
a-частиц в газах и других веществах.
a-
частицы, выбрасываемые веществами активных элементов представляют собой положительно заряженные ионы гелия, скорость движения которых достигает 20000 км/сек. Благодаря такой огромной скорости a-частицы, пролетая через воздух и сталкиваясь с молекулами газов, выбивают из них электроны. Молекулы, потерявшие электроны, становятся заряженными положительно, выбитые же электроны тотчас присоединяются к другим молекулам, заряжая их отрицательно. Таким образом, в воздухе на пути a-частиц образуются положительно и отрицательно заряженные ионы газа. Исследуя пути движения частиц с помощью камеры, Резерфорд заметил, что в камере они параллельны (пути), а при пропускании пучка параллельных лучей через слой газа или тонкую металлическую пластинку,
они выходят не параллельно, а несколько расходятся, т.е. происходит отклонение частиц от их первоначального пути. Некоторые частицы отклонялись очень сильно, некоторые вообще не проходили через тонкую пластинку.
Слайд 14Эта модель атома легко объясняет явление отклонения a- частиц. Размеры
ядра и электронов очень малы по сравнению с размерами всего
атома, которые определяются орбитами наиболее удаленных от ядра электронов; поэтому большинство a-частиц пролетает через атомы без заметного отклонения. Только в тех случаях, когда a-частицы очень близко подходит к ядру, электрическое отталкивание вызывает резкое отклонение ее от первоначального пути. Таким образом, изучение рассеяние a-частиц положило начало ядерной теории атома. Одной из задач, стоявших перед теорией строения атома в начале ее развития, было определение величины заряда ядра различных атомов. Так как атом в целом электрически нейтрален, то, определив заряд ядра, можно было бы установить и число окружающих ядро электронов.Слайд 15Постулаты Бора заключаются в следующем: Электрон может двигаться вокруг
не по любым орбитам, а только по таким, которые удовлетворяют
определенными условиям, вытекающим из теории квантов. Эти орбиты получили название устойчивых или квантовых орбит. Когда электрон движется по одной из возможных для него устойчивых орбит, то он не излучает. Переход электрона с удаленной орбиты на более близкую сопровождается потерей энергии. Потерянная атомом при каждом переходе энергия превращается в один квант лучистой энергии. Частота излучаемого при этом света определяется радиусами тех двух орбит, между которыми совершается переход электрона. Чем больше расстояние от орбиты, на которой находится электрон, до той, на которую он переходит, тем больше частота излучения. Простейшим из атомов является атом водорода; вокруг ядра которого вращается только один электрон. Исходя из приведенных постулатов, Бор рассчитал радиусы возможных орбит для этого электрона и нашел, что они относятся, как квадраты натуральных чисел: 1 : 2 : 3 : ... n Величина n получила название главного квантового числа. Радиус ближайшей к ядру орбиты в атоме водорода равняется 0,53 ангстрема.Движение электронов в атомах Бор представлял как простое механическое, однако оно является сложным и своеобразным. Это своеобразие было объяснено новой квантовой теорией. Отсюда и пошло: “Карпускулярно-вролновой дуализм”.
И так, электрон в атоме характеризуется:
1. Главным квантовым числом n, указывающим на энергию электрона;
2. Орбитальным квантовым числом l , указывающим на характер орбиты;
3. Магнитным квантовым числом, характеризующим положение облаков в пространстве;
4. И спиновым квантовым числом, характеризующим веретенообразное движение электрона вокруг своей оси.
Слайд 16 Особенностью индуцированного излучения является то, что оно монохроматично и
когерентно. Это свойство положено в основу действия лазеров (оптических квантовых
генераторов). Для того, чтобы вещество усиливало проходящий через него свет, необходимо, чтобы более половины его электронов находилось в возбужденном состоянии. Такое состояние называется состоянием с инверсной населенностью уровней. В этом случае поглощение фотонов будет происходит реже, чем испускание. Для работы лазера на рубиновом стержне используют т.н. лампу накачки, смысл которой заключается в создании инверсной населенности. При этом если один атом перейдет из метастабильного состояния в основное, то возникнет цепная реакция испускания фотонов. При соответствующей (параболической) форме отражающего зеркала, возможно, создать луч в одном направлении. Полное высвечивание всех возбужденных атомов происходит за 10-10с, поэтому мощность лазера достигает миллиардов ватт.Слайд 17В нормальном, невозбужденном состоянии ионы хрома находится на нижнем уровне
1. При облучении рубина светом ксеноновой лампы, содержащим свет с
полосой поглощения 560 нм (Cr 3+), атомы возбуждаются и переходят на верхний уровень 3. С уровня 3 часть возбужденных атомов хрома снова возвращается на основной уровень 1, а часть переходит на уровень 2 без излучательно а за тем с уровня2 на уровень 1 с излучением 694,3 нм.Схема энергетических уровней рубинового лазера