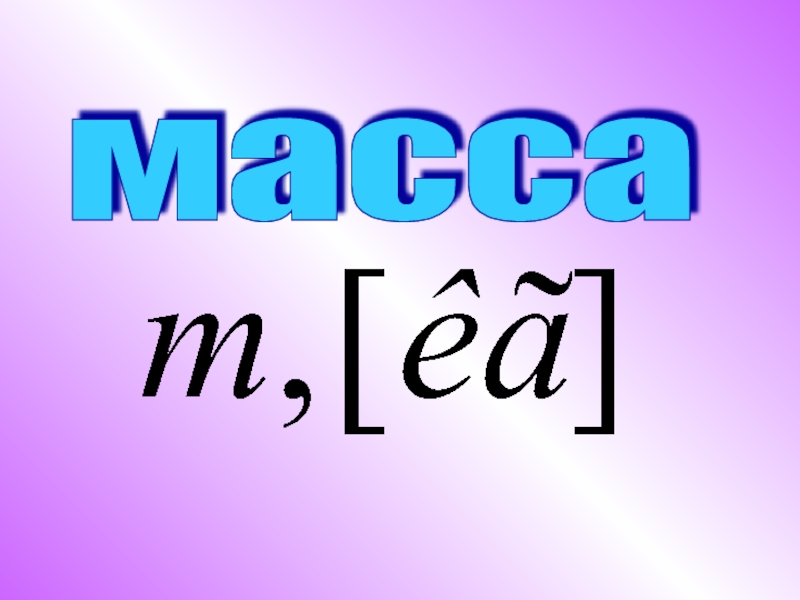Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Движение электрона в атоме
Содержание
- 1. Движение электрона в атоме
- 2. Двойственная природа электрона Электрон имеет массу
- 3. Электрон в атоме может находиться
- 4. В настоящее время считается, что
- 5. Второе квантовое число называется орбитальным. Оно обозначается
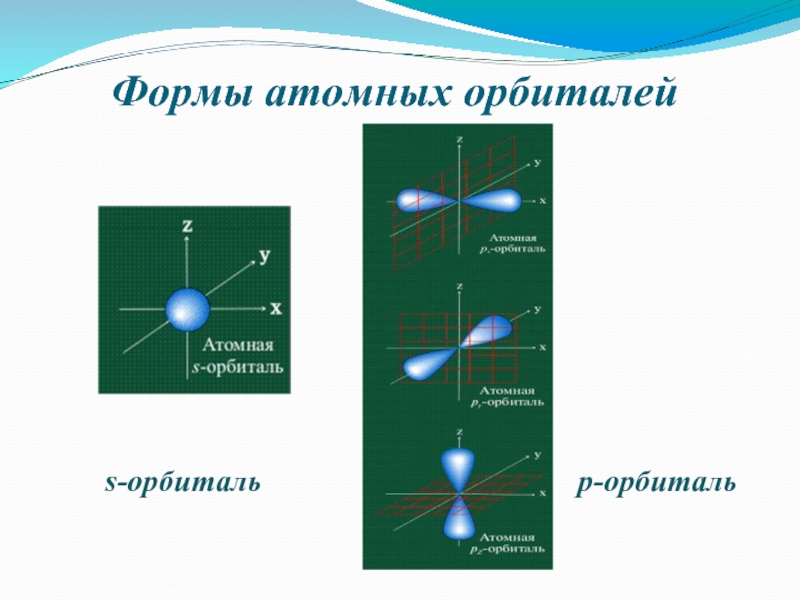
- 6. Формы атомных орбиталейs-орбитальp-орбиталь
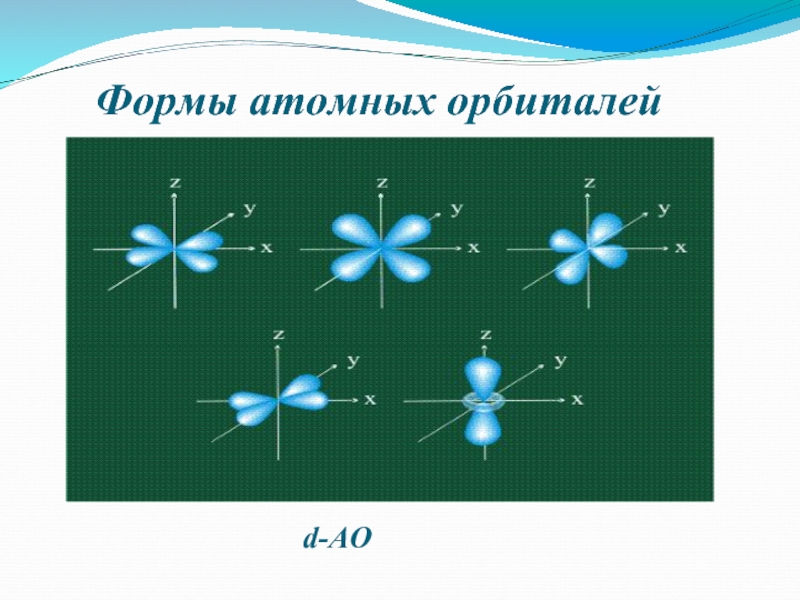
- 7. Формы атомных орбиталейd-АО
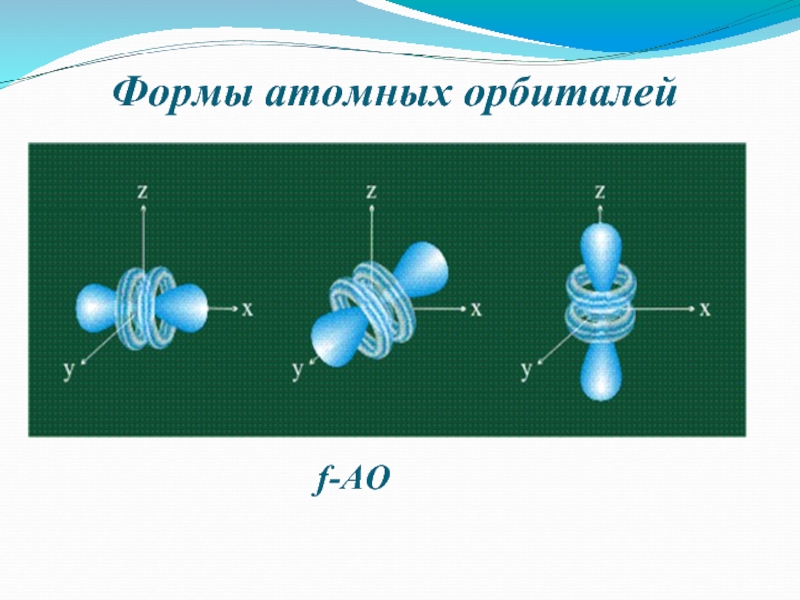
- 8. Формы атомных орбиталейf-АО
- 9. Число подуровней, на которые расщепляется энергетический уровень
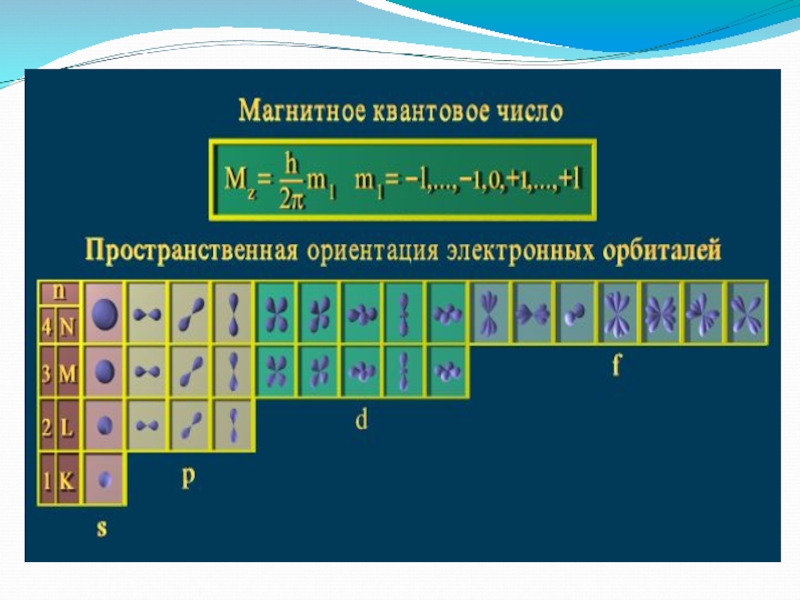
- 10. Магнитное квантовое число ml определяет значения проекции
- 11. Слайд 11
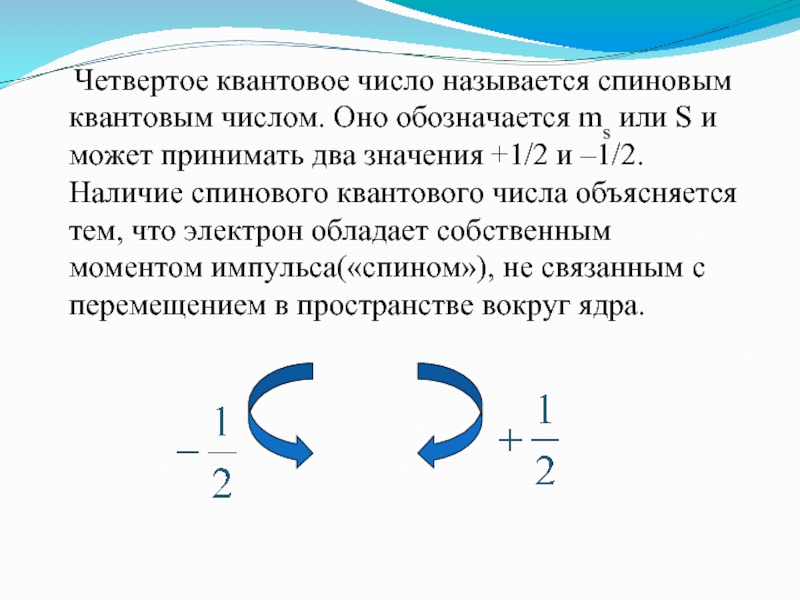
- 12. Четвертое квантовое число называется спиновым
- 13. Общая характеристика состояния электрона в многоэлектронном атоме
- 14. Энергетические уровни атома
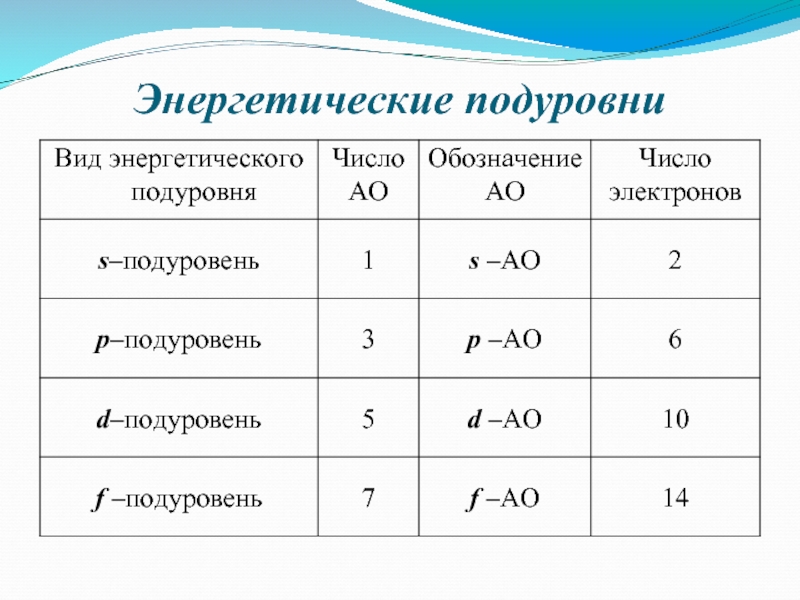
- 15. Энергетические подуровни
- 16. Ссылки на интернет-источники1. Статья «Квантовые числа электрона»:
- 17. 5. Изорбажение форм атомных орбиталей
- 18. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Двойственная природа электрона
Электрон имеет массу и заряд, как
частица.
Электрон проявляет волновые свойства – способен к дифракции.
Электрон в атоме можно рассматривать как частицу, которая при движении проявляет волновые свойства. Т.е. нельзя описать движение электрона в атоме определенной траекторией (орбитой).Слайд 3
Электрон в атоме может находиться в любой точке
пространства вокруг ядра, однако вероятность его пребывания в разных местах
атомного пространства различна.Атомная орбиталь –
область вокруг ядра атома,
в которой наиболее вероятно
нахождение электрона.
Слайд 4
В настоящее время считается, что состояние каждого электрона
в атоме определяется с помощью четырех квантовых чисел.
Первое из них называется главным квантовым числом. Оно обозначается буквой «n» и принимает значение простых целых чисел. Главное квантовое число определяет энергию электрона, степень удаленности от ядра, размеры электронной обитали. Слайд 5
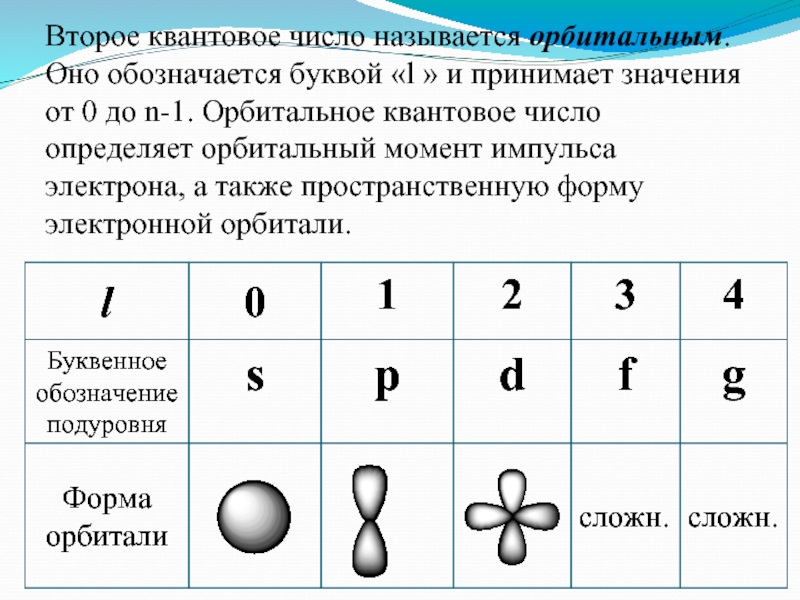
Второе квантовое число называется орбитальным. Оно обозначается буквой «l »
и принимает значения от 0 до n-1. Орбитальное квантовое число
определяет орбитальный момент импульса электрона, а также пространственную форму электронной орбитали.Слайд 9Число подуровней, на которые расщепляется энергетический уровень равно номеру уровня.
Энергетический подуровень – это совокупность электронных состояний, характеризующихся определенным набором
квантовых чисел n и l.Слайд 10Магнитное квантовое число ml определяет значения проекции орбитального момента на
одной из осей, а также пространственную ориентацию элементарных орбиталей и
их максимальное число на электронном подуровне. –Оно принимает все целочисленные значения от – l до + l.
Например, при l =0 ml = 0;
при l =1 ml = -1; 0 ; +1;
при l =2 ml = -2; -1; 0 ; +1; +2;
Любому значению l соответствует (2l+1) возможных расположений электронного облака данного типа в пространстве.
Слайд 12
Четвертое квантовое число называется спиновым квантовым числом. Оно
обозначается ms или S и может принимать два значения +1/2
и –1/2. Наличие спинового квантового числа объясняется тем, что электрон обладает собственным моментом импульса(«спином»), не связанным с перемещением в пространстве вокруг ядра.Слайд 13Общая характеристика состояния электрона в многоэлектронном атоме определяется принципом Паули:
в атоме не может быть двух электронов, у которых все
четыре квантовых числа были бы одинаковыми.На одной орбитали могут находиться не более двух электронов, отличающихся друг от друга спинами. Максимальная емкость энергетического подуровня – 2(2+l ) электронов, а уровня – 2n2.
Слайд 16Ссылки на интернет-источники
1. Статья «Квантовые числа электрона»: http://www.chemistry.ru/course/content/chapter2/section/paragraph2/theory.html
2. Статья
«Квантовые числа электрона»: http://www.himhelp.ru/section23/section2/section9/
3. Изображение атомной орбитали: http://dl.schoolnet.by:81/file.php/61/8/Topic_15002da88f8d0df72e7f0c750e52c8bb/Theme_f6bb59e3576ecf27f0386dc3fc5ac11e/theory.html
4.Изображение
модели атома Резеофорда-Бора: http://www.sistema-stage.ru/brand_news/351 5. Изорбажение форм атомных орбиталей s-орбитали: http://files.school-collection.edu.ru/dlrstore/133a5ccb-734d-9fe6-5026-ffe680109d3d/0011575G.htm
р-орбиталей:
http://files.school-http://files.school- http://files.school- collection.edu.ru/dlrstore/133a5ccb-http://files.school- collection.edu.ru/dlrstore/133a5ccb- http://files.school- collection.edu.ru/dlrstore/133a5ccb- 734d-9fe6-5026-ffe680109d3d/0011576G.htm
Слайд 17
5. Изорбажение форм атомных орбиталей
s-орбитали: http://files.school-collection.edu.ru/dlrstore/133a5ccb-734d-9fe6-5026-ffe680109d3d/0011575G.htm
р-орбиталей:
http://files.school-http://files.school- http://files.school- collection.edu.ru/dlrstore/133a5ccb-http://files.school- collection.edu.ru/dlrstore/133a5ccb- http://files.school- collection.edu.ru/dlrstore/133a5ccb- 734d-9fe6-5026-ffe680109d3d/0011576G.htm
d-орбиталей: http://files.school-collection.edu.ru/dlrstore/133a5ccb-734d-9fe6-5026-ffe680109d3d/0011596G.htm
f-орбиталей: http://files.school-collection.edu.ru/dlrstore/133a5ccb-734d-9fe6-5026-ffe680109d3d/0011597G.htm