Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Молекулярно-кинетическая теория
Содержание
- 1. Молекулярно-кинетическая теория
- 2. ТЕПЛОВЫЕ ЯВЛЕНИЯТепловые явления – это явления, связанные
- 3. МОЛЕКУЛЯРНАЯ ФИЗИКАМолекулярная физика – это раздел физики,
- 4. ТЕМА УРОКА МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ. ПЕРВОЕ ПОЛОЖЕНИЕЦель
- 5. Молекулярно-кинетической теорией называют учение
- 6. СОДЕРЖАНИЕ МКТ Все вещества состоят из отдельных
- 7. ПЕРВОЕ ПОЛОЖЕНИЕ МКТ Все вещества имеют
- 8. МОЛЕКУЛА –
- 9. РАЗМЕРЫ МОЛЕКУЛ Молекулы имеют чрезвычайно малые
- 10. Слайд 10
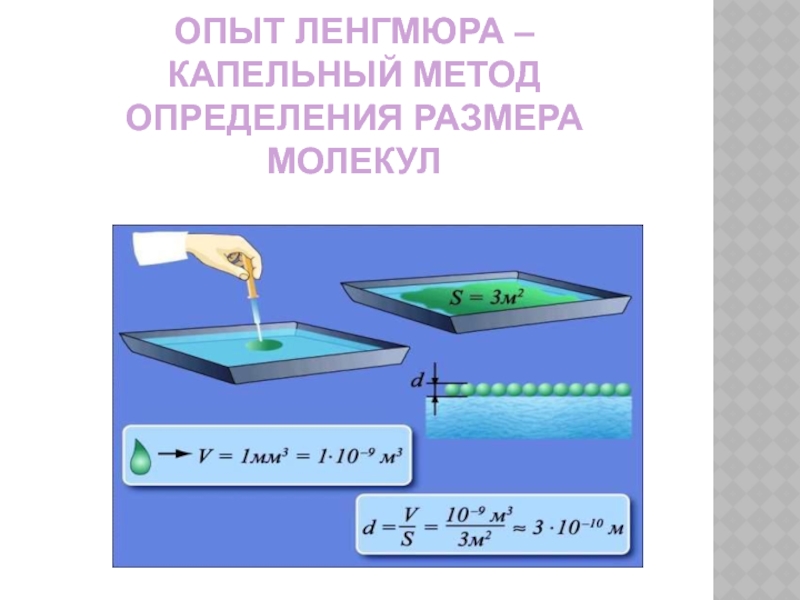
- 11. ОПЫТ ЛЕНГМЮРА – КАПЕЛЬНЫЙ МЕТОД ОПРЕДЕЛЕНИЯ РАЗМЕРА МОЛЕКУЛ
- 12. ОПЫТ ЛЕНГМЮРА
- 13. МАССА МОЛЕКУЛ За единицу массы атомов
- 14. Отношение массы атома данного вещества
- 15. В молекулярно-кинетической теории количество вещества
- 16. Массу одного моля вещества принято
- 17. Опыт показывает, что в одном
- 18. АМЕДЕО АВОГАДРО В 1 моле любого вещества
- 19. Постоянная Авогадро – одна из
- 20. ОСНОВНЫЕ ФОРМУЛЫ
- 21. Слайд 21
- 22. САМОСТОЯТЕЛЬНАЯ РАБОТАНазвать вещество иопределить его молярную массу
- 23. ОТВЕТЫ
- 24. СПАСИБО ЗА ВНИМАНИЕ!
- 25. Скачать презентанцию
ТЕПЛОВЫЕ ЯВЛЕНИЯТепловые явления – это явления, связанные с изменением температуры тела.Тепловое движение – это беспорядочное движение частиц, из которых состоит тело.Тепловые явления изучаются двумя разделами физики:Молекулярная физикаТермодинамика
Слайды и текст этой презентации
Слайд 1МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ
(ПРЕЗЕНТАЦИЯ К УРОКУ)
Кудрявцева Марина Евгеньевна,
учитель физики и природоведения,
ГБОУ
СОШ №268 Невского района
Слайд 2ТЕПЛОВЫЕ ЯВЛЕНИЯ
Тепловые явления – это явления, связанные с изменением температуры
тела.
Тепловое движение – это беспорядочное движение частиц, из которых состоит
тело.Тепловые явления изучаются двумя разделами физики:
Молекулярная физика
Термодинамика
Слайд 3МОЛЕКУЛЯРНАЯ ФИЗИКА
Молекулярная физика – это раздел физики, изучающий тепловые процессы
на основе представлений о внутреннем строении вещества
Основу молекулярной физики составляет
молекулярно-кинетическая теория – МКТСлайд 4ТЕМА УРОКА
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ. ПЕРВОЕ ПОЛОЖЕНИЕ
Цель урока -
познакомиться
с содержанием молекулярно-кинетической теории, рассмотреть первое положение МКТ
Слайд 5Молекулярно-кинетической теорией называют учение о строении и свойствах
вещества на основе представления о существовании атомов и молекул как
наименьших частиц химического веществаСлайд 6СОДЕРЖАНИЕ МКТ
Все вещества состоят из отдельных частиц, которые находятся
в состоянии непрерывного беспорядочного движения и взаимодействуют между собой
Слайд 7ПЕРВОЕ ПОЛОЖЕНИЕ МКТ
Все вещества имеют дискретное строение,
т. е. состоят из мельчайших частиц –молекул или атомов, между
которыми есть промежуткиЭкспериментальные доказательства:
дробление, растворение, диффузия, изменение объема тела при нагревании и охлаждении, фотографии в электронном микроскопе
Слайд 8
МОЛЕКУЛА – ЭТО МЕЛЬЧАЙШАЯ ЧАСТИЦА ВЕЩЕСТВА, ОБЛАДАЮЩАЯ ЕГО ХИМИЧЕСКИМИ СВОЙСТВАМИ
Молекулы химического вещества могут быть простыми и сложными и
состоять из одного или нескольких атомовСлайд 9РАЗМЕРЫ МОЛЕКУЛ
Молекулы имеют чрезвычайно малые размеры. Простые одноатомные
молекулы имеют размер порядка 10–10 м. Сложные многоатомные молекулы могут иметь
размеры в сотни и тысячи раз большеСлайд 13МАССА МОЛЕКУЛ
За единицу массы атомов и молекул принимается
1/12 массы атома углерода 12C
Она называется атомной единицей массы
(а. е. м.): 1 а. е. м. = 1,66·10–27 кг.
Слайд 14 Отношение массы атома данного вещества к 1/12 массы
атома
углерода 12C называется
относительной атомной массой
Слайд 15 В молекулярно-кинетической теории количество вещества принято считать пропорциональным
числу частиц
Единица количества вещества называется молем (моль)
Моль – это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов в 0,012 кг (12 г) углерода 12C Слайд 16 Массу одного моля вещества принято называть молярной массой
M
Молярная масса – это масса вещества, взятого в
количестве 1 мольМолярная масса в системе СИ выражается в килограммах на моль (кг/моль)
Слайд 17 Опыт показывает, что в одном моле любого вещества
содержится одно и то же число частиц. Это число называется
числом(постоянной) Авогадро - Nа
Число Авогадро – количество
частиц, содержащихся в одном
моле любого вещества
-23
Nа = 6,02·10 частиц/моль =
-23 -1
= 6,02·10 моль
Слайд 18АМЕДЕО АВОГАДРО
В 1 моле любого вещества содержится всегда
одно и то же число молекул
(число Авогадро)
Слайд 19 Постоянная Авогадро – одна из важнейших постоянных в
молекулярно-кинетической теории.
Количество вещества ν определяется как
отношение числа N частиц вещества к постоянной Авогадро Nа:
ν = N / Nа
Молярная масса равна произведению массы m0 одной молекулы данного вещества на постоянную Авогадро:
M = Na · m0