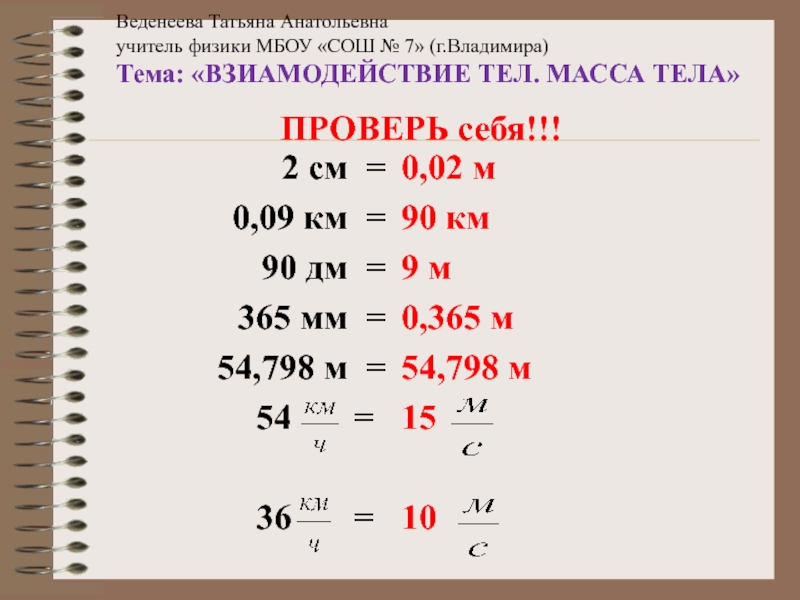
Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Молярный объем газов. Закон Авогадро
Содержание
- 1. Молярный объем газов. Закон Авогадро
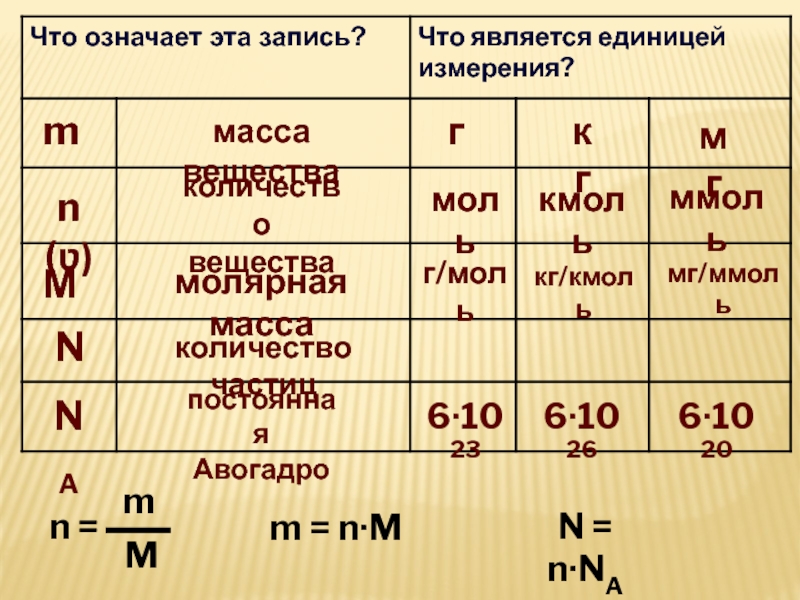
- 2. mмасса веществагкгмгn (ʋ)количество веществамолькмольммольМмолярная массаг/молькг/кмольмг/ммольNколичество частицNAпостоянная Авогадро6∙10236∙10266∙1020n = mMm = n∙M N = n∙NA
- 3. O390 г5 мольC6H12O6FeCl2n = mMm = n∙M
- 4. Молярный объем газов. Закон Авогадро
- 5. Амеде́о Авога́дро(1776 – 1856 г.г.)Итальянский ученый, физик и химик
- 6. Слайд 6
- 7. Слайд 7
- 8. Нормальные условия (н.у.):t° = 0°CP = 101,3
- 9. Вспомним : =m|M г/моль,
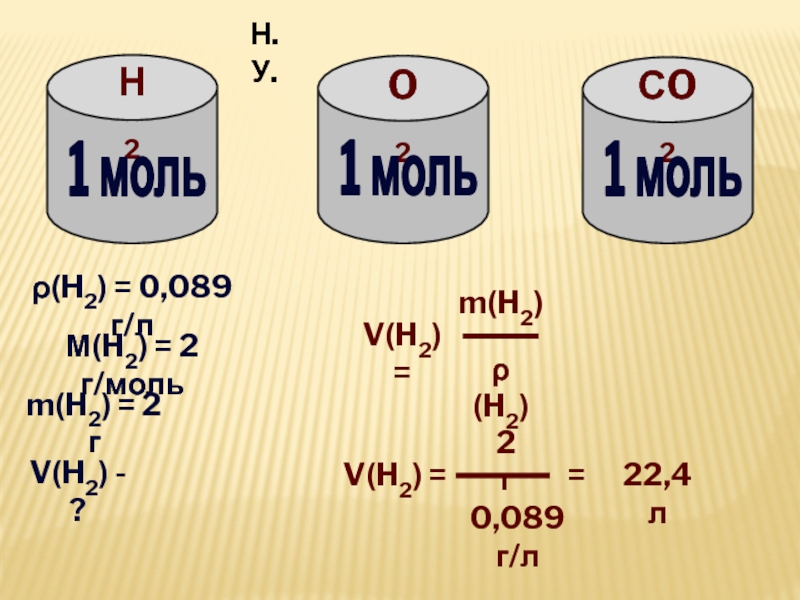
- 10. Н2O2СO21 моль1 моль1 мольρ(H2) = 0,089 г/лМ(H2)
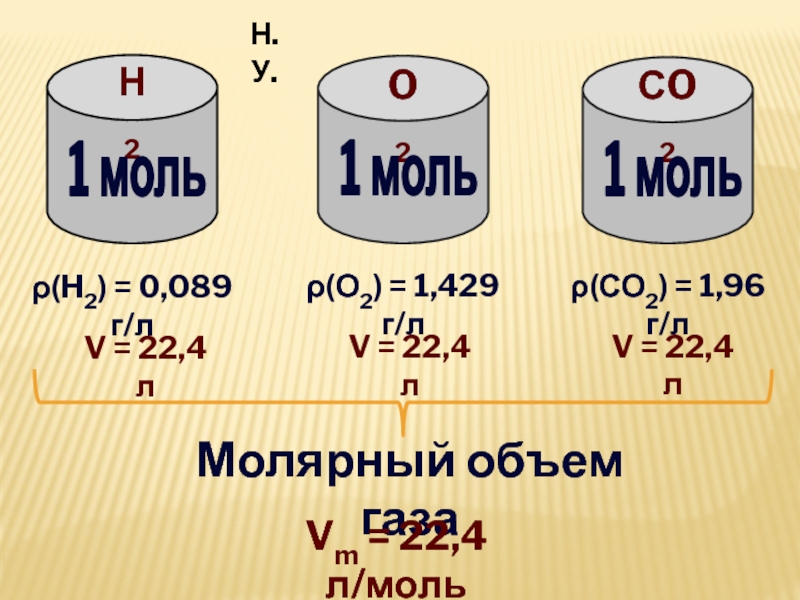
- 11. Н2O2СO21 моль1 моль1 мольρ(H2) = 0,089 г/лМолярный
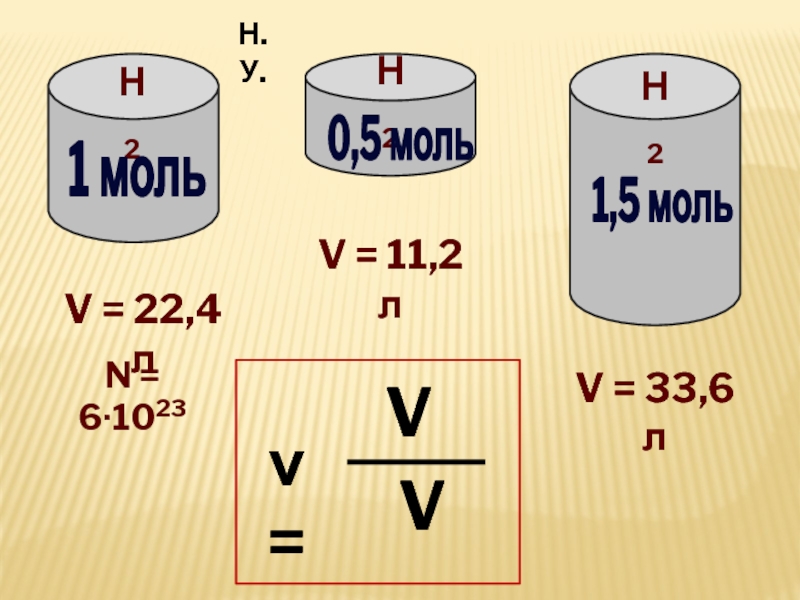
- 12. Н21 мольV = 22,4 л N =
- 13. Vm = V| молярный объем
- 14. Н22 мольV = 44,8 л N = 12∙1023CO22 мольV = 44,8 л N = 12∙1023Н.У.
- 15. В равных объемах разных газов при одинаковых условиях содержится одинаковое число молекулЗакон Авогадро (1811 г.)
- 16. СO85 г0,25 мольNH3Cl267,2 л
- 17. Скачать презентанцию
mмасса веществагкгмгn (ʋ)количество веществамолькмольммольМмолярная массаг/молькг/кмольмг/ммольNколичество частицNAпостоянная Авогадро6∙10236∙10266∙1020n = mMm = n∙M N = n∙NA
Слайды и текст этой презентации
Слайд 1
Молярный объем газов.
Закон Авогадро
Разработала: Милова Елена Анатольевна, учитель химии МБОУСОШ
№12 муниципального образования Усть-Лабинский район, Краснодарского края
Слайд 2m
масса вещества
г
кг
мг
n (ʋ)
количество
вещества
моль
кмоль
ммоль
М
молярная масса
г/моль
кг/кмоль
мг/ммоль
N
количество частиц
NA
постоянная
Авогадро
6∙1023
6∙1026
6∙1020
n =
m
M
m =
n∙M
N = n∙NA
Слайд 3O3
90 г
5 моль
C6H12O6
FeCl2
n =
m
M
m = n∙M
N = n∙NA
12∙1026
48
г/моль
240 г
3∙1024
180 г/моль
0,5 моль
3∙1023
2кмоль
127 000
г/моль
254 кг
Слайд 8Нормальные условия (н.у.):
t° = 0°C
P = 101,3 кПа
V =
ρ
m
ρ(H2)
= 0,089 г/л
ρ(О2) = 1,429 г/л
ρ(СО2) = 1,96 г/л
Слайд 9 Вспомним : =m|M г/моль, где -количество вещества, m-масса вещества,
M-молярная масса вещества
Слайд 10Н2
O2
СO2
1 моль
1 моль
1 моль
ρ(H2) = 0,089 г/л
М(H2) = 2 г/моль
m(H2)
= 2 г
V(H2) - ?
V(H2) =
m(H2)
ρ(H2)
=
V(H2) =
2г
0,089г/л
22,4 л
Н.У.
Слайд 11Н2
O2
СO2
1 моль
1 моль
1 моль
ρ(H2) = 0,089 г/л
Молярный объем газа
ρ(О2) =
1,429 г/л
ρ(СО2) = 1,96 г/л
V = 22,4 л
V =
22,4 л Vm = 22,4 л/моль
V = 22,4 л
Н.У.