Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация по физике "Идеальный газ. Параметры состояния газа" 10 класс
Содержание
- 1. Презентация по физике "Идеальный газ. Параметры состояния газа" 10 класс
- 2. Параметры состояния – определенные величины, описывающие состояние
- 3. Макроскопические – параметры, которые можно измерить с помощью приборов.Микроскопические – параметры, которые измеряются косвенным путем.
- 4. Модели идеального газа соответствует реальный газ находящийся
- 5. Идеальный газ(модель)1. Совокупность большого числа молекул, размерами
- 6. Свойства идеального газа1. Суммарный объем молекул по
- 7. Макропараметры идеального газа Давление ТемператураОбъем
- 8. Давление газа – суммарная сила ударов молекул
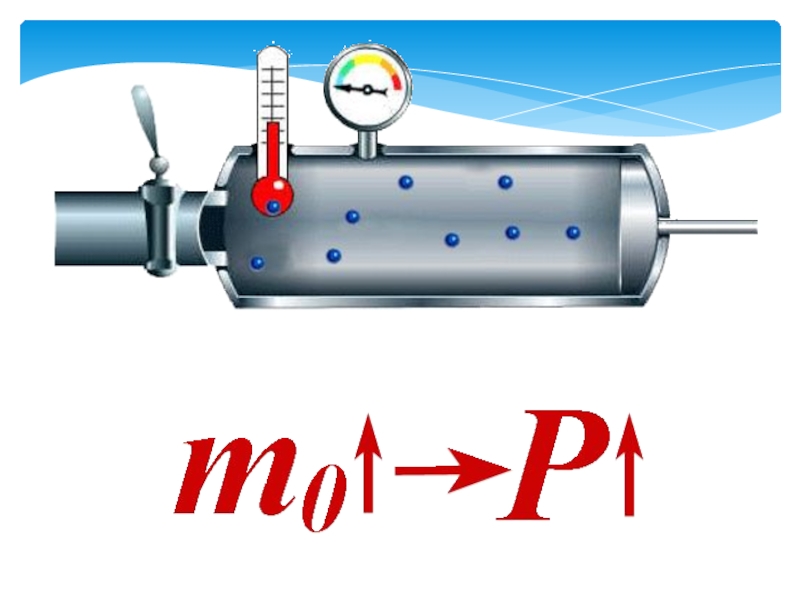
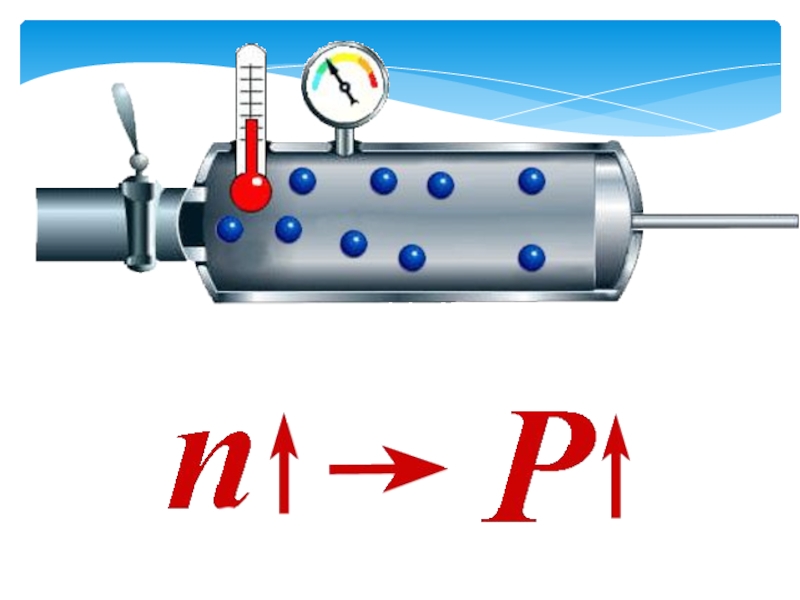
- 9. Слайд 9
- 10. Слайд 10
- 11. Слайд 11
- 12. N – число молекул газа
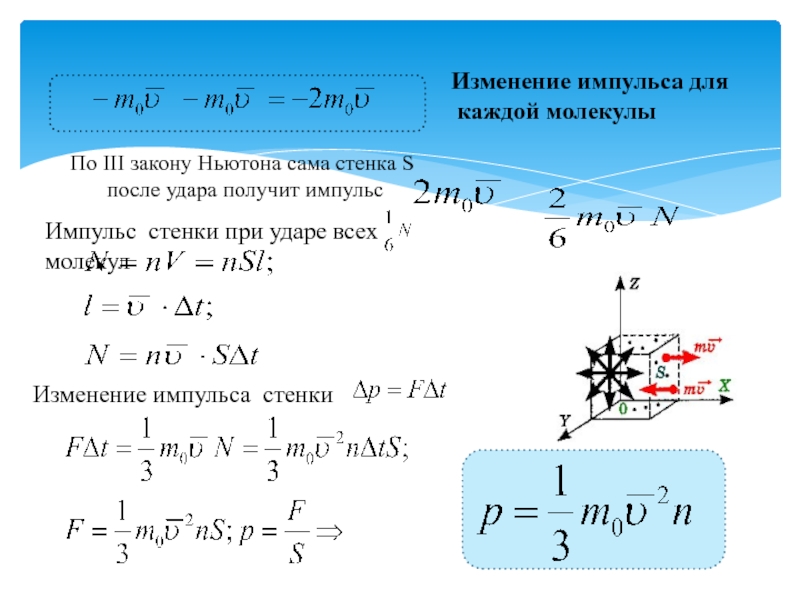
- 13. По III закону Ньютона сама стенка S
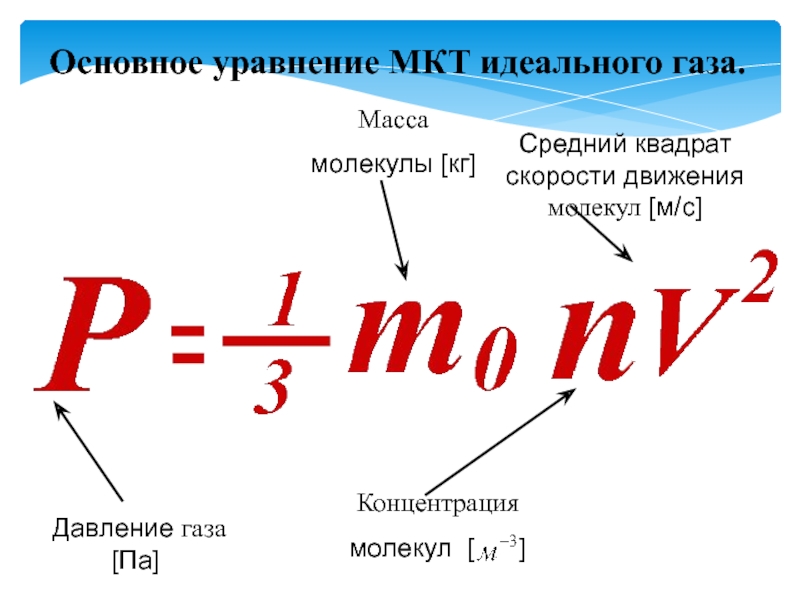
- 14. Основное уравнение МКТ идеального газа.
- 15. Основное уравнение кинетической теории идеального газа или уравнение Клаузиуса
- 16. Давление смеси газов равно сумме их парциальных
- 17. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Идеальный газ.
Параметры состояния газа
Древние считали газ неуловимой формой тела, представляющего
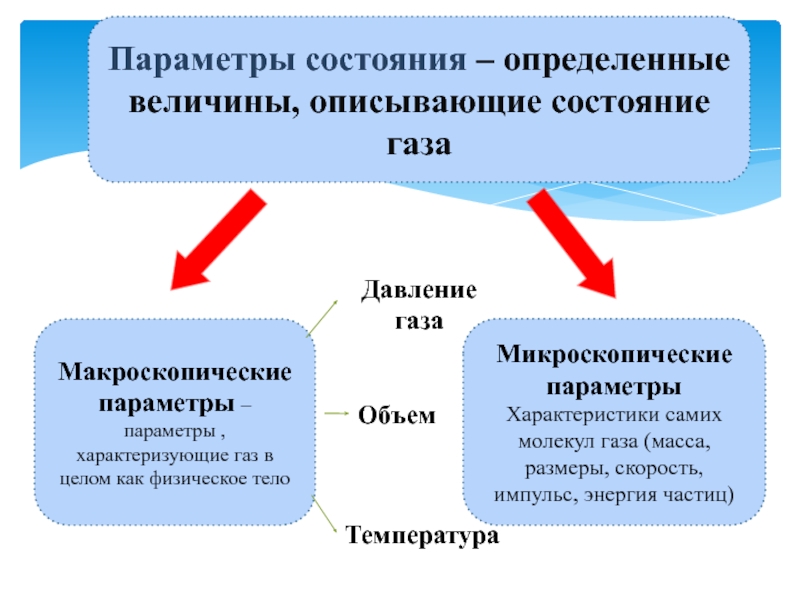
Слайд 2Параметры состояния – определенные величины, описывающие состояние газа
Макроскопические параметры
– параметры , характеризующие газ в целом как физическое тело
Микроскопические
параметрыХарактеристики самих молекул газа (масса, размеры, скорость, импульс, энергия частиц)
Давление газа
Объем
Температура
Слайд 3Макроскопические – параметры, которые можно измерить с помощью приборов.
Микроскопические –
параметры, которые измеряются косвенным путем.
Слайд 4Модели идеального газа соответствует реальный газ находящийся под низким давлением
и при высокой температуре
Идеальный газ – газ, молекулы которого представляют
собой материальные точки, а их взаимодействие носит характер абсолютно упругого удараИдеальный газ – физическая модель реального газа
Воздух при нормальных условиях можно приближенно считать идеальным газом
Слайд 5Идеальный газ
(модель)
1. Совокупность большого числа молекул, размерами которых можно пренебречь
(принимают молекулы за материальные точки).
2. Молекулы находятся на больших расстояниях
друг от друга и движутся хаотически ( все направления движения молекул равноправны ) .3. Молекулы взаимодействуют по законам упругих столкновений , силами притяжения между молекулами пренебрегают.
4. Скорости молекул разнообразны, но при определенной температуре средняя скорость молекул остается постоянной.
5. Все соударения молекул являются абсолютно упругими
Реальный газ
1. Молекулы реального газа не являются точечными образованиями, диаметры молекул лишь в десятки раз меньше расстояний между молекулами.
2. Молекулы не взаимодействуют по законам упругих столкновений.
Слайд 6Свойства идеального газа
1. Суммарный объем молекул по сравнению с объемом,
занимаемым газом, пренебрежимо мал.
2. Молекулы представляют собой упругие шарики
3. Внутренняя
энергия газа определяется лишь кинетической энергией.Слайд 8Давление газа – суммарная сила ударов молекул газа о единицу
площади поверхности сосуда, в котором газ находится
В 1845 г в
Английскую академию наук была представлена работа Ватерстона. В ней было показано, что давление газа на стенки сосуда обусловлено ударами молекул. Работа была отклонена и осталась неопубликованной еще полстолетия
Давление идеального газа
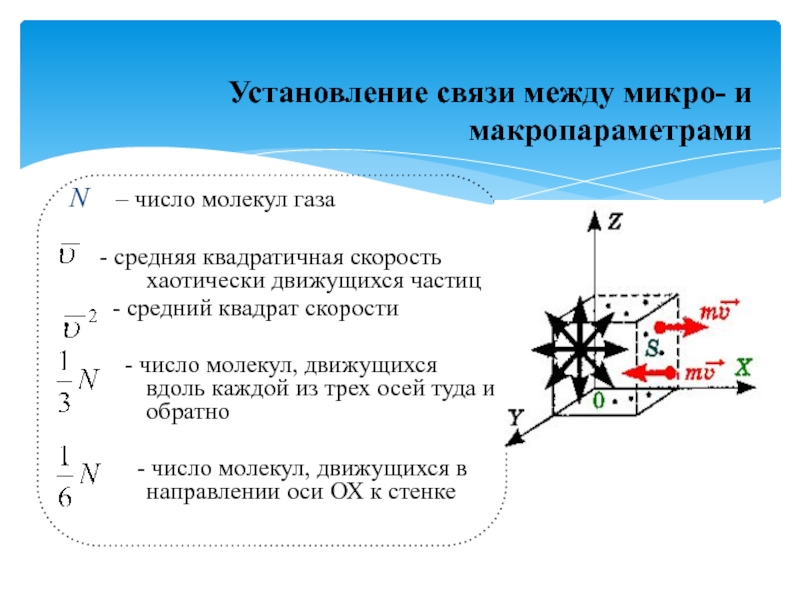
Слайд 12N – число молекул газа
- средняя квадратичная скорость хаотически движущихся частиц
- средний квадрат скорости- число молекул, движущихся вдоль каждой из трех осей туда и обратно
- число молекул, движущихся в направлении оси ОХ к стенке
Установление связи между микро- и макропараметрами
Слайд 13По III закону Ньютона сама стенка S после удара получит
импульс
Изменение импульса для
каждой молекулы
Импульс стенки при ударе всех
молекулИзменение импульса стенки
Слайд 16Давление смеси газов равно сумме их парциальных давлений
Закон Дальтона
Парциальное давление
газа – давление,
которое бы оказывал газ на стенки сосуда,
находясь в нем один
Если в сосуде содержится несколько газов, то каждый газ занимает объем, равный объему сосуда, и все газы имеют одинаковую температуру