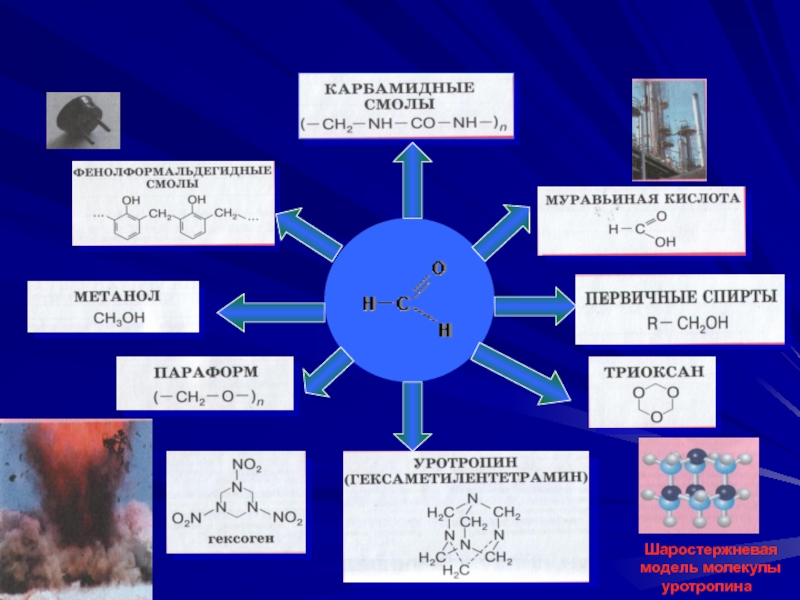
в холодной и горячей воде?
Как по строению отличаются фенолы от
предельных спиртов?Что общего в химических свойствах предельных спиртов и фенолов?
Чем отличаются химические свойства фенола от свойств предельных спиртов?
Какие типы химических реакций характерны для фенола?
Составьте уравнения реакций:
а) замещения атома водорода в гидроксильной группе
б) замещения атомов водорода в бензольном кольце
в) присоединения
Назовите полученные соединения.
Какие качественные реакции на фенол вам известны?
Назовите основные области применения фенола.



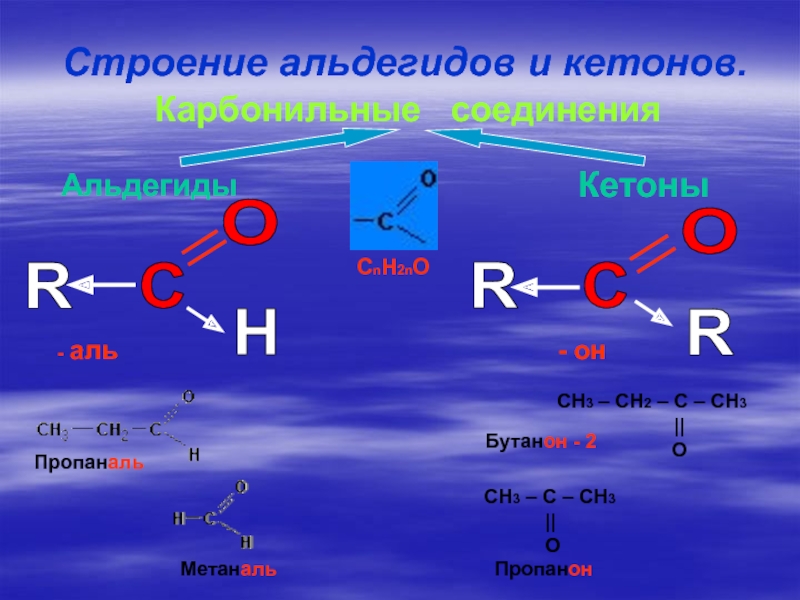





![Альдегиды 10 класс – C OH2. Реакции окисления. R – C OOH[О]RCH3 – C OH2. Реакции окисления. R – C OOH[О]RCH3 – COH+Ag2O OHCH3 –](/img/thumbs/fd3c66482af81c545db9036662e842bc-800x.jpg)




![Альдегиды 10 класс РЕАГЕНТЫХимические свойства альдегидов.(обобщение)РеакцииприсоединенияРеакцииокисленияРеакцииконденсациигидрированиеПрисоединениециановодородаПрисоединениеNaHSO3Реакция«серебряного зеркала»Окисление с помощью Сu(OH)2самоконденсацияполиконденсацияH2HCNNaHSO3[Ag(NH3)2]OHСu(OH)2С6H5OH РЕАГЕНТЫХимические свойства альдегидов.(обобщение)РеакцииприсоединенияРеакцииокисленияРеакцииконденсациигидрированиеПрисоединениециановодородаПрисоединениеNaHSO3Реакция«серебряного зеркала»Окисление с помощью Сu(OH)2самоконденсацияполиконденсацияH2HCNNaHSO3[Ag(NH3)2]OHСu(OH)2С6H5OH](/img/thumbs/735cd6a888a23978caf9bafff7e8c6c8-800x.jpg)