Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Азот
Содержание
- 1. Азот
- 2. СТРОЕНИЕ АТОМА АЗОТА
- 3. Слайд 3
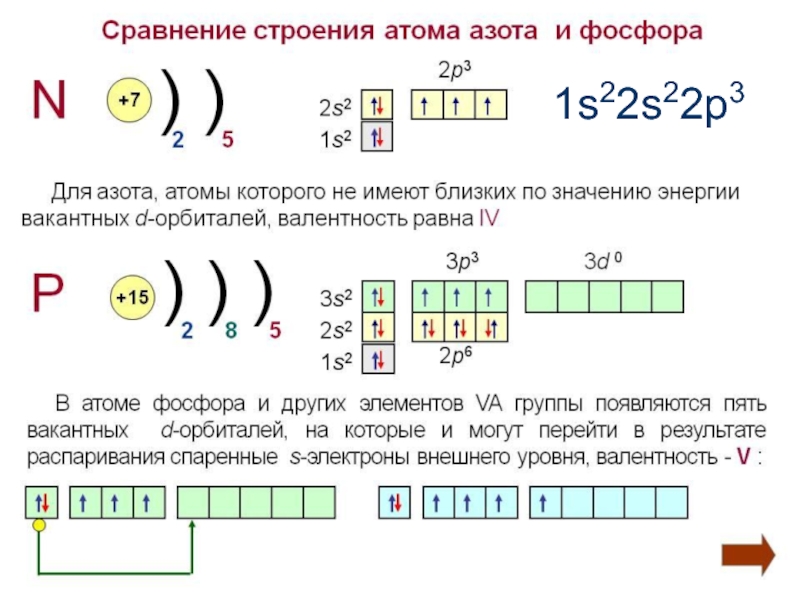
- 4. Строение атома азота1s22s22p3
- 5. Валентность и степень окисления в соединенияхВозможные степени
- 6. В 1772г. азот (под названием «испорченный воздух»
- 7. Строение молекулы азотаМолекулярная формула N2Структурная формула
- 8. Азот в природе В атмосфере – 78%
- 9. NH4NO2 → N2 + 2H2ОПолучениеВ лаборатории – разложением неустойчивых соединений азота:
- 10. Выделение из жидкого воздуха В промышленности
- 11. Химические свойства азотаВзаимодействие с металламиПри обычных условиях
- 12. Химические свойства азотаВзаимодействие с неметаллами
- 13. Области применения азотаСвободный азот применяют во многих
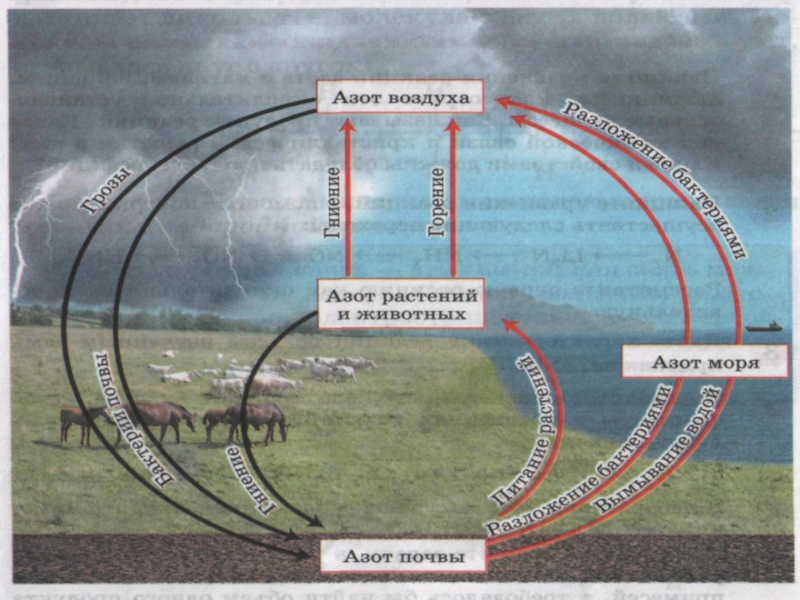
- 14. Круговорот азота в природе
- 15. Химические процессы в природеN2 + O2 ↔
- 16. Азот – жизненно важный элементОсновная часть молекулярного
- 17. Домашнее задание§24№2 (с.146)
- 18. Скачать презентанцию
СТРОЕНИЕ АТОМА АЗОТА
Слайды и текст этой презентации
Слайд 5Валентность и степень окисления в соединениях
Возможные степени окисления:
-3, +1,
+2, +3, +4, +5
степень окисления - +5Слайд 6В 1772г. азот (под названием «испорченный воздух» описал Д. Резерфорд)
В
1777г. азот был получен Г.Кавендишем
Название «азот» предложено в 1787г.
А. Лавуазье
(от греч. а-отрицание и zoos-жизнь)
История открытия азота – простого вещества N2
Слайд 7Строение молекулы азота
Молекулярная формула N2
Структурная формула N N
Связь
ковалентная неполярнаяСлайд 8Азот в природе В атмосфере – 78% по объему. В литосфере –
в составе нитратов почвы.
В биосфере – в составе молекул белков.
Физические свойстваАзот – газ без цвета, запаха и вкуса, немного легче воздуха.
Не поддерживает горение и дыхание.
Малорастворим в воде и органических растворителях.
t кип= -196°C; t пл. -210° C
Слайд 11Химические свойства азота
Взаимодействие с металлами
При обычных условиях азот реагирует только
с литием! 6Li +
N2 → 2Li3NC другими металлами реагирует только при нагревании.
Слайд 12Химические свойства азота
Взаимодействие с неметаллами
1) N2 + 3H2 ↔ 2NH3 + Q
2) N2 + O2 ↔ 2NO – Q
реакция идет при температуре электрической дуги
Fe, t°
Слайд 13Области применения азота
Свободный азот применяют во многих отраслях промышленности: как
инертную среду в химических и металлургических процессах;
для заполнения свободного
пространства в ртутных термометрах;жидкий азот применяют в холодильных установках;
большое количество азота идет на синтез аммиака, из которого получают азотную кислоту, минеральные удобрения (мочевину, сульфаты и фосфаты аммония).
Слайд 15Химические процессы в природе
N2 + O2 ↔ 2NO - Q
2NO
+ O2 ↔ 2NO2
4NO2 + O2 + 2H2O = 4HNO3
2NO2
+H2O = HNO2 + HNO3Слайд 16Азот – жизненно важный элемент
Основная часть молекулярного азота фиксируется биотическим
путем (клубеньковые бактерии бобовых растений, сине-зеленые водоросли и др.)
Азот в
виде аммиака и соединений аммония окисляется до нитратов и нитритов (хорошо растворимых в воде). Затем попадают в Мировой океан, разлагаются и азот выделяется в атмосферу.Все основные части клеток тканей организма построены из белковых молекул, в состав которых входит азот.