Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
План – конспект урока химии в 9-ом классе
Содержание
- 1. План – конспект урока химии в 9-ом классе
- 2. Тема:Общие химические свойства металлов
- 3. Цель:Систематизировать сведения о химических свойствах металловОсознать химическую функцию металлов как восстановителей
- 4. Задачи:Знать отношение металлов к неметаллам.Взаимодействие с водой, кислотами, солями.Научиться применять знания.Формирование познавательного интереса.
- 5. О б о р у д о в а н и е:Компьютер, проектор,экран
- 6. Что характерно для атомов металлов?
- 7. Для атомов металлов характерно:Небольшое число электронов
- 8. Поэтому в химических реакциях атомы металлов отдают электроны и являются восстановителями.
- 9. На пример:Na0 - 1ē → Na+1 Al0 - 3ē → Al+3
- 10. Слайд 10
- 11. Взаимодействие металлов с водойt0
- 12. З а п о м н и!!!С водой взаимодействует только амальгамированный алюминий (лишенный оксидной пленки)
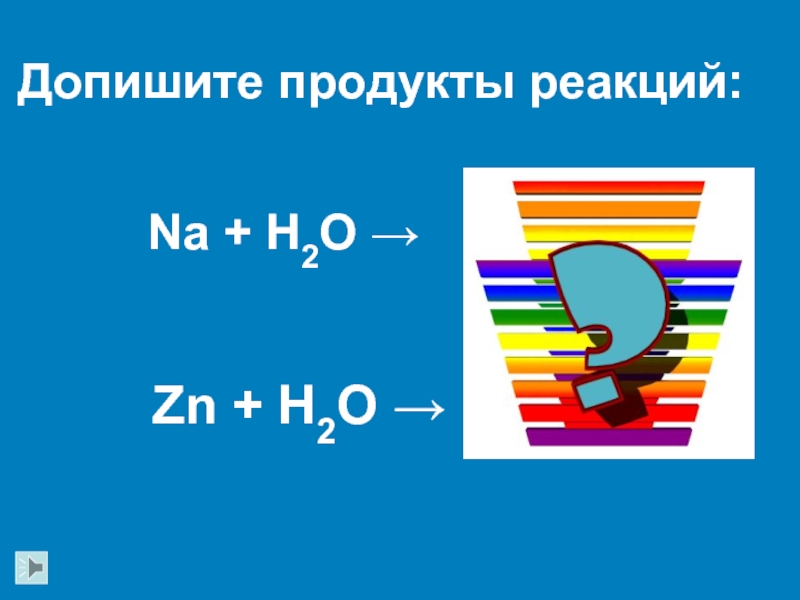
- 13. Na + H2O → Zn + H2O → Допишите продукты реакций:
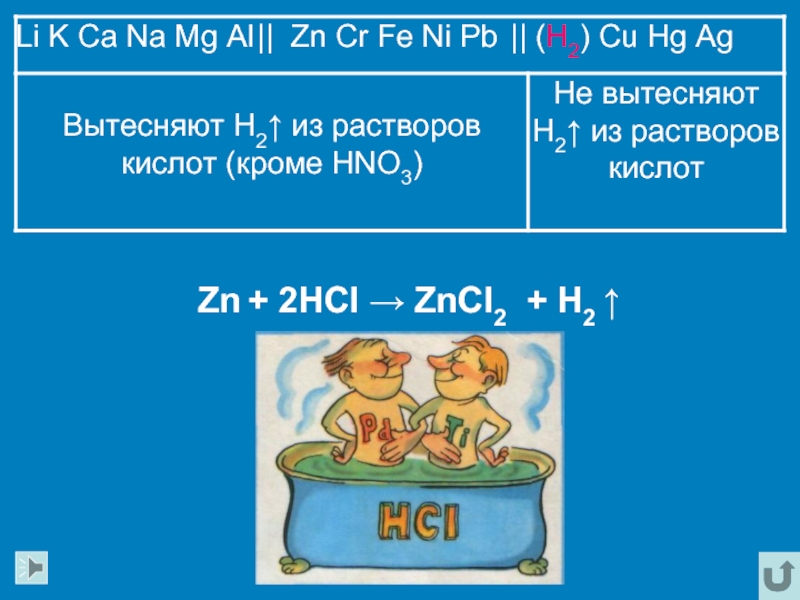
- 14. Zn + 2HCl → ZnCl2 + H2 ↑
- 15. Металлы могут восстанавливать и катионы менее активных металловZn0 +Cu+2Cl2 → Cu0 + Zn+2 Cl2
- 16. Все металлы на основании их восстановительной способности
- 17. Окислителями металлов являются неметаллы:Кислород, сера, галогены…
- 18. С кислородом воздуха легко взаимодействуют щелочные и щелочно-земельные металлы.4 Li0 + O20 → 2 LI+120-2
- 19. Железо, цинк, медь окисляются только при нагревании3Fe + 2O2 → Fe3O4to
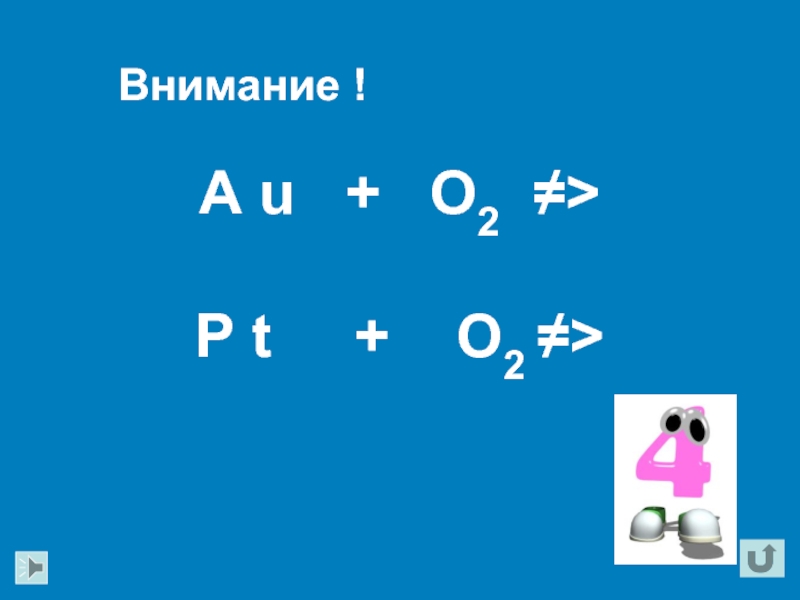
- 20. A u + O2
- 21. Металлы с неметаллами образуют бинарные соединенияХлориды – AlCl3Сульфиды – PbSФосфиды – Na3 Р
- 22. А теперь ты должен закрепить приобретенные знания, выполнив УпражнениеУДАЧИ ТЕБЕ!!!
- 23. Если ты испытываешь трудности при выполнении этих заданий то обратись к предыдущим слайдам!
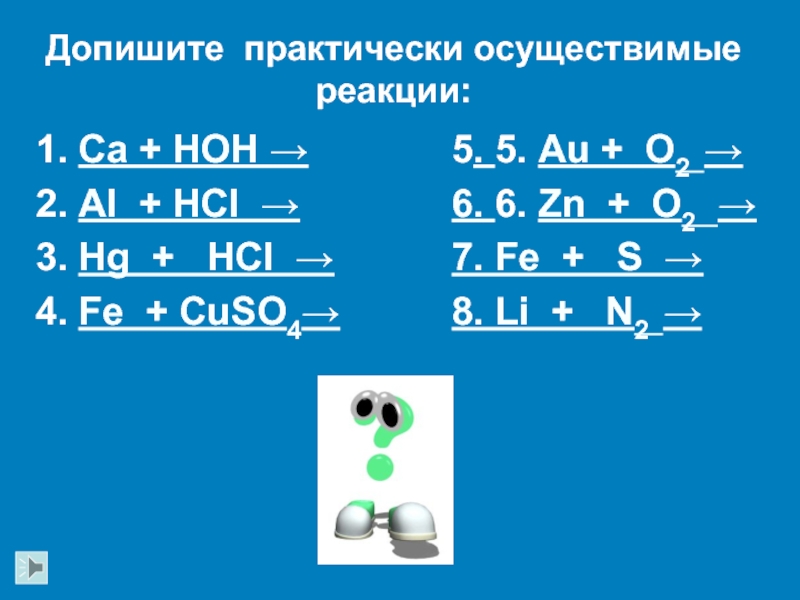
- 24. Ca + HOH → Al + HCl
- 25. 2ē Ca + 2HOH
- 26. Дома обязательно поработай с учебником!§ 8Выполнить письменно упражнения:- с. 37№4, №2, №5, №6
- 27. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3Цель:
Систематизировать сведения о
химических свойствах металлов
Осознать химическую функцию металлов как
восстановителей
Слайд 4
Задачи:
Знать отношение металлов к неметаллам.
Взаимодействие с водой, кислотами, солями.
Научиться применять
знания.
Формирование познавательного интереса.
Слайд 7
Для атомов металлов характерно:
Небольшое число
электронов на внешнем
слое.
С увеличением радиуса атома сила удерживания электронов на внешнем слое
уменьшается
Слайд 10
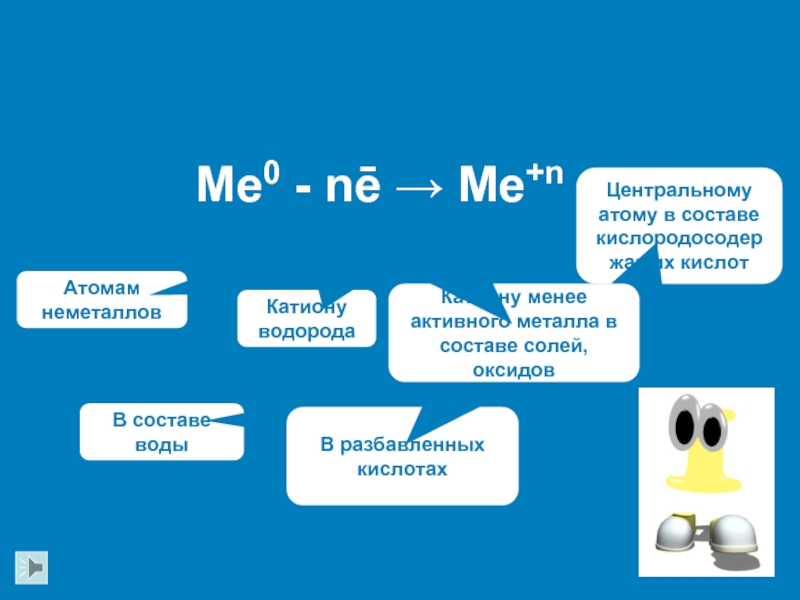
Me0 - nē → Me+n
Атомам неметаллов
Катиону водорода
В составе воды
В разбавленных
кислотахКатиону менее активного металла в составе солей, оксидов
Центральному атому в составе кислородосодержащих кислот
Слайд 12З а п о м н и!!!
С водой взаимодействует
только
амальгамированный
алюминий
(лишенный оксидной
пленки)
Слайд 15
Металлы могут восстанавливать и катионы менее активных металлов
Zn0 +Cu+2Cl2 →
Cu0 + Zn+2 Cl2
Слайд 16Все металлы на основании их восстановительной
способности по отношению к
ионам металлов
в водных растворах расположены в
Электрохимический ряд напряжений металлов
Li
K Ca Na Mg Al Zn Cr Fe Ni Pb H2 Cu Hg AgУвеличение восстановительных свойств
Слайд 18С кислородом воздуха легко
взаимодействуют щелочные и
щелочно-земельные металлы.
4 Li0
+ O20 → 2 LI+120-2
Слайд 21Металлы с неметаллами образуют бинарные соединения
Хлориды – AlCl3
Сульфиды – PbS
Фосфиды
– Na3 Р
Слайд 24
Ca + HOH →
Al + HCl →
Hg +
HCl →
Fe + CuSO4→
5. 5. Au + O2 →
6. 6.
Zn + O2 →7. Fe + S →
8. Li + N2 →
Допишите практически осуществимые реакции:
Слайд 25
2ē
Ca + 2HOH →Ca(OH)2 + H2
2Al + 6HCl →2AlCl3 + H2
2ē
Fe + CuSO4 → FeSO4 +Cu
Ag + CuCl2 → не происходит
Au + O2 → не происходит
4ē
2Zn + O2 → 2ZnO
2ē
Fe + S → FeS
6ē
6Li + N2 → 2Li3N
Проверь себя!!!