Слайд 1ЭЛЕКТРОЛИЗ
Выполнила учитель химии Апастовской средней общеобразовательной школы Хайдарова Милявша Хуснулловна
Слайд 2ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ, ПРОТЕКАЮЩИЕ НА ЭЛЕКТРОДАХ ПРИ ПРОПУСКАНИИ ПОСТОЯННОГО ЭЛЕКТРИЧЕСКОГО ТОКА
ЧЕРЕЗ РАСТВОРЫ ИЛИ РАСПЛАВЫ ЭЛЕКТРОЛИТОВ, НАЗЫВАЮТ ЭЛЕКТРОЛИЗОМ.
При электролизе окислителем
и восстановителем является электрический ток.
Процессы окисления и восстановления разделены в пространстве, они совершаются не при контакте частиц друг с другом, а при соприкосновении с электродами электрической цепи.
Катод - отрицательно- заряженный электрод.
Анод – положительно-заряженный электрод.
Катион- «+»ион, анион- «-» ион.
Слайд 3ЭЛЕКТРОЛИЗ ВОДНЫХ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
Катодные процессы в водных растворах электролитов :катионы
или молекулы воды принимают электронов и восстанавливаются.
Li,K,Ca, |
Mn,Zn,Fe,Ni,| H2|Cu,Hg,Ag,Pt
Na,Mg,Al Sn,Pb Au
Катионы металлов не | Катионы металлов и молекулы воды| Катионы
восстанавливаются. восстанавливаются металлов
Восстанавливается вода восстанавливаются
Слайд 4
Cu2+ + 2e– = Cu0, E0=0,337 В
2H2O +
2e– = H2 + 2OH–, E0=–0,83 В
1. Катионы металлов со
стандартным электродным потенциалом, большим, чем у ВОДОРОДА, расположены в ряду напряжений после него: Cu2+, Hg2+, Ag+, Pt2+, ..., до Pt4+. При электролизе они почти полностью восстанавливаются на катоде и выделяются в виде металла.
Слайд 52. Катионы металлов с малой величиной стандартного электродного потенциала (катионы
металлов начала ряда напряжений Li+, Na+, K+, Rb+, ..., до
Al3+ включительно). При электролизе на катоде они не восстанавливаются, вместо них восстанавливаются молекулы воды.
2H2O + 2e– = H2 + 2OH–, E0=–0,83 В
Слайд 63. Катионы металлов со стандартным электродным потенциалом меньшим, чем у
ВОДОРОДА, но большим, чем у алюминия (Mn2+, Zn2+, Cr3+, Fe2+,
..., до H). При электролизе эти катионы, характеризующиеся средними величинами электроноакцепторной способности, на катоде восстанавливаются одновременно с молекулами воды.
Zn 2+ + 2e = Zn0
2H2O + 2e– = H2 + 2OH–
Слайд 74. На катоде легче всего разряжаются катионы того металла, которому
отвечает наиболее положительный потенциал. Так, например, из смеси катионов Cu2+,
Ag+ и Zn2+ при достаточном напряжении на клеммах электролизера вначале восстанавливаются ионы серебра (E0=+0,79 В), затем меди (E0=+0,337 В) и, наконец, цинка (E0=–0,76 В).
Ag + + 2e– = Ag 0, E0=+0,79 В
Cu2+ + 2e– = Cu0, E0=+0,337 В
Zn 2+ + 2e = Zn0
E0=-0,76 В
Слайд 8АНОДНЫЕ ПРОЦЕССЫ
На аноде происходит окисление анионов или молекул воды (
частицы отдают электронов - окисляются)
Анионы по их способности окисляться располагаются
в следующем порядке:
Iˉ,Brˉ,S²ˉ,Clˉ,OHˉ, SO4²ˉ,NO3ˉ,Fˉ
----------------------------------------------------------→
Восстановительная активность уменьшается.
Слайд 9НА АНОДЕ ОКИСЛЯЮТСЯ АНИОНЫ БЕСКИСЛОРОДНЫХ КИСЛОТ, OH– ИЛИ МОЛЕКУЛЫ ВОДЫ
2Cl–
– 2e– = Cl2 2H2O
– 4e– = O2 + 4H+
4OH– – 4e– = 2H2O + O2
Анионы кислородосодержащих кислот не окисляются, так как их стандартный потенциал намного превышает потенциал воды 2SO42– – 2e– = S2O82–, E0=+2,01 В
поэтому вместо них окисляется вода:
2H2O – 4e– = O2 + 4H+, E0=1,228 В
Слайд 10
ПРАВИЛА ПРОЦЕССОВ ЭЛЕКТРОЛИЗА
При электролизе водного раствора соли из активного металла
и кислородосодержащей кислоты на катоде выделяется Н2, а на аноде
– О2.
К- Na2SO4 А +
← Na+ SO4²ˉ→
2H2O + 2e– →H2 + 2OH– | 2H2O- 4eˉ →O2 +4H+
Электролиз воды 2H2O→ Н2↑ +О2↑
Слайд 11
При электролизе раствора соли из активного металла и бескислородной кислоты
на катоде образуется - Н2, на аноде – неметалл, а
в растворе – основание ( из Fˉ - O2)
2H2O + 2NaCl = H2 + Cl2 + 2NaOH
Если металл средней активности связан с кислородосодержащим анионом, то на катоде образуется металл и Н2, на аноде – О2.
ZnSO4 +2H2O→Zn+H2+O2+H2SO4
При электролизе раствора соли из металла средней активности и бескислородной кислоты на катоде образуется металл и Н2, на аноде – неметалл. 2ZnCl2+2H2O→Zn+H2+Zn(OH)2+2Cl2
Слайд 12ПРАВИЛА ПРОЦЕССОВ ЭЛЕКТРОЛИЗА
При электролизе водного раствора соли из малоактивного металла
и кислородосодержащей кислоты на катоде выделяется металл, а на аноде
– О2 и кислота.
K- СuSO4 A+
Cu2+ SO4²ˉ
← →
Cu2+ + 2e– = Cu0 2H2O – 4e– = O2 + 4H+
2СuSO4 + 2H2O=2Сu+ O2 +2H2SO4
Слайд 13ПРАВИЛА ПРОЦЕССОВ ЭЛЕКТРОЛИЗА
При электролизе катиона аммония NH4+
восстанавливается вода.
При электролизе солей
органических кислот на катоде восстанавливается вода, на аноде анион кислоты с образованием алкана и углекислого газа.
2CH3COONa +2H2O=C2H6↑+2CO2↑+H2↑+2NaOH
Слайд 14ПРАВИЛА ПРОЦЕССОВ ЭЛЕКТРОЛИЗА
Электролиз раствора щелочи – это электролиз воды.
Электролиз раствора
кислородосодержащей кислоты – это тоже электролиз воды.
Электролиз бескислородной кислоты: на
катоде образуется водород, на аноде –неметалл.
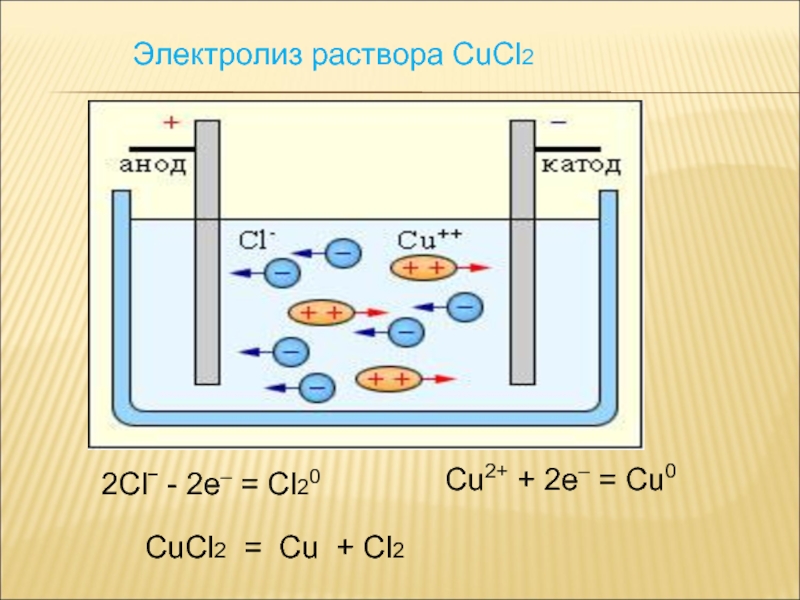
Слайд 16Электролиз раствора CuCl2
2Clˉ - 2e– = Cl20
Cu2+ + 2e–
= Cu0
CuCl2 = Cu + Cl2
Слайд 17ТВОРЧЕСКИХ УСПЕХОВ И ОТКРЫТИЙ, КОЛЛЕГИ!