Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Элементы главной подгруппы III группы
Содержание
- 1. Элементы главной подгруппы III группы
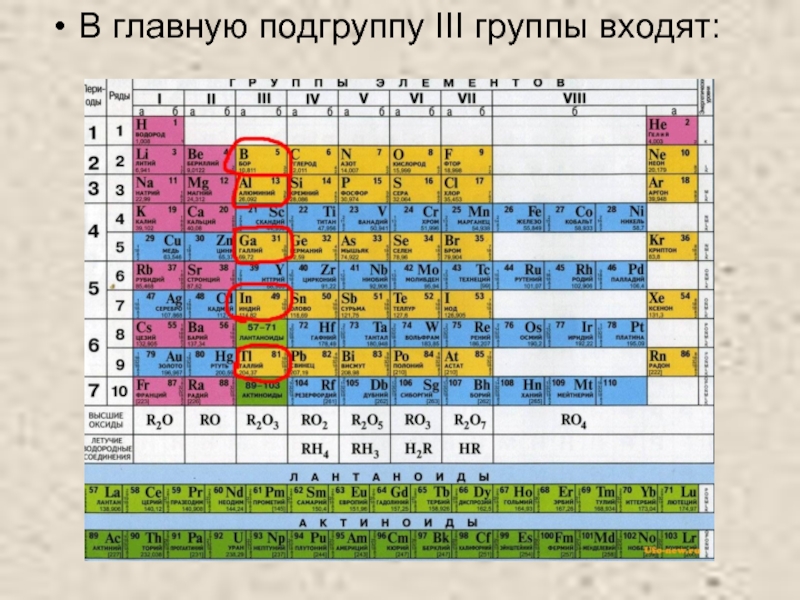
- 2. В главную подгруппу III группы входят:
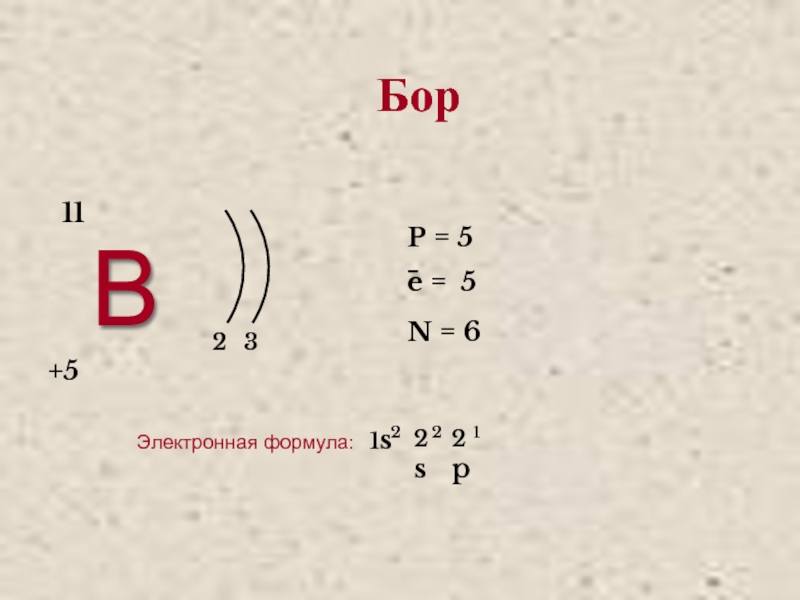
- 3. В 23 +5 11P = 5e = 5N = 6−Электронная формула:Бор
- 4. Алюминий Al 27+130283P = 13e = 13N = 14−Электронная формула:Al Al
- 5. ГаллийGa +317028183P = 31e = 31N = 39−Электронная формула:
- 6. ИндийIn115+498183182P = 49e = 49N = 66Электронная формула:−
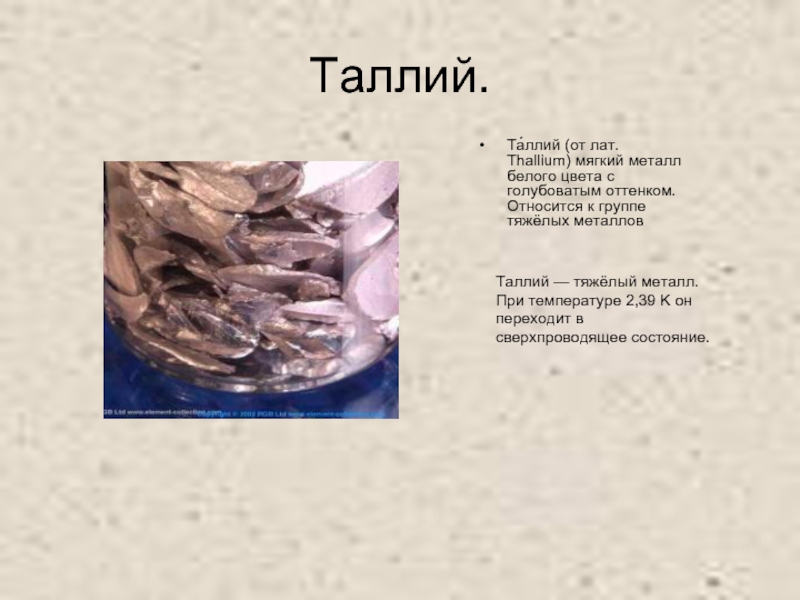
- 7. Таллий−Tl 818322183P = 81e = 81N = 123204+81Электронная формула:
- 8. Общая характеристикаНа внешнем электронном уровне элементов главной
- 9. Бор Бор (от лат. Borum). В свободном состоянии бор —
- 10. АлюминийАлюми́ний (от лат. Aluminium)-лёгкий, парамагнитный металл серебристо-белого цвета, легко
- 11. Галлий.Га́ллий (от лат. Gallium) мягкий пластичный металл
- 12. Индий.И́ндий (от лат. Indium) ковкий, легкоплавкий, очень мягкий металл
- 13. Таллий.Та́ллий (от лат. Thallium) мягкий металл белого
- 14. Применение.Бор
- 15. ПрименениеАлюминий
- 16. Применение.Галлий
- 17. Применение.Индий
- 18. Применение.Таллий
- 19. Химические свойстваЛегко реагирует с простыми веществами:1. С
- 20. 2. С галогенами (кроме фтора), образуя хлорид,
- 21. с другими неметаллами реагирует при нагревании: с
- 22. с серой, образуя сульфид алюминия: 2Al +
- 23. с азотом, образуя нитрид алюминия: 2Al +
- 24. с углеродом, образуя карбид алюминия: Al +
- 25. Со сложными веществами:с водой (после удаления защитной
- 26. со щелочами (с образованием тетрагидроксоалюминатов и других
- 27. Скачать презентанцию
В главную подгруппу III группы входят:
Слайды и текст этой презентации
Слайд 1город Альметьевск 2012 год
Выполнили:
ученицы 11
класса Зигангирова Регина Фазлиахметова Аделя Проверила: Ильясова Л.С.
подгруппы III группыСлайд 8Общая характеристика
На внешнем электронном уровне элементов главной подгруппы имеется по
три электрона (s2р1). Они легко отдают эти электроны или образуют
три неспаренных электрона за счет перехода одного электрона на р-уровень. Для бора и алюминия характерны соединения только со степенью окисления +3. В отличие от алюминия галлий обладает явно неметаллическими свойствами. Эти свойства в ряду Gа, In, Тl ослабевают, а металлические свойства усиливаются.Все элементы III группы обладают очень сильным сродством к кислороду, и образование их оксидов сопровождается выделением большого количества теплоты.
Слайд 9Бор
Бор (от лат. Borum). В свободном состоянии бор — бесцветное, серое или
красное кристаллическое либо тёмное аморфное вещество.
Чрезвычайно твёрдое вещество (уступает
только алмазу, нитриду углерода, нитриду бора (боразону), карбиду бора, сплаву бор-углерод-кремний, карбиду скандия-титана). Обладает хрупкостью и полупроводниковыми свойствами (широкозонный полупроводник).Слайд 10Алюминий
Алюми́ний (от лат. Aluminium)-лёгкий, парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью,
механической обработке. Относится к группе лёгких металлов.
Алюминий обладает высокой
тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия.Слайд 11Галлий.
Га́ллий (от лат. Gallium) мягкий пластичный металл серебристо-белого цвета с
синеватым оттенком. Относится к группе лёгких металлов.
Одной из особенностей галлия
является широкий температурный интервал существования жидкого состояния (от 30 и до 2230 °C), при этом он имеет низкое давление пара при температурах до 1100—1200 °C.Слайд 12Индий.
И́ндий (от лат. Indium) ковкий, легкоплавкий, очень мягкий металл серебристо-белого цвета. Относится
к группе лёгких металлов.
Сходен по химическим свойствам с алюминием
и галлием, по внешнему виду с цинком.Слайд 13Таллий.
Та́ллий (от лат. Thallium) мягкий металл белого цвета с голубоватым
оттенком. Относится к группе тяжёлых металлов
Таллий — тяжёлый металл. При
температуре 2,39 K он переходит в сверхпроводящее состояние.Слайд 19Химические свойства
Легко реагирует с простыми веществами:
1. С кислородом, образуя оксид
алюминия:
Al + O2 =
Задание № 1
Составьте уравнение
реакции, расставьте коэффициенты с помощью электронного балансаПроверим.
4Al + 3O2 = 2Al2O3
Слайд 202. С галогенами (кроме фтора), образуя хлорид, бромид или иодид
алюминия:
Al + Cl2 =
Задание №2
Составьте уравнение реакции,
расставьте коэффициенты с помощьюэлектронного баланса
Проверим.
2Al + 3Cl2 = 2AlCl3
Слайд 21с другими неметаллами реагирует при нагревании:
с фтором, образуя фторид
алюминия:
Al + F2 =
Задание №3
Составьте уравнение реакции, расставьте
коэффициенты с помощьюэлектронного баланса
Проверим
2Al + 3F2 = 2AlF3
Слайд 22с серой, образуя сульфид алюминия:
2Al + S =
Задание
№4
Составьте уравнение реакции, расставьте коэффициенты с помощью
электронного баланса
Проверим
2Al + 3S
= Al2S3Слайд 23с азотом, образуя нитрид алюминия:
2Al + N =
Задание
№5
Составьте уравнение реакции, расставьте коэффициенты с помощью
электронного баланса
Проверим
2Al + N2
= 2AlNСлайд 24с углеродом, образуя карбид алюминия:
Al + 3С =
Задание №6
Составьте
уравнение реакции, расставьте коэффициенты с помощью
электронного баланса
Проверим
4Al + 3С =
Al4С3Слайд 25Со сложными веществами:
с водой (после удаления защитной оксидной пленки, например,
амальгамированием или растворами горячей щёлочи):
2Al + Н2O =
Задание
№7Составьте уравнение реакции, расставьте коэффициенты с помощью
электронного баланса
Проверим
2Al + 6H2O = 2Al(OH)3 + 3H2
Слайд 26
со щелочами (с образованием тетрагидроксоалюминатов и других алюминатов):
Al +
NaOH + H2O =
Задание №8
Составьте уравнение реакции, расставьте коэффициенты
с помощьюэлектронного баланса
Проверим
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Теги