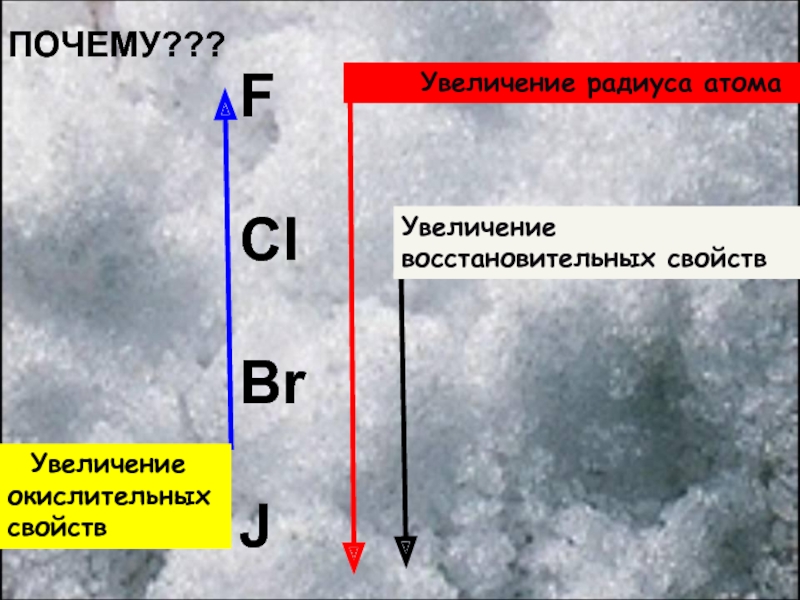
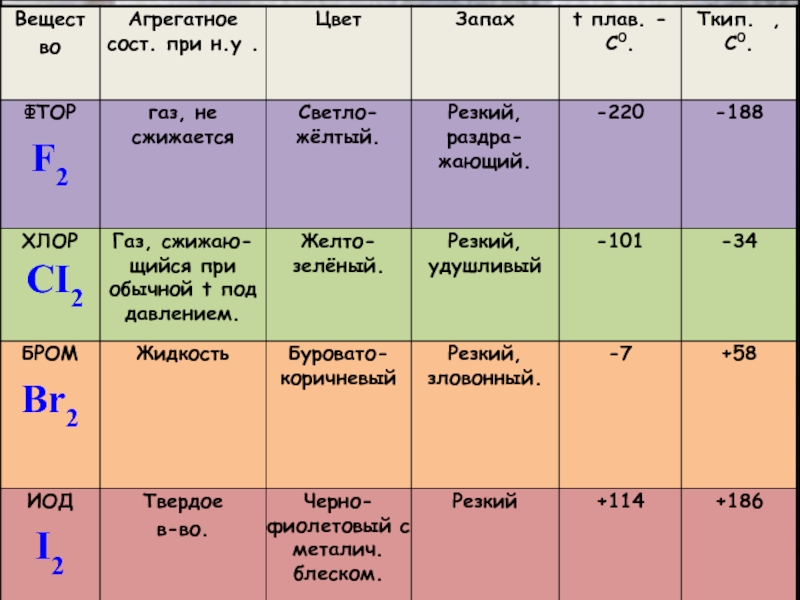
в главной подгруппе 7 группы.
Фтор (F), хлор(Cl), бром (Br),
йод (I), астат (At) Галогены имеют степень окисления +1,+3,+5,+7, -1
У фтора только -1
В природе наиболее распространён- хлор. Астат получен искусственным путём.