Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Гидролиз солей 11 класс
Содержание
- 1. Гидролиз солей 11 класс
- 2. Гидроксиды NaOH, KOH, NH4OH, Cu(OH)2, Zn(OH)2, Al(OH)3,
- 3. *Громова О.ИЭлектролитысильные: NaOH, KOH, H2SO4, HNO3, HClO4,
- 4. *Громова О.ИИзменение цвета различных индикаторов при действии растворов кислот и щелочей
- 5. *Громова О.ИЛюбую соль можно представить как продукт
- 6. *Громова О.И1.Соли, образованные сильной кислотой и слабым
- 7. *Громова О.И Гидролизом называется
- 8. *Громова О.И Схема гидролиза NaCN
- 9. *Громова О.ИУравнения гидролиза NaCNNaCN ↔Na+ + CN‾Н2О
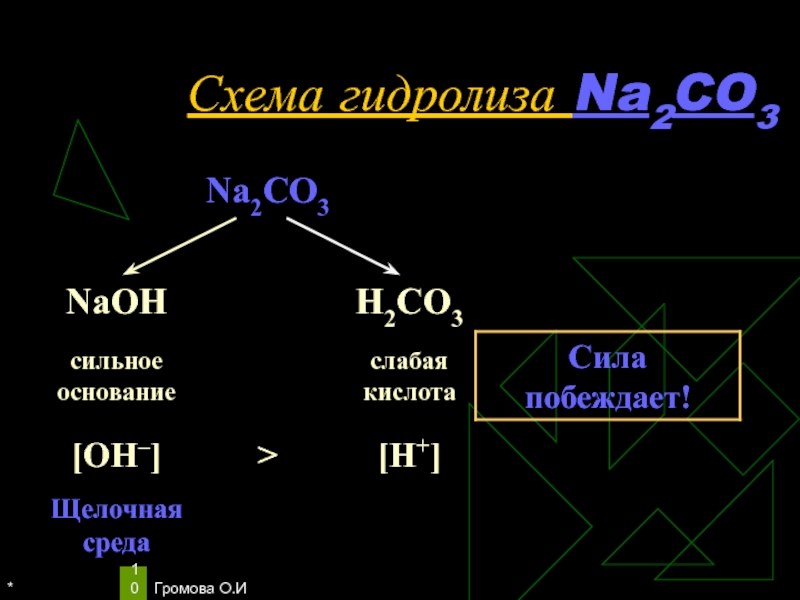
- 10. *Громова О.ИСхема гидролиза Na2CO3
- 11. *Громова О.ИУравнения гидролиза Na2CO3Na2CO3 ↔ 2Na+ +
- 12. *Громова О.И Схема гидролиза NH4Cl
- 13. *Громова О.ИУравнения гидролиза NH4ClNH4Cl ↔ NH4+ +
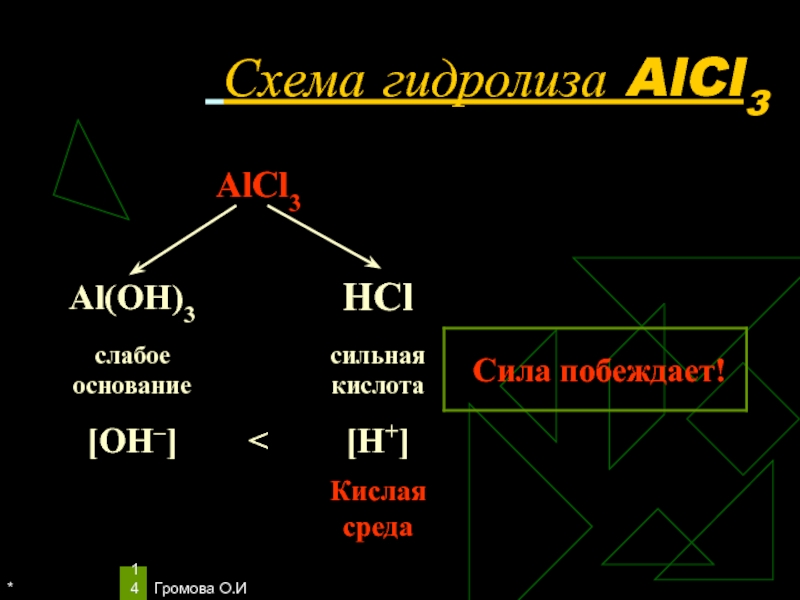
- 14. *Громова О.И Схема гидролиза AlCl3
- 15. *Громова О.ИУравнения гидролиза АlСl3АlСl3 ↔ Аl3+ +
- 16. *Громова О.ИСхема гидролиза Al2S3
- 17. *Громова О.ИУравнения гидролиза Al2S3Al2S3 + 6H2O-->2Al(OH)3 + 3H2SГидролиз по катиону и аниону.
- 18. *Громова О.ИСхема гидролиза NaCl
- 19. *Громова О.ИУравнения гидролиза NaClNaCl ↔ Na+ +
- 20. *Громова О.ИВыполните следующие заданияКакую среду будут иметь
- 21. *Громова О.ИОтветы
- 22. *Громова О.ИZn(NO3)2 ↔ Zn2+ + 2NO3–Н2O ↔
- 23. б)
- 24. *Громова О.ИNa2S ↔ 2Na+ + S2–Н2O ↔
- 25. *Громова О.ИЗадания ЕГЭ
- 26. *Громова О.ИЗадания В-4 (ЕГЭ) 1. Установите соответствие
- 27. *Громова О.И2. Установите соответствие между составомсоли и реакцией среды её водного раствора.
- 28. *Громова О.И3. Установите соответствие между названием соли и средой её водного раствора.
- 29. *Громова О.ИЗадние на дом:Параграф 18, № 1-11.В контакте. Ru, в заметках, материал ЕГЭ выполнить.
- 30. *Громова О.ИИсточники материаловКузьменко Н.Е., Еремин В.В., Попков
- 31. Скачать презентанцию
Гидроксиды NaOH, KOH, NH4OH, Cu(OH)2, Zn(OH)2, Al(OH)3, H2SO4, HNO3, HClO4, HCl, HMnO4, HI, HBr, H2SO3, H2CO3, H2SiO3, HF, HNO2
Слайды и текст этой презентации
Слайд 1Гидролиз солей.
Единственный путь,
Ведущий к знанию,-
Это деятельность.
«Шоу»
Составила Громова Ольга Ильинична,
учитель химии и биологии
Слайд 2Гидроксиды
NaOH, KOH, NH4OH,
Cu(OH)2, Zn(OH)2, Al(OH)3, H2SO4,
HNO3, HClO4,
HCl, HMnO4, HI, HBr,
H2SO3, H2CO3, H2SiO3, HF, HNO2
Слайд 3*
Громова О.И
Электролиты
сильные: NaOH, KOH, H2SO4, HNO3, HClO4, HCl, HMnO4, HI,
HBr;
слабые: , NH4OH, Cu(OH)2, Zn(OH)2, Al(OH)3, H2SO3, H2CO3, H2SiO3, HF,
HNO2, СН3СООНСлайд 5*
Громова О.И
Любую соль можно представить как продукт взаимодействия основания с
кислотой.
В зависимости от силы основания и кислоты можно выделить 4
типа солей:Слайд 6*
Громова О.И
1.Соли, образованные сильной кислотой и слабым основанием (AlCl3, FeSO4,
Mn(NO3)2.)
2. Соли, образованные сильным основанием и слабой кислотой (Na2CO3, КСN,
NaCH3COO).3. Соли, образованные слабой кислотой и
слабым основанием (NH4CN, Cu(CH3COO)2).
4. Соли, образованные сильной кислотой и сильным основанием (NaCl, K2SO4, BaI2).
Слайд 7*
Громова О.И
Гидролизом называется взаимодействие веществ с водой, при котором составные
части вещества соединяются с составными частями воды.
Гидролизу подвержены соединения различных
классов. Рассмотрим один случай – гидролиз солей. Слайд 9*
Громова О.И
Уравнения гидролиза NaCN
NaCN ↔Na+ + CN‾
Н2О ↔ H+
+ OH ‾
____________________________
Полное ионное уравнение гидролиза:
Na+ + CN¯ +
Н2О ↔ Na+ + OH¯ + HCNСокращённое уравнение гидролиза:
CN¯ + Н2О ↔ OH¯ + HCN
Полное молекулярное уравнение гидролиза:
NaCN + Н2О ↔ NaOH + HCN
Избыток гидроксид-ионов дает соли щелочную среду, поэтому лакмус синеет, а фенолфталеин становится малиновым.
рн >7, среда щелочная, гидролиз по аниону.
Слайд 11*
Громова О.И
Уравнения гидролиза Na2CO3
Na2CO3 ↔ 2Na+ + СO32–
Н2O ↔ Н+
+ ОН–
____________________________________________________________________________
Полное ионное уравнение гидролиза:
2Na+ + СO32– + Н2O ↔
2Na+ + HCO3– + ОН–Сокращённое уравнение гидролиза:
СO32– + Н2O ↔ НСO3– + ОН–
Полное молекулярное уравнение гидролиза:
Na2CO3 + Н2O ↔ NaHCO3 + NaОН
Избыток гидроксид-ионов дает соли щелочную среду, поэтому лакмус синеет, а фенолфталеин становится малиновым.
рн >7, среда щелочная, гидролиз по аниону.
Слайд 13*
Громова О.И
Уравнения гидролиза NH4Cl
NH4Cl ↔ NH4+ + Сl–
Н2O ↔ Н+
+ ОН–
_________________________________________
Полное ионное уравнение гидролиза:
NH4+ + Сl– +
Н2O ↔ NH3·H2О + Сl– + Н+Сокращённое уравнение гидролиза:
NH4+ + Н2O ↔ NH3·H2О + Н+
Полное молекулярное уравнение гидролиза:
NH4Cl + Н2O ↔ NH3·H2О + НСl
Избыток ионов водорода дает соли кислую среду, поэтому лакмус краснеет.
рн < 7, среда кислотная, гидролиз по катиону.
Слайд 15*
Громова О.И
Уравнения гидролиза АlСl3
АlСl3 ↔ Аl3+ + 3Сl–
Н2O ↔ Н+
+ ОН–
______________________________________
Полное ионное уравнение гидролиза:
Al3+ + 3Сl– + Н2O ↔
АlOН2+ + 3Сl– + Н+Сокращённое уравнение гидролиза:
Аl3+ + Н2O ↔ АlOН2+ + Н+
Полное молекулярное уравнение гидролиза:
АlСl3 + Н2O ↔ АlOНСl2 + НСl
Избыток ионов водорода дает соли кислую среду, поэтому лакмус краснеет.
рн < 7, среда кислотная, гидролиз по катиону.
Слайд 17*
Громова О.И
Уравнения гидролиза Al2S3
Al2S3 + 6H2O-->2Al(OH)3 + 3H2S
Гидролиз по катиону
и аниону.
Слайд 19*
Громова О.И
Уравнения гидролиза NaCl
NaCl ↔ Na+ + Сl–
Н2O ↔ Н+
+ ОН–
____________________________________________________________________________
Na+ + Сl– + Н2O ↔ Na+ + Cl–
+ H2OОдинаковое количество гидроксид-ионов и ионов водорода дает соли нейтральную среду, поэтому индикаторы не меняют окраску (гидролизу не подвергается).
рн =7, среда нейтральная, гидролиз не происходит.
Слайд 20*
Громова О.И
Выполните следующие задания
Какую среду будут иметь водные растворы следующих
солей: 1 вариант
2 варианта) нитрата цинка (II) а) хлорида меди (II) б) сульфата калия б) сульфита натрия в) сульфида натрия в) нитрата бария
Составьте ионное уравнение гидролиза этих солей.
Слайд 22*
Громова О.И
Zn(NO3)2 ↔ Zn2+ + 2NO3–
Н2O ↔ Н+ + ОН
–
________________________________________________________
Zn2+ + 2NO3– + Н2O ↔ ZnOН+ + 2NO3– +
Н+Zn2+ + Н2O ↔ ZnOН+ + Н+ (среда кислая)
Zn(NO3)2 + Н2O ↔ ZnOНNO3 + НNO3
2 вариант
CuCl2 ↔ Cu2+ + 2Сl –
Н2O ↔ Н+ + ОН –
_______________________________________________________________________________________________________________________
Cu2+ + Сl – + Н2O ↔ CuOH+ + Cl – + Н+
Сu2+ + Н2O ↔ СuOH+ + Н+ (среда кислая)
CuCl2 + Н2O ↔ CuOHCl + НCl
а) 1 вариант
Слайд 23б)
1 вариант
K2SO4 ↔ 2K+ + SO42–
Н2O ↔ Н+
+ ОН –_____________________________________
2K+ + SO42– + Н2O ↔ 2K+ + SO42– + H2O
(среда нейтральная)
2 вариант
Na2SO3 ↔ 2Na+ + SO32–
Н2O ↔ Н+ + ОН –
________________________________________2Na+ + SO32– + Н2O ↔ 2Na+ + HSO3– + ОН-
SO3 2– + Н2O ↔ НSO3– + ОН – (среда щелочная)
Na2SO3 + Н2O = NaHSO3+ NaОН
Слайд 24*
Громова О.И
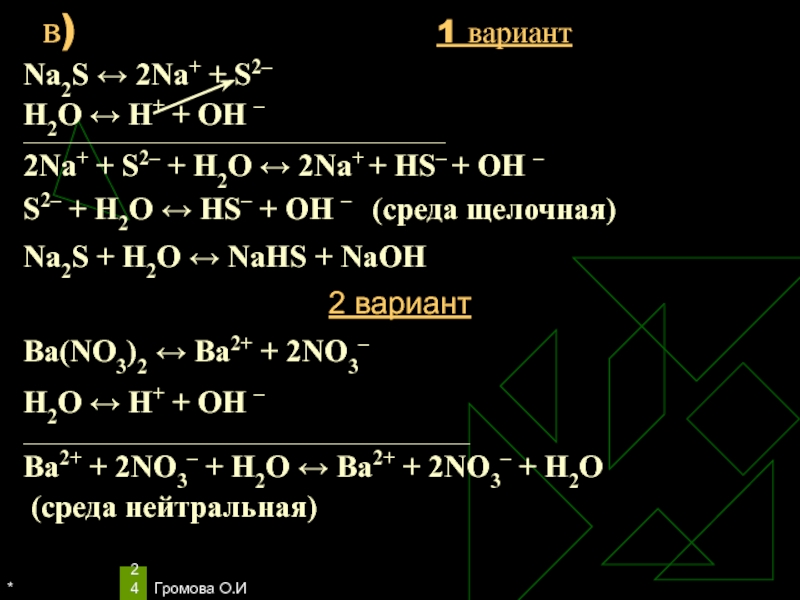
Na2S ↔ 2Na+ + S2–
Н2O ↔ Н+ + ОН
–
____________________________________________________________________________
2Na+ + S2– + Н2O ↔ 2Na+ + HS– +
ОН –S2– + Н2O ↔ НS– + ОН – (среда щелочная)
Na2S + Н2O ↔ NaHS + NaОН
2 вариант
Ba(NO3)2 ↔ Ba2+ + 2NO3–
Н2O ↔ Н+ + ОН –
___________________________________________________________________
Ba2+ + 2NO3– + Н2O ↔ Ba2+ + 2NO3– + Н2O
(среда нейтральная)
в) 1 вариант
Слайд 26*
Громова О.И
Задания В-4 (ЕГЭ)
1. Установите соответствие между составом соли и
реакцией среды её водного раствора.
Слайд 27*
Громова О.И
2. Установите соответствие между составомсоли и реакцией среды её
водного раствора.
Слайд 29*
Громова О.И
Задние на дом:
Параграф 18, № 1-11.
В контакте. Ru, в
заметках, материал ЕГЭ выполнить.
Слайд 30*
Громова О.И
Источники материалов
Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии.
— М.: Экзамен, 2001.
Хомченко Г.П. , Хомченко И.Г. Сборник задач
по химии. — М., 2000 .http://hydorlysis.narod.ru/pages/teoria.htm
http://www.xumuk.ru/encyklopedia/1047.html