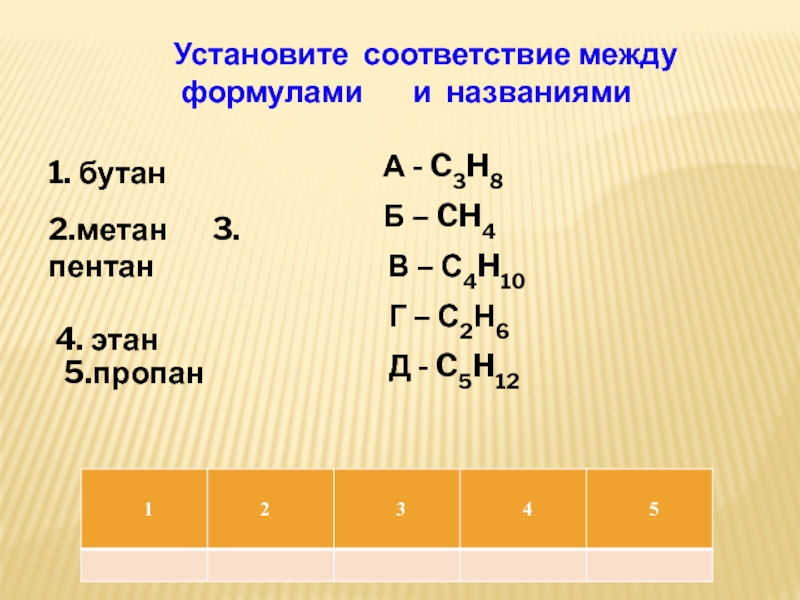
о вытеснительном ряде активности металлов.
Познакомить учащихся с индикаторами и их
применением.Раскрыть сущность реакций замещения .
Научить ребят прогнозировать возможность протекания некоторых реакций, используя ряд активности металлов.
Развивать и закреплять умение учащихся работать с лабораторным оборудованием и химическими реактивами.
Познакомить учеников с техникой безопасности при работе с кислотами.
Воспитывать бережное отношение к своему здоровью и экономное отношение к использованию реактивов.