периодической системе
химических элементов Д.И.Менделеева
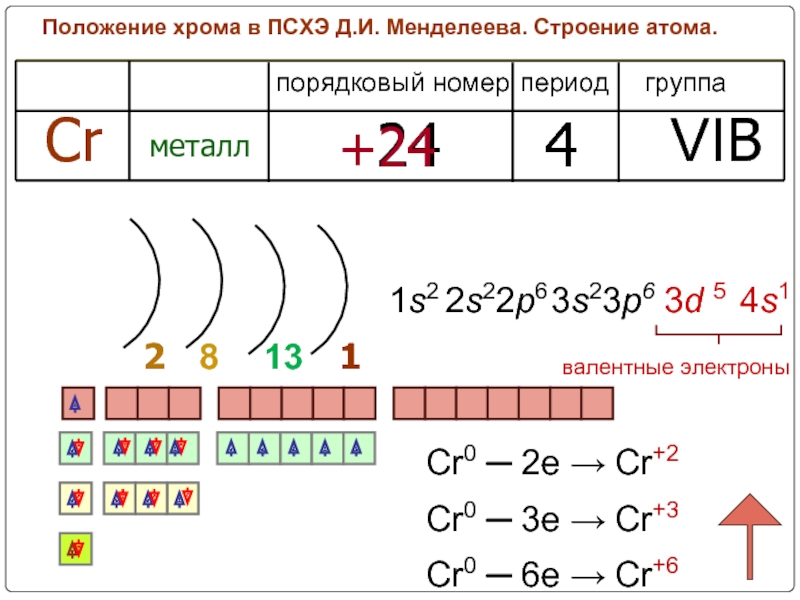
2. Строение атома.
III.Хром – простое вещество
3.
Нахождение в природе1. Состав. Физические свойства.
2. Получение.
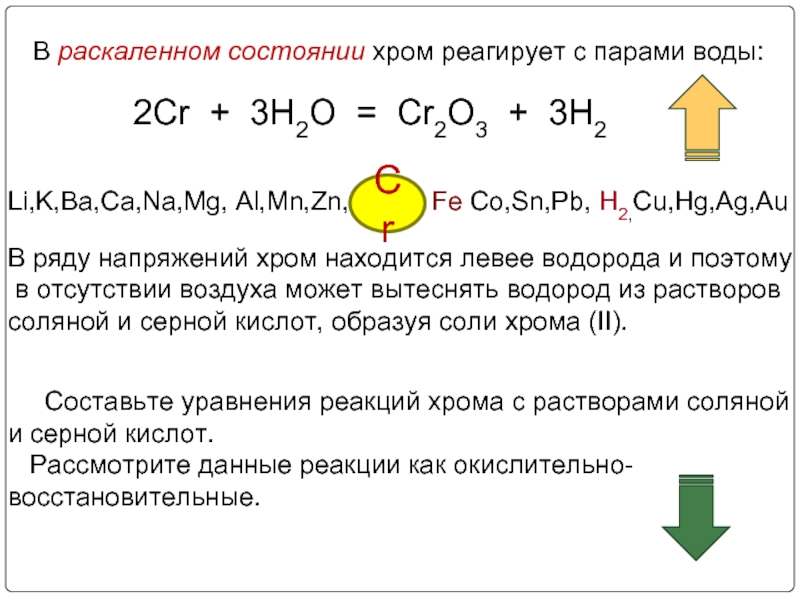
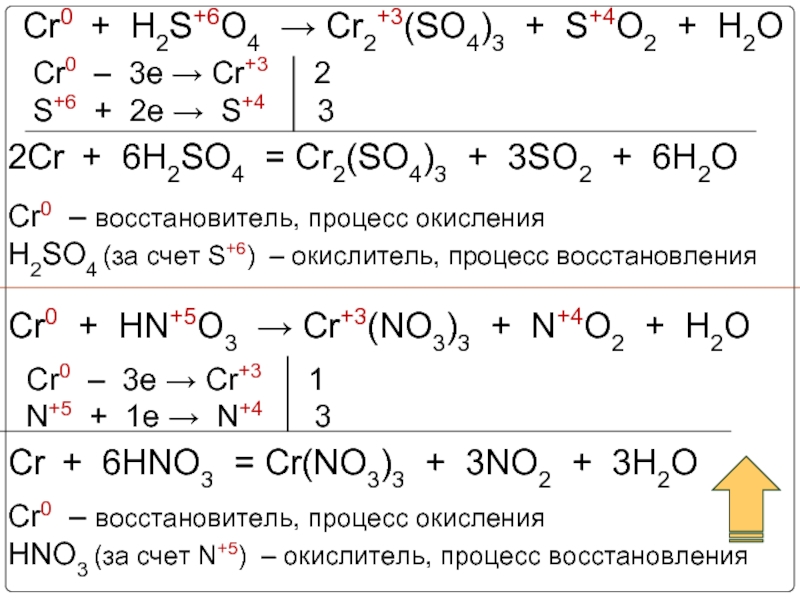
3. Химические свойства
4. Биологическая роль и физиологическое действие.
5. Применение
IV. Соединения хрома




















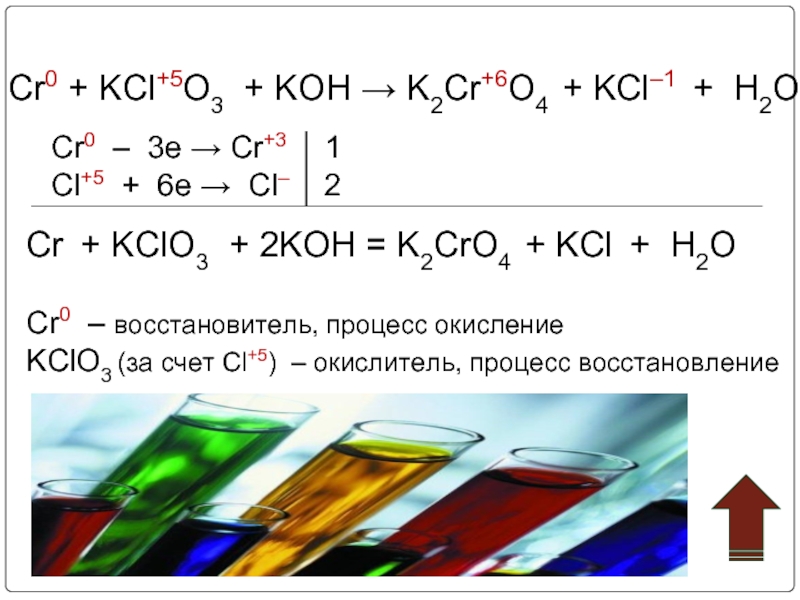





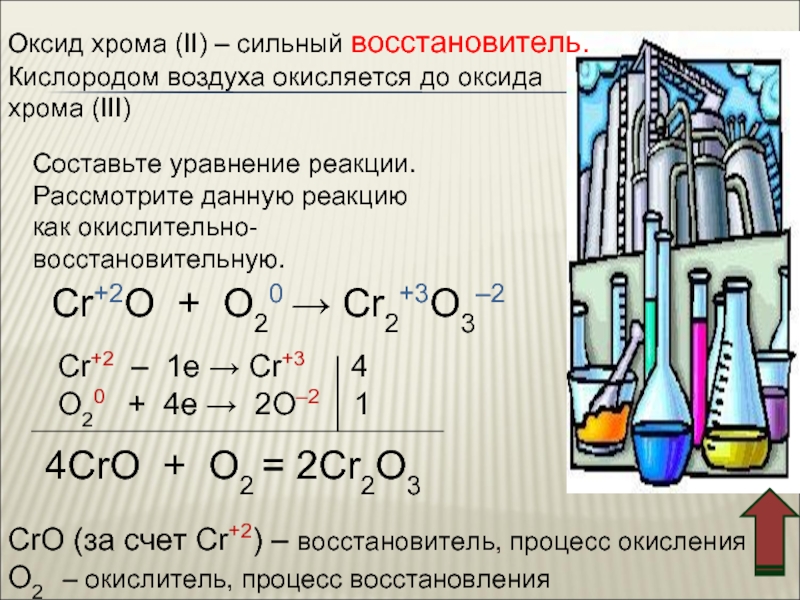








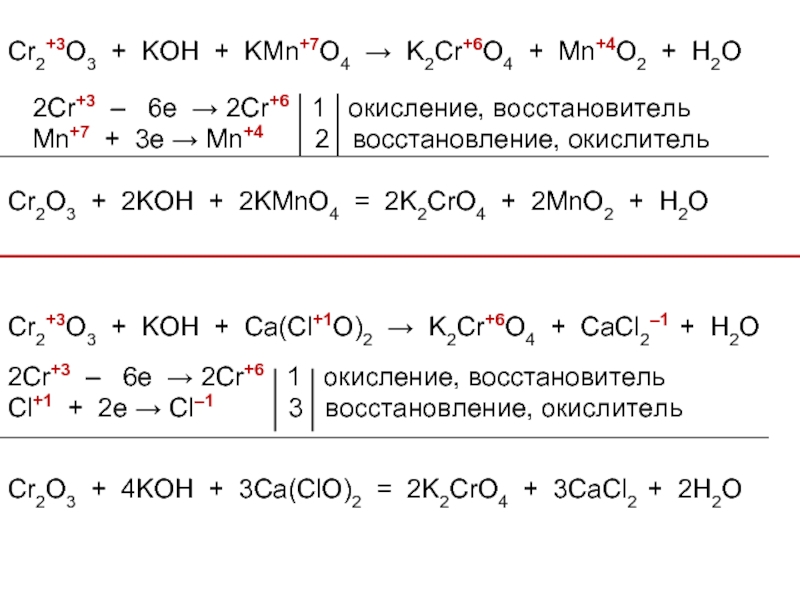
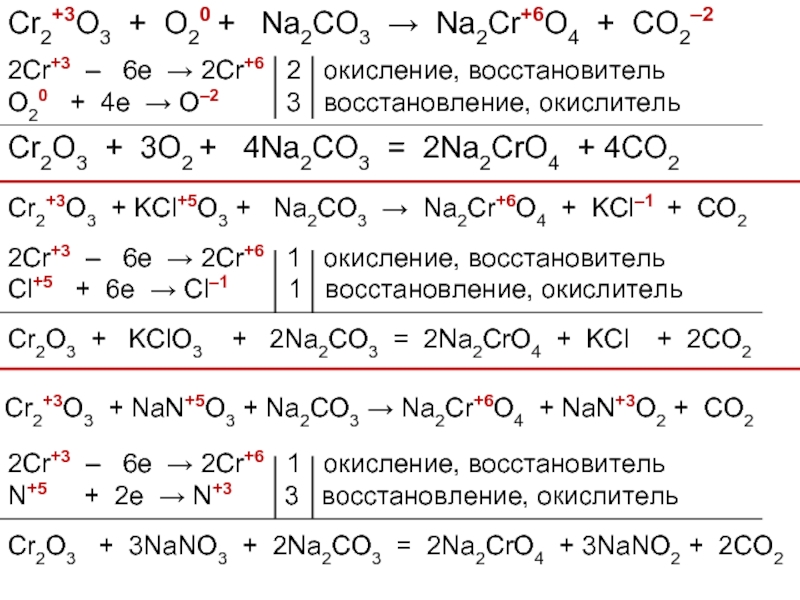



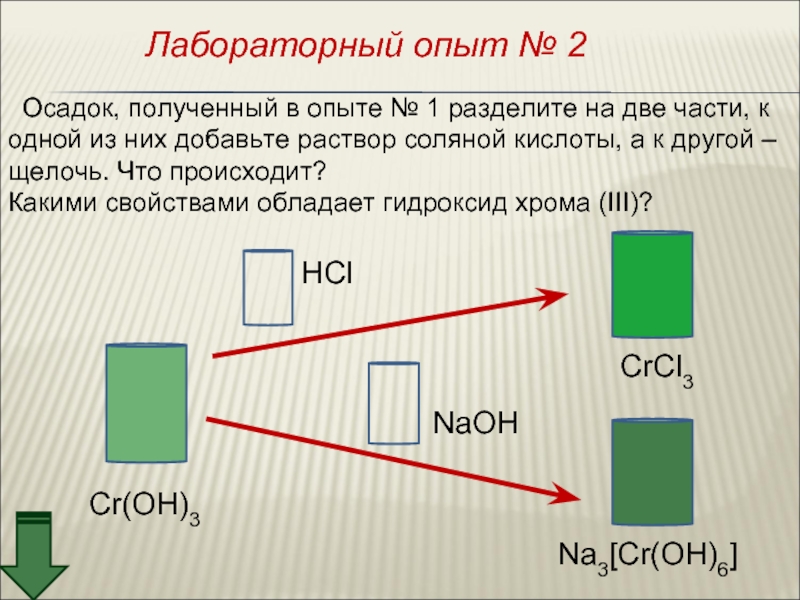


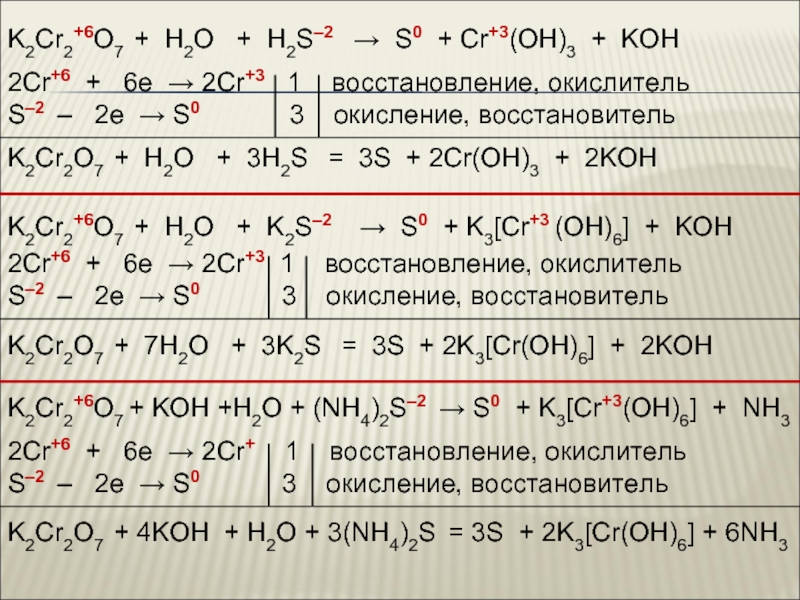
![Хром Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]Cr(OH)3 + 3Na+ + 3OH– = 3Na+ Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]Cr(OH)3 + 3Na+ + 3OH– = 3Na+ + [Cr(OH)6]3–Cr(OH)3 + 3OH– = [Cr(OH)6]3–2Cr(OH)3](/img/thumbs/5811f4a72027a8257b31b02cdd3cb745-800x.jpg)



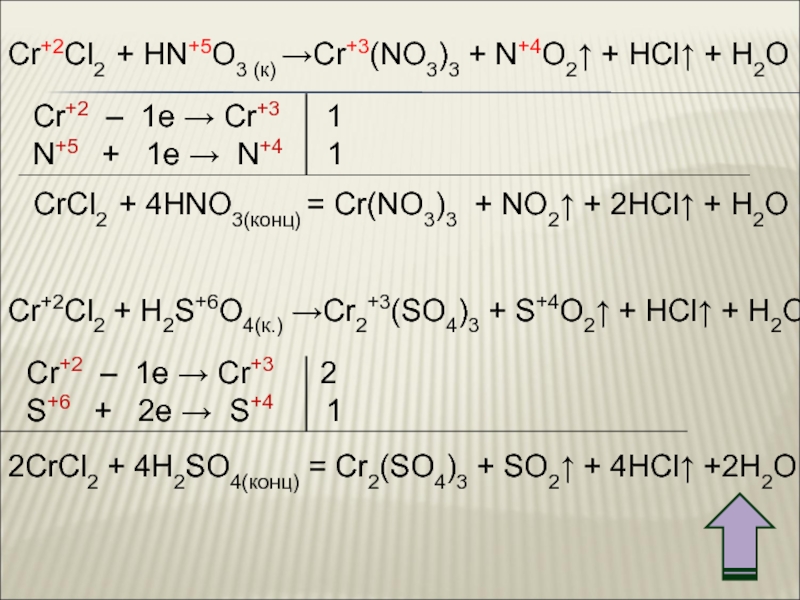
![Хром K3[Cr+3(OH)6] + Br20 + KOH → K2Cr+6O4 + KBr– + H2O K3[Cr+3(OH)6] + Br20 + KOH → K2Cr+6O4 + KBr– + H2O Cr+3 – 3e → Cr+6](/img/thumbs/8338cb1d8d5a48979ed7167d64f96275-800x.jpg)



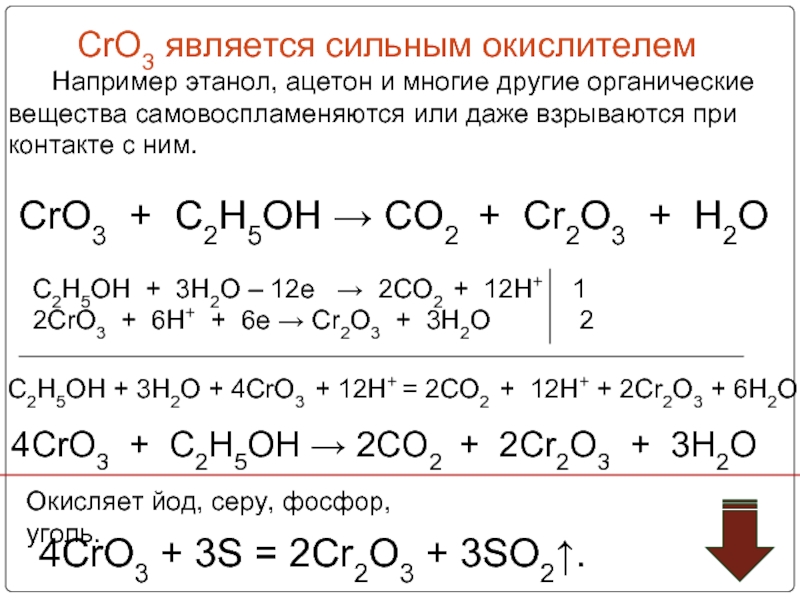



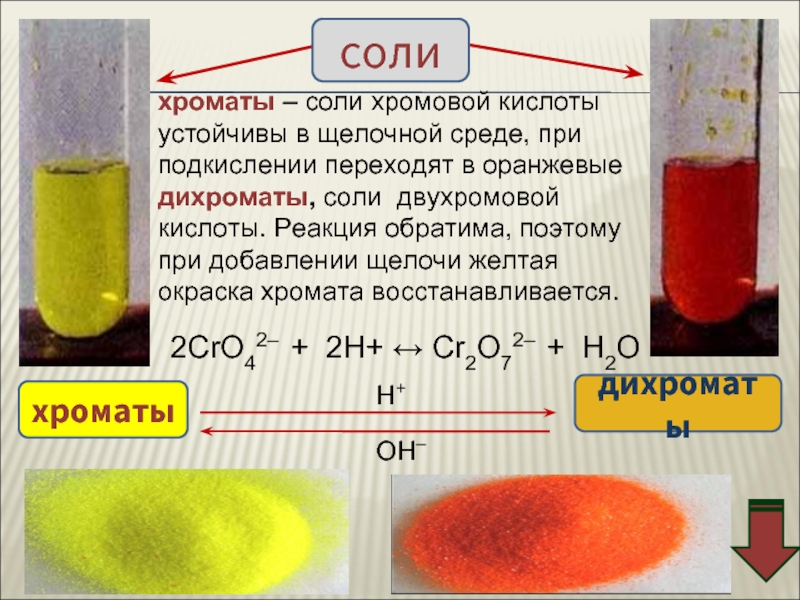



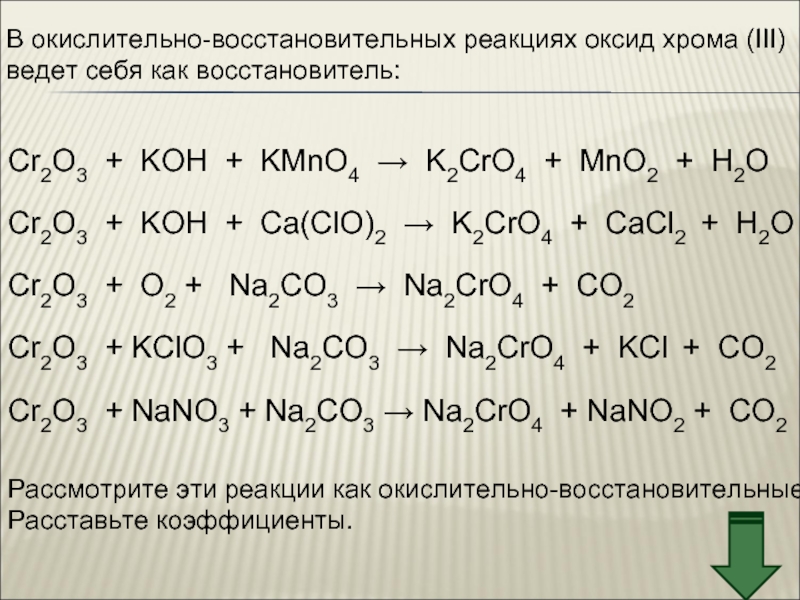
![Хром Соединения хрома (VI) – сильные окислители Cr2O72–Cr3+Cr(OH)3[Cr(OH)6]3–H+H2OOH–Cr2O72– + 14H+ + Соединения хрома (VI) – сильные окислители Cr2O72–Cr3+Cr(OH)3[Cr(OH)6]3–H+H2OOH–Cr2O72– + 14H+ + 6e → 2Cr3+ + 7H2OCr2O72–](/img/thumbs/aa65277833541eb839b90f3e7399bf0d-800x.jpg)