Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ионная химическая связь
Содержание
- 1. Ионная химическая связь
- 2. Ионная химическая связьИонная химическая связь – это
- 3. Атомы, присоединившие свои электроны, превращаются в отрицательные
- 4. Два разноименно заряженных иона, связанные силами притяжения,
- 5. В ионном соединении ионы представлены как бы
- 6. Ковалентная химическая связьКовалентная химическая связь – это связь, возникающая между атомами за счет общих электронных пар.
- 7. 1)Связь возникает благодаря образованию общей электронной пары s-электронами атомов H2 (перекрыванию s-орбиталей)
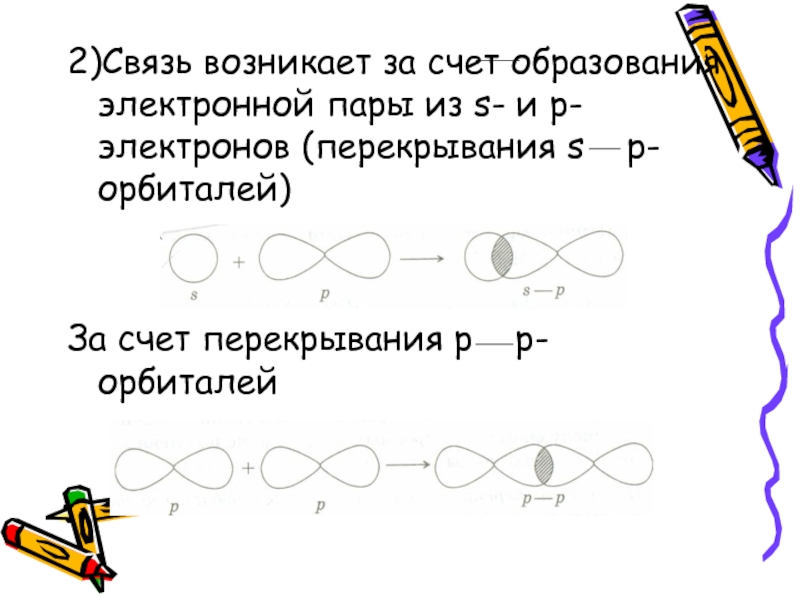
- 8. 2)Связь возникает за счет образования электронной пары
- 9. Донорно-акцепторный механизм образования ковалентной связи рассмотрим на
- 10. По способу перекрывания электронных орбиталей различают σ
- 11. σ-связи могут образовываться за счет перекрывания электронных
- 12. По числу общих электронных пар, связывающих атомы,
- 13. По степени смещённости общих электронных пар к
- 14. Вещества с ковалентной связью характеризуются кристаллической решеткой
- 15. Металлическая связьЭто связь в металлах и сплавах,
- 16. Это связь ненаправленная, ненасыщенная, характеризуется небольшим числом
- 17. Водородная связьХимическая связь между положительно поляризованными атомами
- 18. Механизм образования водородной связи имеет частично электростатический, частично донорно-акцепторный характер.
- 19. В биополимерах – белках имеется внутримолекулярная водородная
- 20. Единая природа химической связиДеление химических связей на
- 21. Различные типы связей могут содержаться в одних
- 22. В солях аммония, метиламмония и т.д. –
- 23. Различные типы связей могут переходить одна в
- 24. Причиной единства всех типов и видов химических связей служит их одинаковая физическая природа – электронноядерное взаимодействие
- 25. Скачать презентанцию
Ионная химическая связьИонная химическая связь – это связь, образовавшаяся за счет электрического притяжения катионов к анионам.Наиболее устойчивой является такая электронная конфигурация атомов, при которой на внешнем электронном уровне, подобно атомам благородных
Слайды и текст этой презентации
Слайд 1
Под химической связью понимают такое взаимодействие атомов, которое связывает
их в молекулы, ионы, радикалы, кристаллы.
Слайд 2Ионная химическая связь
Ионная химическая связь – это связь, образовавшаяся за
счет электрического притяжения катионов к анионам.
Наиболее устойчивой является такая электронная
конфигурация атомов, при которой на внешнем электронном уровне, подобно атомам благородных газов, будет находиться 8 электронов (а для 1 энергетического уровня – 2)При химических взаимодействиях атомы стремятся приобрести именно такую устойчивую электронную конфигурацию. Это происходит во время процесса восстановления или окисления.
Слайд 3Атомы, присоединившие свои электроны, превращаются в отрицательные ионы, или анионы,
а атомы, отдавшие электроны – в положительные ионы, или катионы.
Между катионами и анионами возникают силы электростатического притяжения, которые будут удерживать их друг около друга, осуществляя тем самым ионную химическую связь. Этот тип связи характерен для элементов главных подгрупп I и II групп, кроме Mg и Be)Слайд 4Два разноименно заряженных иона, связанные силами притяжения, не теряют способности
взаимодействовать с противоположно заряженными ионами, вследствие чего образуются соединения с
ионной кристаллической решеткой.Ионные соединения представляют собой твердые, прочные, тугоплавкие вещества с высокой температурой плавления. Растворы и расплавы большинства ионных соединений – электролиты.
Ионная связь является случаем ковалентной полярной связи.
Слайд 5В ионном соединении ионы представлены как бы в виде электрических
зарядов со сферической симметрией электрического поля, одинаково убывающего с увеличением
расстояния от центра заряда (иона) в любом направлении.Ионная связь ненаправленная.
Слайд 6Ковалентная химическая связь
Ковалентная химическая связь – это связь, возникающая между
атомами за счет общих электронных пар.
Слайд 71)Связь возникает благодаря образованию общей электронной пары s-электронами атомов H2
(перекрыванию s-орбиталей)
Слайд 82)Связь возникает за счет образования электронной пары из s- и
p-электронов (перекрывания s p-орбиталей)
За счет перекрывания p p-орбиталей
Слайд 9Донорно-акцепторный механизм образования ковалентной связи рассмотрим на классическом примере образования
иона аммония NH4
Донор имеет электронную пару, акцептор – свободную орбиталь,
которую эта пара может занять. В ионе аммония все 4 связи ковалентные и равноценные.Слайд 10По способу перекрывания электронных орбиталей различают σ и π-ковалентные связи
(сигма- и пи- )
1). σ –связь. Электронная плотность находится в
одной области, расположенной на линии, соединяющей ядра атомов. Эта связь прочная.2)π-связь образуется за счет бокового перекрывания p-орбиталей в двух областях. Эта связь менее прочная.
Слайд 11σ-связи могут образовываться за счет перекрывания электронных орбиталей:
S
S (H2)
S P (HCl)
P P (Cl2)
А
также за счет перекрывания «чистых» и гибридных орбиталейS SP3 (CH4)
SP2 SP3 (C2H4)
Слайд 12По числу общих электронных пар, связывающих атомы, то есть по
кратности, различают связи:
Одинарные
H2
H HДвойные
CO2 O C O
Тройные
N2 N N
Слайд 13По степени смещённости общих электронных пар к одному из связанных
ими атомов ковалентная связь может быть неполярной и полярной.
Ковалентную химическую
связь, образующуюся между атомам с одинаковой электроотрицательностью, называют НЕПОЛЯРНОЙ.H2
Cl2
N2
Ковалентную химическую связь между атомами элементов, электроотрицательности которых различаются, называют ПОЛЯРНОЙ.
NH3
Слайд 14Вещества с ковалентной связью характеризуются кристаллической решеткой двух типов:
Атомной –
очень прочной (алмаз, графит, кварц SiO2)
Молекулярной – в обычных условиях
это газы, легколетучие жидкости и твердые, но легкоплавкие или возгоняющиеся вещества (Cl2, H2O, I2,CO2 и др.)Слайд 15Металлическая связь
Это связь в металлах и сплавах, которую выполняют относительно
свободные электроны между ионами металлов в металлической кристаллической решетке.
Слайд 16Это связь ненаправленная, ненасыщенная, характеризуется небольшим числом валентных электронов и
большим числом свободных орбиталей, что характерно для атомов металлов.
M0
nē Mn+Наличием металлической связи обусловлены физические свойства металлов и сплавов: твердость, электрическая проводимость и теплопроводность, ковкость, пластичность, металлический блеск.
Слайд 17Водородная связь
Химическая связь между положительно поляризованными атомами водорода одной молекулы
(или ее части) и отрицательно поляризованными атомами сильно электроотрицательных элементов,
имеющих неопределенные электронные пары (F, O, N и реже Cl и S) другой молекулы (или ее части)Слайд 18Механизм образования водородной связи имеет частично электростатический, частично донорно-акцепторный характер.
Слайд 19В биополимерах – белках имеется внутримолекулярная водородная связь между карбонильным
кислородом и водородом аминогруппы
C Oδ-…δ+H N
Слайд 20Единая природа химической связи
Деление химических связей на группы носит условный
характер.
Ионную связь можно рассматривать как предельный случай ковалентной связи.
Металлическая связь
совмещает ковалентное взаимодействие атомов и электростатическое притяжение между этими электронами и ионами металлов.Слайд 21Различные типы связей могут содержаться в одних и тех же
веществах.
Например:
В основаниях – между атомами кислорода и водорода в гидроксогруппах
связь ковалентная полярная, а между металлом и гидроксогруппой – ионная;В солях кислородсодержащих кислот - между атомами неметалла и кислородом кислотного остатка – ковалентная полярная, а между металлом и кислотным остатком – ионная;
Слайд 22В солях аммония, метиламмония и т.д. – между атомами азота
и водорода – ковалентная полярная, а между ионами аммония или
метиламмония и кислотным остатком – ионная и т.д.В пероксидах металлов – связь между атомами кислорода ковалентная неполярная, а между металлом и кислородом – ионная и т.д.
Слайд 23Различные типы связей могут переходить одна в другую
При электролитической диссоциации
в воде ковалентных соединений ковалентная полярная связь переходит в ионную
При
испарении металлов металлическая связь превращается в ковалентную неполярную и т.д.Слайд 24Причиной единства всех типов и видов химических связей служит их
одинаковая физическая природа – электронноядерное взаимодействие
Теги