Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кальций ж?не оны? ?осылыстары.
Содержание
- 1. Кальций ж?не оны? ?осылыстары.
- 2. Сабақтың тақырыбы:s-элементтер туралы білімдеріне сүйене отырып, сілтілік
- 3. І-тапсырма. Графикалыќ диктант.Дұрыс -, ќате ^1.S-элементтер өздерінің
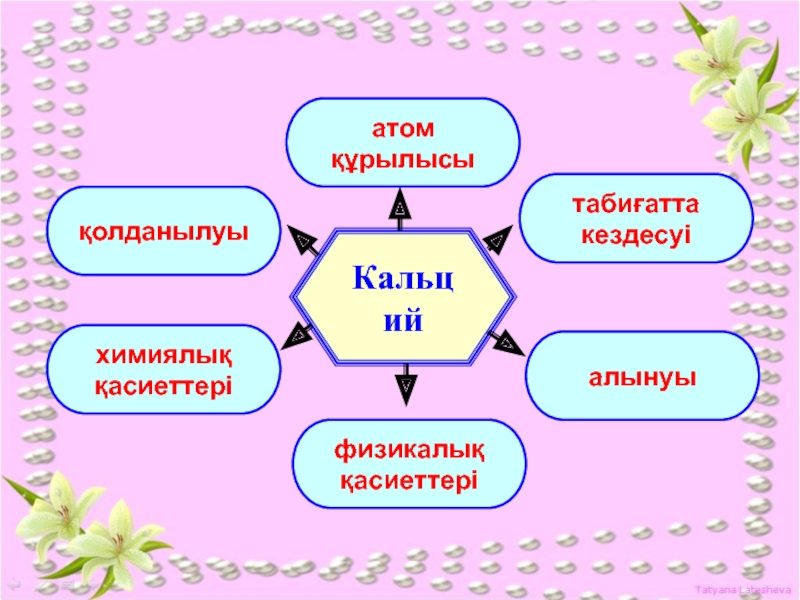
- 4. Кальцийатом құрылысықолданылуытабиғаттакездесуіхимиялыққасиеттеріалынуыфизикалыққасиеттері
- 5. Атом құрылысыФосфордың сыртқы энергетикалық деңгейінде 2 электрон
- 6. Табиғатта кездесуіТабиғатта таралуы: Сілтілік жер металдардың табиғатта
- 7. КӨМІРТЕКТІҢ АЛЛОТРОПИЯЛЫҚ ТҮР ӨЗГЕРІСІалмазграфит карбин
- 8. Физикалық қасиеттері: Са – күміс түстес, ақ,
- 9. Химиялық қасиеттері: Кальций оттекпен әрекеттестіріп, оксид
- 10. Слайд 10
- 11. Кальций қосылыстарыКальций оксиді — ақ түсті қиын
- 12. Табиғаттағы кальций қосылыстарының айналымы.Табиғатта жүретін көптеген процестер
- 13. Кальцийдің химиялық қасиеттерін сипаттайтын мына рекция теңдеулерін аяқтаңыздар. Са+Cl2 →Са+S →Са+Н2 →Ca+O2 →Ca+HCl →Ca+H2O →
- 14. ІІ-тапсырма. Карточкамен жұмыс. 1-карточка. Кальций атомынан валенттік
- 15. 3-карточка. Құрылысшылардың сөндірілмеген ізбесті «қайнатпа», ал сөндірілген
- 16. ІІІ-тапсырма. Тестпен жұмыс.(3-сұрақ) 1. Кальций атомының ядросында
- 17. ІІІ-тапсырма. Мына өзгерістерді жүзеге асыратын реакция теңдеулерін
- 18. Ca → CaO → Ca(OH)2 → CaCО3
- 19. Сәйкестендіру: Ғаныш
- 20. Есептер шығару№1-есеп. 4гр кальций сумен толық әрекеттескенде, неше грамм кальций гидроксиді түзіледі?.
- 21. Есептер шығару №2-есеп. Құрамында 40% кальций,
- 22. Оқушыларды бағалау.Үйге тапсырма:§ 20. Қальций§ 21. Қальций қосылыстары№3; №4; №5
- 23. Бағалау
- 24. Назарларыңызға Рахмет!
- 25. Скачать презентанцию
Сабақтың тақырыбы:s-элементтер туралы білімдеріне сүйене отырып, сілтілік жер металы кальцийдің ПЖ орны, қасиеттеріне, алыну жолына және қосылыстарына сипаттама беру.Нәтижесі: сілтілік жерметалы кальцийдің атом құрылысын ,табиғатта таралуы туралы түсіндіріп бере алады және
Слайды и текст этой презентации
Слайд 1Кальций және оның
қосылыстары.
10 сынып
№ 19 М.Мақатаев атындағы ЖОМ КММ
Битабарова
Хадиша Исабековна
Слайд 2Сабақтың тақырыбы:
s-элементтер туралы білімдеріне сүйене отырып, сілтілік жер металы кальцийдің
ПЖ орны, қасиеттеріне, алыну жолына және қосылыстарына сипаттама беру.
Нәтижесі: сілтілік
жерметалы кальцийдің атом құрылысын ,табиғатта таралуы туралы түсіндіріп бере алады және қасиеттерін сипаттай алады.Слайд 3І-тапсырма. Графикалыќ диктант.Дұрыс -, ќате ^
1.S-элементтер өздерінің валенттілік е оңай
береді.-
2.Ең белсенді Ме жєне өте күшті тотыќсыздандырѓыш литий. ^
3.Сілтілік Ме
сыртќы энергетикалыќ деңгейінде 2е бар. ^4.Сілтілік Ме реттік нөмір артќан сайын атомдыќ жєне иондыќ радиостары артады.-
5.Біздің планетамызда таралуы бойынша натрий екінші орында. ^
6.Калий өсімдікткр үшін негізгі ќоректік элементке жатады.-
7.Натрий және калий бейметалдармен әрекеттескенде тотыќтырѓыш ќасиет көрсетеді. ^
8.Сілтілік Ме оксидтері негіздік оксидке жатады.-
9.Кальцийленген соданыњ формуласы NaCl. ^
10.Ас содасының формуласы NaHCO3.-
11.Екінші топтыњ негізгі топшасында орналасќан Ме-Ве,Zn,Cl,Ba. ^
12.Олардың сыртќы энергетикалыќ деңгейінде 2е бар.-
13.Сілтілік жер Ме барлыќ өкілдері S-бар.-
14.1s22s22p63s2 натрийдің е -дыќ формуласы. ^
15.Магний атомы ядросыныњ ќұрамында 12р+,20n0 бар. ^
16. 1s22s22p63s2 3р6 4s2 кальцийдің е -дыќ формуласы. ^
17.Сілтілік жер Ме тотыѓу дєрежесі -2. ^
18.Сілтілік жер Ме реттік нөмірі артќан сайын ЭТ артады.-
19.Магний мен кальций тіршілік элеенттері ќатарына кіреді.-
20.Ве –екідайлы элемент.-
Слайд 5Атом құрылысы
Фосфордың сыртқы энергетикалық деңгейінде 2 электрон бар. Атомындағы электрондардың
орналасуы:
Электрондық құрылысы:
+20Са )2е )8е )8е)2е
1s2
2s2 2p6 3s2 3p3 4s2 Слайд 6Табиғатта кездесуі
Табиғатта таралуы: Сілтілік жер металдардың табиғатта кең таралғаны кальций,
оның жер қыртысындағы массалық үлесі 3,6%, ал мөлшері бойынша 5
– орын алады. Адам ағзасында 1 кг Са болады. Кальций табиғатта гипстің (CaSO4∙2H2O), фосфорит пен апатиттің (негізгі құраушысы Ca3(PO4)2), флюориттің CaF2кальцит (CaCO3), алебастердің (CaSO4*0,5H2O), доламиттің (CaCO3*2MgCO2) және т.б қосылыстардың құрамында кездеседі.Слайд 8Физикалық қасиеттері: Са – күміс түстес, ақ, жеңіл металл. Тығыздығы
– 1,54 г/см3. Кальций қатты металл, балқу температурасы – 8510С.
Алынуы: Өнеркәсіпте кальцийді сілтілік металдар сияқты, тұздарының балқымасын электролиздеу арқылы алады:
CaCl2 → Ca + Cl2
Слайд 9Химиялық қасиеттері:
Кальций оттекпен әрекеттестіріп, оксид түзеді:
2Са +
О2 → 2СаО
Кальцийдің қосылыстарындағы тотығу дәрежесі тұрақты +2. Ол әртүрлі
бейметалдармен әрікеттеседі: Ca + Br2 → Ca+2Br2-1(кальций бромиді)
Са + S → Ca+2S-2(кальций сульфиді)
Са + N → Ca3+2N2-3(кальций нитриді)
Қышқылдармен әрекеттеседі:
Ca + 2HCl → CaCl2 + H2↑
Кальций күрделі заттарменде реакцияға түседі. Мыс: сумен қуатты әрекеттесіп, одан сутекті ығыстырып шығарады:
Ca + 2H2O → Ca+2(OH)2 + H2
Слайд 11Кальций қосылыстары
Кальций оксиді — ақ түсті қиын балқитын зат. Техникада
оны "сөндірілмеген әк" деп атайды. Оны әктасты жоғары температурада (1000
C0 шамасында) қыздырып, ыдырату арқылы алады:СаС03 =t= СаО + СО2↑- 180кДжКальций оксиді — нағыз негіздік оксид. Кальций сілтілікжер металл болғандықтан, оның оксиді сумен оңай әрекеттесіп кальций гидроксидін, яғни сілтісін түзеді: СаО + Н20 = Са(ОН)2 + 70 кДж
Бұл реакция өте қуатты жүреді, су бұрқылдап "қайнап" жатады, тіпті біразы буланады. Нөтижесінде, сөндірілген әк деп аталатын көпсіген кеуек ақ ұнтақ түзіледі. Кальций гидроксиді суда аз ериді. Оның қанық ерітіндісі лабораторияда әк суы деген атпен жиі колданылады. Кальций гидроксиді ерітіндіде иондарға толық диссоциацияланады:
Са(ОН)2 = Са+2 + 2ОНСілті ерітіндісінің түзілгені фенолфталеиннің таңкурай түске боялуынан байқалады. Кальций гидроксиді қышқылдармен және қышқылдық оксидтермен әрекеттесіп бейтараптанады. Бұл реакцияны лабораторияда көмірқышқыл газын анықтау үшін қолданады. Әқ суына көмір қышқыл газын жібергенде, ол алдымен ерімейтін карбонат түзіп, лайлана бастайды:
Са(ОН)2 + CO2 = СаСО3↓ + Н2О Газды одан өрі жібере берсе, лай көрінбей кетеді, өйткені суда ерімейтін орта тұз ерімтал қышқыл тұзға айналады:
СаСО3 + Н2О + СО2 = Са(НСО3)2
Слайд 12Табиғаттағы кальций қосылыстарының айналымы.
Табиғатта жүретін көптеген процестер кальций түздарымен байланысты
болады. Осындай процестің моделі ретінде жоғарыда қарастырылған кальций карбонатының гидрокарбонатқа
айналуын және оған кері реакцияларды алуға болады. Жаңбыр және басқа да табиғи сулар ауадағы кемірқышкыл газын ерітіп, көмір қышқылын түзеді:H2O + CO2 ↔ H2CO3
Қышкыл ерітіндісі топыраққа сіңіп, жолында әктасының қорын кездестірсе, оны ерітіп, карбонатты гидрокарбонатқа айналдырады. Гидрокарбонат оңай еріп кетеді, нәтижесінде әктасының қалың жынысында үлкен бос кеңістік ("карсты үңгірлер") пайда болады.Кальций гидрокарбонатының ерітіндісі баяу ыдырайды, ал кыздырғанда, бұл процесс күшейе түседі: Са(НСО3)2 =t= CaCO3↓ + Н2О + CО2↑
Слайд 13Кальцийдің химиялық қасиеттерін сипаттайтын мына рекция теңдеулерін аяқтаңыздар.
Са+Cl2 →
Са+S →
Са+Н2
→
Ca+O2 →
Ca+HCl →
Ca+H2O →
Слайд 14ІІ-тапсырма. Карточкамен жұмыс.
1-карточка. Кальций атомынан валенттік элетрондарды кетергеннен кейін пайда
болған бөлшек элетрондық құрылысы жөнінен алғанда қай инертті газдың атомына
және қай галоген ионына ұқсас?Жауабы: инертті газдан аргонға, ал галоген иондарынан хлор ионына ұқсас.
2-каротчка. Кальций атомы кальций ионына айналатын әртүрлі төрт реакция теңдеулерін жазыңдар.
Жауабы. Са + 2Н2О → Са(ОН)2 + Н2
Са + Н2 → СаН2
3Са + N2→ Са3N2
4Са + 10НNО3→ 4Са(NО3)2 + NН4NО3 + 3Н2О
Слайд 153-карточка. Құрылысшылардың сөндірілмеген ізбесті «қайнатпа», ал сөндірілген ізбесті «үлпілдек» деп
атайтын себебі неліктен?
Жауабы. Себебі, сөндірілмеген әк суға салғанда бұрқылдап қайнайды,
ал сөндірілген әк үлпілдек келеді.4-каротчка. Жанып жаткан металл кальцийді су құйып өшіруге болмайтыны неліктен?
Жауабы: Себебі, жанып жатқан кальций сумен әрекеттесіп кальций гидроксидің түзеді.
5-карточка. Кальцийдің: а) тотығатын, б) тотықсызданатынын; в) тотығу дәрежесі өзгермейтін кезіндегі реакция теңдеулерін келтіріңдер.
Жауабы. а) СаСІ2 → Са + СІ2
б) Са + Н2 → СаН2
в) Са О+ Н2О → Са(ОН)2
Слайд 16ІІІ-тапсырма. Тестпен жұмыс.(3-сұрақ)
1. Кальций атомының ядросында қанша протон және нейтрон
бар?
А) 20,20 Б) 25,15 С) 10, 10 Д)
15,15 Е) 10,302. Өндірісте кальцийді алады:
А) ерітінді электролизімен;
В) балқыма электролизімен;
С) пирометаллургиялық әдіспен;
Д) металтермиялық әдіспен .
3. Рет нөмірі 20-ға тең элемент ... элементтер тобына жатады
A) d B) f C) q D) s E) p
Слайд 17ІІІ-тапсырма. Мына өзгерістерді жүзеге асыратын реакция теңдеулерін жаз:
Ca → CaH2
→Ca(OH)2 → Ca(HCO3 )2→ CaCО3 → CaCI2 → Ca3(PО4)2
Шешуі:
Ca +
H2 → CaH2CaH2 + 2H2O → Ca(OH)2 + 2H2↑ сумен тез әр-ді
Ca(OH)2 + 2H2СO3 → Ca(HCO3 )2 + 2H2O
Ca(HCO3 )2 →СaСO3 ↓+ CO2↑ + H2O
СaСO3 + 2HCI →СaСI2 + CO2↑ + H2O
3 СaСI2 + 2Н3PО4 → Ca3(PО4)2 + 6HCI
Слайд 18Ca → CaO → Ca(OH)2 → CaCО3 → Ca(HCO3 )2
→ CО2
Шешуі:
2Ca + O2 → 2CaO
CaO + H2O → Ca(OH)2
Ca(OH)2
+ CО2→ CaCО3 ↓ + H2OCaCО3+ CO2 + H2O→ Ca(HCO3 )2
Ca(HCO3 )2 + Ca(OH)2 →2СaСO3 ↓ + H2O
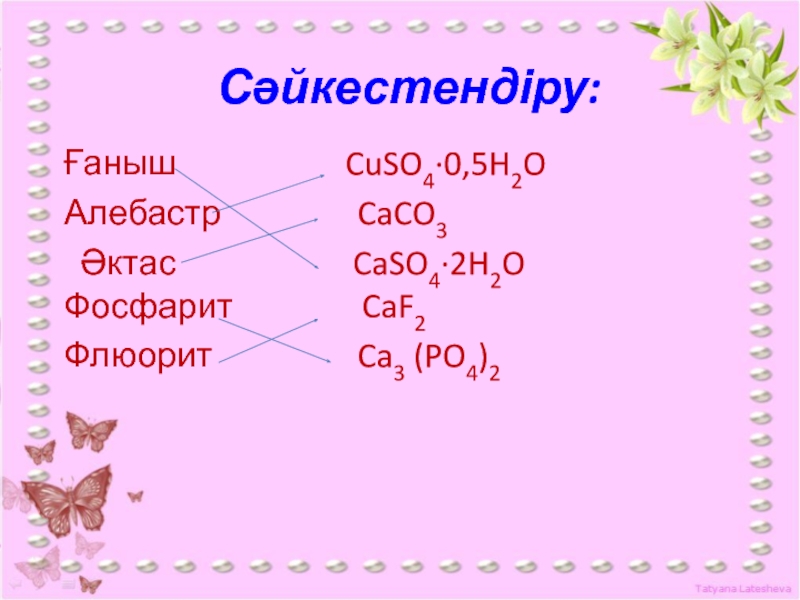
Слайд 19Сәйкестендіру:
Ғаныш
CuSO4·0,5H2O
Алебастр
CaCO3Әктас CaSO4·2H2O Фосфарит CaF2
Флюорит Ca3 (PO4)2