элемента). В химических реакциях не могут разлагаться с образованием других
веществ.Сложные вещества (или химические соединения). Молекулы состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ.
Неорганические вещества
Простые
Металлы
Неметаллы
Сложные
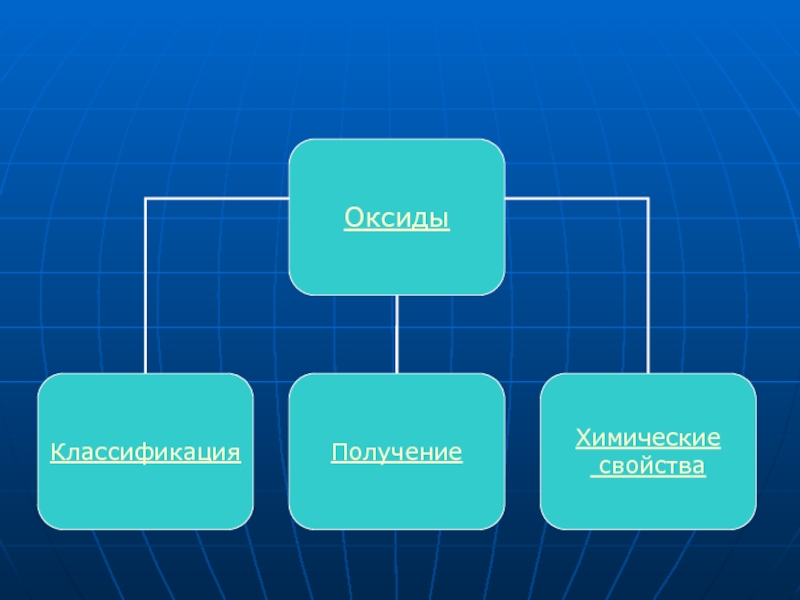
Оксиды
Основания
Кислоты
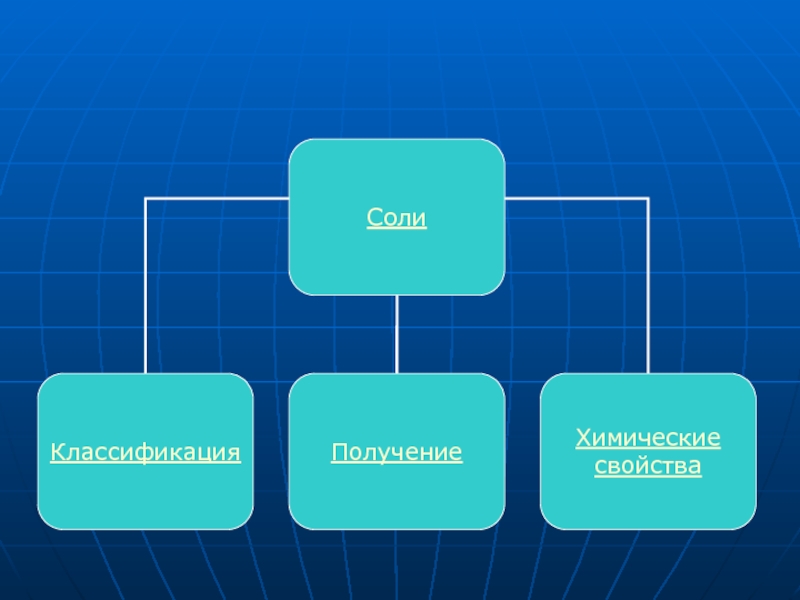
Соли