Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Металлургия
Содержание
- 1. Металлургия
- 2. Нахождение металлов в земной коре Многие
- 3. Железо – второй по распространенности металл. В самородном
- 4. Типы металлосодержащих руд Руды, из которых на
- 5. По виду присутствующих металлсодержащих минералов руды цветных
- 6. Общие принципы извлечения металлов из руд Немногие
- 7. Важнейший способ получения металлов основан на восстановлении
- 8. Кроме пирометаллургических методов, при добывании металлов применяются
- 9. Обогащение руд Обычно руды представляют собой совокупность
- 10. Флотационный метод основан на различной смачиваемости поверхности
- 11. Гидрометаллургия и пирометаллургия – общие подходы и
- 12. Пирометаллургические процессы по характеру поведения участвующих в
- 13. Обжиговые методы получения металлов В цветной металлургии
- 14. Карботермия В том случае, если не предъявляются
- 15. Гидротермия На примере железа:Восстановление железа водородом при температуре выше 570° С происходит по реакции:
- 16. Восстановление железа водородом при температуре ниже 570°
- 17. Металлотермия Металлотермия — восстановление металлов из их
- 18. Электролиз растворов и расплавов металлов Электролиз - это
- 19. Технология доменного процесса. Получение чугуна Сущность доменного
- 20. Слайд 20
- 21. Сама печь представляет собой сооружение с вертикальной
- 22. Выплавка в доменной печи происходит следующим образом:Поданный
- 23. Технология получения сталиСущность процесса получения стали из
- 24. Легированные сталиЛегированными называют стали, в которые специально вводят
- 25. Хром. Содержится от 1,5 до 30%. Повышает
- 26. Технология получения алюминияОсновным сырьем для получения алюминия
- 27. Слайд 27
- 28. Наиболее часто для получения глинозема из руд
- 29. Пульпа из автоклава после фильтрации сливается в
- 30. Технология получения медиСреди способов производства меди из
- 31. Концентрат обжигается в преимущественно окислительной среде, что
- 32. В специальную печь небольшими порциями загружаются медные
- 33. Слайд 33
- 34. Технология получения золота
- 35. Скачать презентанцию
Нахождение металлов в земной коре Многие металлы, находятся в природе в виде соединений. Такие вещества называют минералами. Минералы, пригодные для получения металлов, называют рудами. Многие металлы, находятся в природе в виде соединений.
Слайды и текст этой презентации
Слайд 2Нахождение металлов в земной коре
Многие металлы, находятся в природе
в виде соединений. Такие вещества называют минералами. Минералы, пригодные для получения
металлов, называют рудами. Многие металлы, находятся в природе в виде соединений. Такие вещества называют минералами. Минералы, пригодные для получения металлов, называют рудами.Наиболее распространены в природе оксиды и сульфиды металлов (соединения металлов с кислородом и серой).
Самым распространенным в земной коре металлом является алюминий. Его массовая доля составляет 8,2%. Одним из минералов, содержащим алюминий, является корунд Al2O3.
Оксид алюминия входит в состав некоторых драгоценных камней, например, рубина и сапфира. Алюминий также содержится в глине.
Слайд 3Железо – второй по распространенности металл. В самородном виде встречается крайне
редко: только в составе метеоритных камней. Важнейшие природные соединения железа:
Fe3O4 –
магнитный железнякFe2O3 – красный железняк
Fe2O3·H2O – бурый железняк
FeS2 – пирит
Кальций, натрий, калий, магний – следующие по распространенности металлы в земной коре.
Кальций и магний образуют карбонатные минералы (например, кальцит CaCO3, магнезит MgCO3). Кальций входит в состав гипса. Натрий и калий образуют растворимые в воде минералы. Например, поваренную соль (галит) NaCl, сильвин – KCl, сильвинит KCl·NaCl.
Слайд 4Типы металлосодержащих руд
Руды, из которых на практике извлекают только один
металл, называются простыми или монометаллическими. Примером таких руд и то
достаточно условно в настоящее время могут служить только некоторые сорта железных руд. Все руды цветных металлов, по существу, являются полиметаллическими (или комплексными) и содержат как минимум два извлекаемых металла. Наиболее сложными по химическому (и по минералогическому тоже) составу являются медные, медно-никелевые, медно-цинковые и медно-свинцово-цинковые руды, из которых уже сейчас извлекают до 10 - 15 ценных элементов.Слайд 5По виду присутствующих металлсодержащих минералов руды цветных металлов делят на
следующие основные группы:
сульфидные, содержащие металлы в форме соединений с серой
— сульфидов. К таким рудам в основном относятся медные, медно-цинковые, медно-молибденовые, медно-никелевые и свинцово-цинковые (полиметаллические) руды;окисленные, в которых металлы содержатся в форме различных кислородсодержащих соединений: оксидов, карбонатов, гидроксидов и т.д. Примером таких РУД служат алюминиевые, окисленные никелевые, оловянные, некоторые разновидности медных и редкометалльных руд;
самородные, содержащие металлы в свободном (металлическом) состоянии. В самородном состоянии в природе встречаются золото, серебро, медь, платина, виснут и ртуть;
смешанные, в которых металлы могут одновременно присутствовать в сульфидной и окисленной формах, а иногда и в самородном состоянии (медные руды);
хлоридные, содержащие металлы в форме солей хлористоводородной кислоты. Из таких руд, в частности, извлекают магний, а также ряд других легких и редких металлов.
Сульфидные руды по характеру минерализации делятся, в свою очередь, на сплошные, состоящие почти полностью из сульфидов, и вкрапленные, в которых сульфиды в виде включений размещены в пустой породе.
Слайд 6Общие принципы извлечения металлов из руд
Немногие металлы встречаются в свободном
состоянии, и они называются самородными. Золото и платина встречаются почти
исключительно в самородном виде, а серебро и медь — отчасти; иногда попадаются также самородные ртуть и некоторые другие металлы.Добывание золота и платины производится или посредством механического отделения их от той породы, в которой они заключены, например промывкой водой, или путем извлечения их из породы различными реагентами с последующим выделением из раствора. Все же остальные металлы добываются химической переработкой их природных соединений.
Слайд 7Важнейший способ получения металлов основан на восстановлении их оксидов углем
или СО. Если, например, смешать красную медную руду с углем и
накалить, то уголь, восстанавливая медь, превращается в оксид углерода (II), а медь выделяется в расплавленном состоянии:Выплавка чугуна производится восстановлением железных руд оксидом углерода.
При переработке сульфидных руд сперва переводят сульфиды в оксиды путем обжига в специальных печах, а затем уже восстанавливают полученные оксиды углем. Например:
Слайд 8Кроме пирометаллургических методов, при добывании металлов применяются гидрометаллургические методы. Они
представляют собою извлечение металлов из руд в виде их соединений
водными растворами различных реагентов с последующим выделением металла из раствора.Для металлов, не восстанавливаемых ни углем, ни оксидом углерода (II), применяются более сильные восстановители: водород, магний, алюминий, кремний. Восстановление металла из его оксида с помощью другого металла называется металлотермией.
Наконец, металлы, оксиды которых наиболее прочны (алюминий, магний и другие), получают электролизом.
Слайд 9Обогащение руд
Обычно руды представляют собой совокупность минералов. Минералы, содержащие извлекаемый
металл, называются рудными минералами, все остальные — пустой породой. Последняя
чаще всего состоит из песка, глины, известняка, которые трудно плавятся. Чтобы облегчить выплавку металла, к руде примешивают специальные вещества — флюсы. Флюсы образуют с веществами пустой породы легкоплавкие соединения — шлаки, которые обычно собираются на поверхности расплавленного металла и удаляются. Если пустая порода состоит из известняка, то в качестве флюса применяется песок. Для руд, содержащих большие количества песка, флюсом служит известняк.Во многих рудах количество пустой породы столь велико, что непосредственная выплавка металла из таких руд экономически невыгодна. Такие руды предварительно обогащают — отделяют от них часть пустой породы. В остающемся концентрате содержание рудного минерала повышается.
Существуют различные способы обогащения руд. Чаще других применяются флотационный, гравитационный и магнитный способы.
Слайд 10Флотационный метод основан на различной смачиваемости поверхности минералов водою. Тонкоизмельченную
руду обрабатывают водой, к которой добавлено небольшое количество флотационного реагента,
усиливающего различие в смачиваемости частиц рудного минерала и пустой породы. Через образующуюся смесь энергично продувают воздух; при этом его пузырьки прилипают к зернам тех минералов, которые хуже смачиваются. Эти минералы выносятся вместе с пузырьками воздуха на поверхность и таким образом отделяются от пустой породы.Гравитационное обогащение основано на различии плотности и вследствие этого скорости падения зерен минералов в жидкости.
Магнитный способ основан на разделении минералов по их магнитным свойствам.
Слайд 11Гидрометаллургия и пирометаллургия – общие подходы и области применения, плюсы
и минусы
Гидрометаллургия — извлечение металлов из сырья с использованием химических реакций в
водных растворах. Гидрометаллургия включает три следующих основных процесса: переведение ценных металлов в раствор, переработку растворов и выделение из очищенных растворов металлов или нерастворимых соединений.Гидрометаллургические методы пригодны для извлечения металлов из сырья с низкими концентрациями металла и не поддающегося переработке традиционными методами. К достоинствам гидрометаллургии относится также возможность разделения близких по свойствам металлов (Zr и Hf, Nb и Та и др.), упрощение переработки по сравнению с пирометаллургией. Применение гидрометаллургических методов во многих случаях существенно снижает загрязнение окружающей среды вредными отходами.
Один из недостатков гидрометаллургии — относительно большой расход воды на единицу продукции.
Слайд 12Пирометаллургические процессы по характеру поведения участвующих в процессе компонентов и
их конечным результатам можно разделить на три группы: обжиг, плавка
и дистилляция.Обжиг – металлургический процесс, проводимый при высоких температурах (500-1200°С) с целью изменения химического состава перерабатываемого сырья.
Плавка – пирометаллургический процесс, проводимый при температурах, обеспечивающих в большинстве случаев полное расплавление перерабатываемого материала.
Дистилляционные процессы – процессы испарения вещества при температуре несколько выше точки его кипения. Дистилляция с целью рафинирования называется ректификацией.
Важное направление совершенствования пирометаллургических процессов – снижение их вредного воздействия на окружающую среду, связанное с внедрением безотходных технологий, с сокращением и обезвреживанием отходов и выбросов.
Слайд 13Обжиговые методы получения металлов
В цветной металлургии чаще всего применяют следующие
виды обжига: кальцинирующий, окислительный и восстановительный.
окислительный обжиг приводит к получению оксидов или сульфатов (сульфатизирующий обжиг)
при взаимодействии сульфидных материалов с кислородом воздуха;восстановительный обжиг применяется для получения низших оксидов или металлов путем взаимодействия исходных материалов с углем или другими восстановителями;
кальцинирующий обжиг используют для получения оксидов металлов из их гидратов, карбонатов или других соединений, разлагающихся при высокой температуре.
Слайд 14Карботермия
В том случае, если не предъявляются особые требования к чистоте
получаемого металла, восстановителем может быть углерод или CO (карботермия). Углерод
применяется при восстановлении железа из Fe2O3 или Fe3O4 (доменный процесс), олова из касситерита, меди из куприта:SnO2 + C = Sn + CO2
2Cu2O + C = 4Cu +CO2
Слайд 15Гидротермия
На примере железа:
Восстановление железа водородом при температуре выше 570° С
происходит по реакции:
Слайд 16Восстановление железа водородом при температуре ниже 570° С:
Гематит Fe2O3 превращается
в магнетит Fe3O4 при любом содержании водорода в смеси H2—H2O
(а вернее, при отсутствии свободного кислорода).Слайд 17Металлотермия
Металлотермия — восстановление металлов из их соединений (оксидов и т.
д.) более активными металлами: алюминием, кальцием, магнием и др. Металлотермические процессы протекают при
повышенных температурах, с выделением теплоты.Металлотермические способы производства металлов более дороги, чем обычная углевосстановительная металлургия (карботермия). Поэтому они используются для получения лишь тех металлов и сплавов, восстановление которых углеродом или невозможно, или приводит к недопустимому загрязнению продукта углеродом и карбидами. Методами металлотермии получают титан в виде губки, другие чистые металлы, некоторые сплавы.
Выбор металла-восстановителя определяется многими условиями. Необходимо, чтобы он не образовывал с восстанавливаемым металлом сплавов и соединений, а избыток восстановителя и шлак легко отделялись от восстанавливаемого металла. Иначе чистого металла не получится. Кроме того, стоимость полученного продукта должна оправдывать расходы на восстановитель, особенно в случаях многотоннажного производства.
Слайд 18Электролиз растворов и расплавов металлов
Электролиз - это окислительно-восстановительный процесс, который происходит
на электродах во время прохождения электрического тока через расплав или
раствор.Различают электролиз растворов и электролиз расплавов. Оба эти процесса существенно отличаются друг от друга. Отличие - в наличии растворителя. При электролизе растворов кроме ионов самого вещества в процессе участвуют ионы растворителя. При электролизе расплавов - только ионы самого вещества.
Электролиз водных растворов солей металлов применяется как для получения покрытий на металлах, так и для получения самих металлов. В значительных количествах этим методом получают порошкообразное железо, медь, кобальт и некоторые другие металлы, используемые в порошковой металлургии. Для получения железа применяют ванну, содержащую хлориды двух- и трехвалентного железа, и электролиз ведут при катодной плотности тока в 10—20 А/дм2 при температуре 90°. В качестве катода используют листы хромированного железа, в качестве анода — чистое железо. После электролиза катоды вынимают из ванн, железо соскребывают, сушат и размалывают.
В промышленности применяют также электролиз расплавов солей. При этом в зависимости от соотношения плотностей получаемого металла и электролита, металл всплывает на поверхность или опускается на дно электролизера. Этим методом получат щелочные металлы, бериллий, магний, кальций, алюминий, тантал.
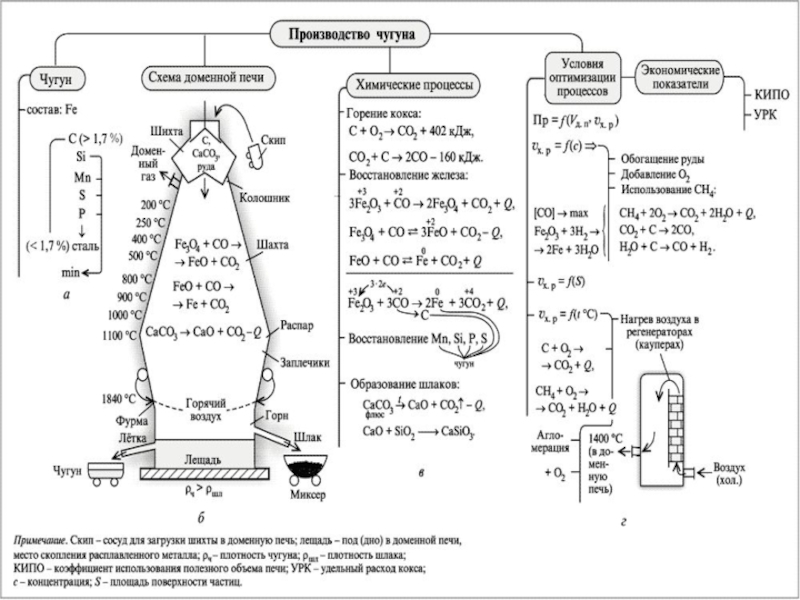
Слайд 19Технология доменного процесса. Получение чугуна
Сущность доменного процесса получения чугуна заключается в восстановлении
оксидов железа, входящих в состав руды, оксидом углерода, водородом и твердым
углеродом, выделяющимися при сгорании топлива в доменной печи.Восстановления оксидов железа проходит по схеме:
Fe2O3 → Fe3O4 → FeO → Fe.
Слайд 21Сама печь представляет собой сооружение с вертикальной рабочей камерой, внутренняя
поверхность которой выложена огнеупорным кирпичом.
Шихта – сырьё для плавки, подаётся
в верхнюю часть доменной печи, называемую колошником.Колошник оснащён газоотводами, через которые из доменной печи удаляется смесь из колошниковых газов и шихтовой пыли, скопившихся во время плавки. Затем смесь сепарируется, и пыль уходит в агломерацию, снова попадая в шихту, а газ применяется для использования на вспомогательных производствах.
Основная часть рабочей камеры – шахта, выполнена в виде усеченного конуса, расположенного основанием вниз.
Под шахтой расположена ёмкость цилиндрической формы – распар. В распаре происходит расплавление шихты, он опирается на столбы, которые укреплены непосредственно в фундаменте доменной печи.
Под распаром находится ещё одна ёмкость цилиндрической формы – горн. В верхней части горна имеется летка для выпуска шлака, а в нижней – летка для выпуска чугуна. Через летки во время плавки периодически происходит вывод чугуна и шлака из доменной печи.
Выше шлаковой летки расположены отверстия – фурмы, через которые производится подача кислорода, нагретого воздуха и прочих добавок.
Слайд 22Выплавка в доменной печи происходит следующим образом:
Поданный через фурмы кислород
вступает в реакцию с содержащимся в шихте углеродом, температура горения
при этом составляет до 2000 градусов.Расплавленное железо, освобожденное от сгоревшего углерода, скапливается в переходной камере конусообразной формы между горном и распаром – заплечиках. Здесь часть выделившегося из шихты углерода соединяется с железом, науглероживая его. Здесь же с железом соединяются освобожденные из шихты марганец с кремнием, сера, фосфор и другие элементы.
Образовавшийся таким образом чугун стекает из заплечиков в горн, а расплавленный шлак скапливается над ним.
Чугун и шлак выпускаются из доменной печи через соответствующие летки.
Из летки расплавленный чугун, температура которого при этом составляет около 1500 градусов, по желобу попадает в раздаточный ковш.
Слайд 23Технология получения стали
Сущность процесса получения стали из чугуна заключается в
уменьшении содержания углерода в металле и возможно полном удалении вредных
примесей: серы и фосфора. Это достигается окислительной плавкой, при которой удаляемые из чугуна примеси переходят в соединения, нерастворимые в металле.Применяются следующие основные способы передела чугуна в сталь: мартеновский, бессемеровский и томасовский, различающиеся методами окисления.
В мартеновском способе для окисления углерода и других примесей применяются твёрдые окислители (руда, окалина, скрапметаллический лом, обрезки, отходы металлообрабатывающей промышленности) специально добавляемые в шихту, и кислород, содержащийся в газах, обогревающих печь.
В бессемеровском и томасовском способах окисление осуществляется кислородом воздуха, продуваемого через расплавленный металл.
Слайд 24Легированные стали
Легированными называют стали, в которые специально вводят те или иные
химические элементы (хром, никель, кобальт, молибден, титан, вольфрам и др.).
Эти элементы вводят с целью воздействия на структуру и получения требуемых свойств.Легирование сталей и сплавов используют для улучшения их технологических свойств. Легированием можно повысить предел текучести, ударную вязкость, относительное сужение и прокаливаемость, а также существенно снизить скорость закалки, порог хладноломкости, деформируемость изделий и возможность образования трещин.
Слайд 25Хром. Содержится от 1,5 до 30%. Повышает твердость и прочность,
незначительно снижает ударную вязкость и пластичность.
Никель. Как и хром, повышает
твердость и жесткость стали. При содержании более 1% начинает оказывать антикоррозионное действие. Наиболее коррозионностойкие стали содержат одновременно никель и хром.Вольфрам. Одна из самых ценных и важных добавок к стали. Вольфрам способствует повышению твердости, при этом повышается красностойкость, то есть, способность материала сохранять твердость при высоких температурах.
Молибден. Как и хром, повышает прочность и антикоррозионные свойства, жаростойкость и предел прочности на растяжение. В виду более низкой химической активности, чем железо, при значительной величине координационных связей, повышает сопротивление окислению при высоких температурах.
Кобальт. Представляет собой яркий пример влияния электронов предвнешнего электронного слоя на свойства легируемого сплава. За счет образования координационных связей вокруг атомов кобальта, происходит уплотнение структуры металла и дополнительная сшивка решетки. Это приводит к повышению жаропрочности и увеличению сопротивления ударным нагрузкам. Также улучшает намагничиваемость стали.
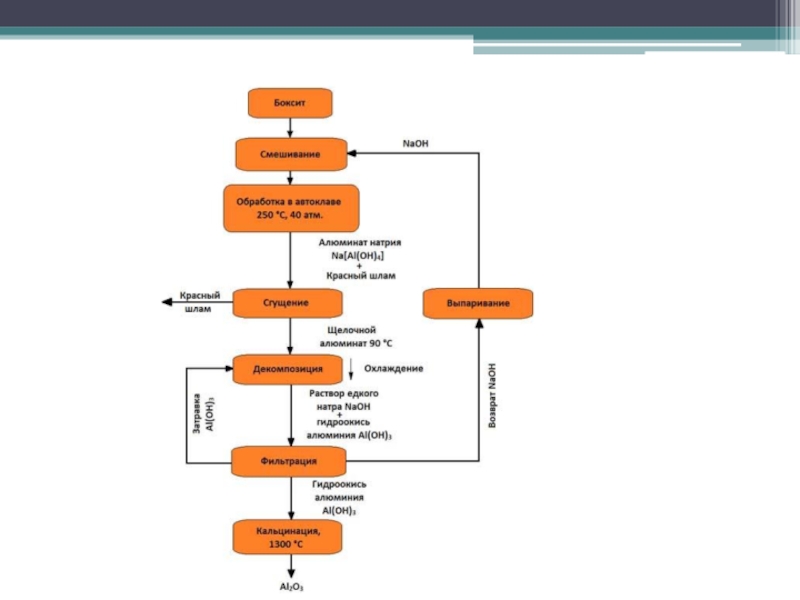
Слайд 26Технология получения алюминия
Основным сырьем для получения алюминия служат бокситы, представляющие
собой гидраты глинозема Al2O3•nH2O в смеси с оксидами железа, титана,
кремния и других элементов. Лучшие бокситы содержат около 60% Al2O3.Технологический процесс получения алюминия состоит из двух основных самостоятельных этапов – производство глинозема Al2O3 и получение из него алюминия. Способы восстановления алюминия непосредственно из бокситов и других руд пока не разработаны.
Слайд 28Наиболее часто для получения глинозема из руд используют так называемый
метод выщелачивания. С этой целью обезвоженный при температуре около 200оС
боксит измельчают в шаровых мельницах, смешивают с содой и спекают, вследствие чего получают растворимый в воде алюминат натрия. Реакция спекания протекает по уравнениюAl2O3 + Na2CO3 = Al2O3•Na2O + CO2.
Выщелачивание производится в специальных автоклавах при температуре около 250оС и высоком давлении. Автоклавы представляют собой герметически закрывающиеся стальные сосуды цилиндрической формы диаметром около 2 метров и высотой до 12 метров.
Образовавшийся алюминат натрия хорошо растворяется в воде и переходит в раствор. Оксиды железа, кремния, титана и другие примеси боксита, которые не растворяются в воде, выпадают в осадок и образуют так называемый красный шлам. Полученный раствор алюмината натрия Al2O3•Na2O в виде пульпы поступает на дальнейшую обработку.
Слайд 29Пульпа из автоклава после фильтрации сливается в цилиндрические баки –
отстойники, где при длительном и медленном перемешивании из раствора выпадает
осадок гидроокиси алюминия Al(OH)3. Для ускорения процесса в отстойник вводится затравка – кристаллическая гидроокись алюминия, играющая роль катализатора. В результате идет выпадение осадка по реакции:Al2O3• Na2O +4Н2О = 2Al(OH)3 + NaOH
Полученный осадок тщательно промывают, фильтруют и прокаливают. С этой целью используются наклонные вращающиеся печи, в которых засыпанная гидроокись постепенно перемещается в зону высоких температур (до 1200оС). В результате прокаливания образуется чистый глинозем Al2O3 по реакции:
2Al(OH)3 = Al2O3 + Н2О
Выход глинозема составляет около 85% от его содержания в боксите.
Слайд 30Технология получения меди
Среди способов производства меди из руд с концентратами
выделяют пирометаллургический метод и гидрометаллургический. Последний не получил широкого распространения.
Это продиктовано невозможностью одновременного с медью восстановления прочих металлов. Он используется для обработки окисленной или самородной руды с бедным содержанием меди. Отличаясь от него, пирометаллургический способ позволяет разработку любого сырья с извлечением всех компонентов. Очень эффективен он для подвергающихся обогащению руд.Основной операцией такого процесса производства меди служит плавка. При ее производстве используют медные руды или их обожженные концентраты. В ходе подготовки к данной операции схемой производства меди предусмотрено их обогащение способом флотации. При этом руды, содержащие наряду с медью ценные элементы: теллур или селен, золото с серебром, стоит обогащать в целях одновременного перехода данных элементов в медный концентрат. Образованный таким методом концентрат может содержать до 35% меди, столько же железа, до 50% серы, а также пустую породу. Обжигу он подвергается в целях снижения до приемлемого содержания в нем серы.
Слайд 31Концентрат обжигается в преимущественно окислительной среде, что позволяет удалить примерно
половины содержания серы. Полученный таким образом концентрат при переплавке дает
довольно содержательный штейн. Еще обжиг помогает снизить вдвое расход топлива отражательной печью. Достигается это при качественном смешении состава шихты, обеспечивающем ее нагревание до 600ºС. Но богатые медью концентраты лучше перерабатывать, не обжигая, так как после этого возрастают утраты меди с пылью и в шлаке.Итогом такой последовательности производства меди является деление объема расплава надвое: на штейн-сплав и шлак-сплав. Первую жидкость, как правило, составляют медные сульфиды и железные, вторую – окислы кремния, железа, алюминия и кальция. Переработку концентратов в сплав штейн ведут при помощи электрической либо отражательной печей различных видов. Чисто медные либо сернистые руды лучше плавить с помощью шахтных печей. К последним также стоит применить медно-серное плавление, позволяющее улавливать газы, одновременно извлекая серу.
Слайд 32В специальную печь небольшими порциями загружаются медные руды с кокс,
а также известняки и оборотные продукты. Верхняя часть печи создает
восстановительную атмосферу, нижняя часть – окислительную. По мере расплавления нижнего слоя масса медленно спускается вниз для встречи с разогретыми газами. Верхняя часть печи нагрета до 450ºС, а температура отходящих газов составляет 1500ºС. Это необходимо при создании условий очищения от пыли еще до того, как начнется выделение паров с серой.В результате такой плавки получают штейн, включающий от 8 до 15% меди, шлак, главным образом содержащий известь с железным силикатом, а еще колошниковый газ. Из последнего после предварительного осаждения пыли удаляют серу. Задача увеличения в штейн-сплаве процента Cu при производстве меди в мире решается применением сократительной плавки. Она заключается в помещении в печь наряду со штейном кокса, флюса из кварца, известняка.
При нагревании смеси происходит процесс восстановления медных окисей и железных оксидов. Сплавляемые друг с другом железные и медные сульфиды составляют штейн первоначальный. Расплавляемый железный силикат при стекании вдоль поверхностей откосов принимают в себя прочие компоненты, пополняя шлак. Результатом такой плавки является получение обогащенного штейна со шлаком, включающих медь до 40% и 0,8% соответственно. Драгоценные металлы, такие как серебро с золотом, почти не растворяясь в сплаве шлака, целиком оказываются в сплаве штейна.
Теги