Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Неметаллы
Содержание
- 1. Неметаллы
- 2. Неметаллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы.
- 3. Нахождение в природе N o22s
- 4. Са5[PO4]3(F, Cl, ОН) АПАТИТ АметистSiO2
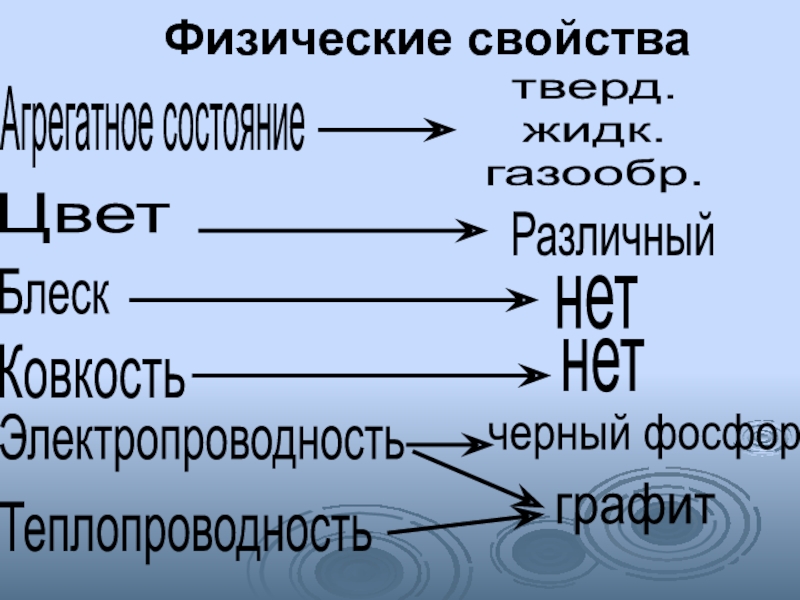
- 5. Физические свойстваАгрегатное состояниетверд.жидк.газообр.ЦветРазличныйБлескнетнетКовкость Электропроводностьчерный фосфорграфитТеплопроводность
- 6. Взаимодействие с металлами: 2Na + Cl2 = 2NaCl,Fe
- 7. Взаимодействие с другими неметаллами: взаимодействуя с водородом, большинство
- 8. при взаимодействии с фтором фтор является окислителем, а
- 9. Получение неметаллов Способы получения неметаллов отличаются многообразием
- 10. Получение водорода. Основной промышленный способ получения водорода
- 11. Кислород и азот получают фракционной перегонкой жидкого
- 12. Применение неметаллов Водород используется в химической промышленности
- 13. Сера используется для производства серной кислоты,
- 14. Скачать презентанцию
Неметаллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы.
Слайды и текст этой презентации
Слайд 2
Неметаллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний
угол Периодической системы.
Слайд 5 Физические свойства
Агрегатное состояние
тверд.
жидк.
газообр.
Цвет
Различный
Блеск
нет
нет
Ковкость
Электропроводность
черный фосфор
графит
Теплопроводность
Слайд 6Взаимодействие с металлами:
2Na + Cl2 = 2NaCl,
Fe + S = FeS,
6Li
+ N2 = 2Li3N,
2Ca + O2 = 2CaO
В этих случаях
неметаллы проявляют окислительные свойства, они принимают электроны, образуя отрицательно заряженные частицы.Слайд 7Взаимодействие с другими неметаллами:
взаимодействуя с водородом, большинство неметаллов проявляет окислительные
свойства, образуя летучие водородные соединения – ковалентные гидриды:
3H2 +
N2 = 2NH3,H2 + Br2 = 2HBr;
взаимодействуя с кислородом , все неметаллы, кроме фтора, проявляют восстановительные свойства:
S + O2 = SO2,
4P + 5O2 = 2P2O5;
Слайд 8
при взаимодействии с фтором фтор является окислителем, а кислород – восстановителем:
2F2 + O2 = 2OF2;
неметаллы взаимодействуют между собой, более электроотрицательный металл играет
роль окислителя:S + 3F2 = SF6,
C + 2Cl2 = CCl4.
Слайд 9Получение неметаллов
Способы получения неметаллов отличаются многообразием и специфичностью, общих подходов
не существует. Рассмотрим основные способы получения некоторых неметаллов.
Получение галогенов. Самые активные
галогены – фтор и хлор – получают электролизом. Фтор – электролизом расплава KHF2, хлор – электролизом расплава или раствора хлорида натрия.Другие галогены можно также получить электролизом или вытеснением из их солей в растворе с помощью более активного галогена:
Cl2 + 2NaI = 2NaCl + I2.
Слайд 10
Получение водорода. Основной промышленный способ получения водорода – конверсия метана
(каталитический процесс):
CH4 +
H2O = CO + 3H2.Получение кремния. Кремний получают восстановлением коксом из кремнезема:
SiO2 + 2C = Si + 2CO.
Получение фосфора. Фосфор получают восстановлением из фосфата кальция, который входит в состав апатита и фосфорита:
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P+5CO.
Слайд 11
Кислород и азот получают фракционной перегонкой жидкого воздуха.
Сера и углерод встречаются
в природе в самородном виде.
Селен и теллур получают из отходов производства
серной кислоты, так как эти элементы встречаются в природе вместе с соединениями серы.Мышьяк получают из мышьяковистого колчедана по сложной схеме превращений, включающей стадии получения оксида и восстановления из оксида углеродом.
Бор получают восстановлением оксида бора магнием.
Слайд 12Применение неметаллов
Водород используется в химической промышленности для синтеза аммиака,
хлороводорода и метанола, применяется для гидрогенизации жиров.
Водород используется в
химической промышленности для синтеза аммиака, хлороводорода и метанола, применяется для гидрогенизации жиров. Бром и йод используют в синтезе полимерных материалов, для приготовления лекарственных препаратов и др.
Кислород применяется при сжигании топлива, при выплавке чугуна и стали, для сварки металлов, необходим для жизнедеятельности организмов
Слайд 13
Сера используется для производства серной кислоты, изготовления спичек, пороха,
для борьбы с вредителями сельского хозяйства и лечения некоторых болезней,
в производстве красителей, взрывчатых веществ, люминофоров.Азот и фосфор применяются при производстве минеральных удобрений, азот применяется при синтезе аммиака, для создания инертной атмосферы в лампах, используется в медицине. Фосфор применяется при производстве фосфорной кислоты.



![Неметаллы Са5[PO4]3(F, Cl, ОН) АПАТИТ АметистSiO2 Са5[PO4]3(F, Cl, ОН) АПАТИТ АметистSiO2](/img/tmb/2/177845/6b0532e1c789784fed417781b3f6424e-800x.jpg)