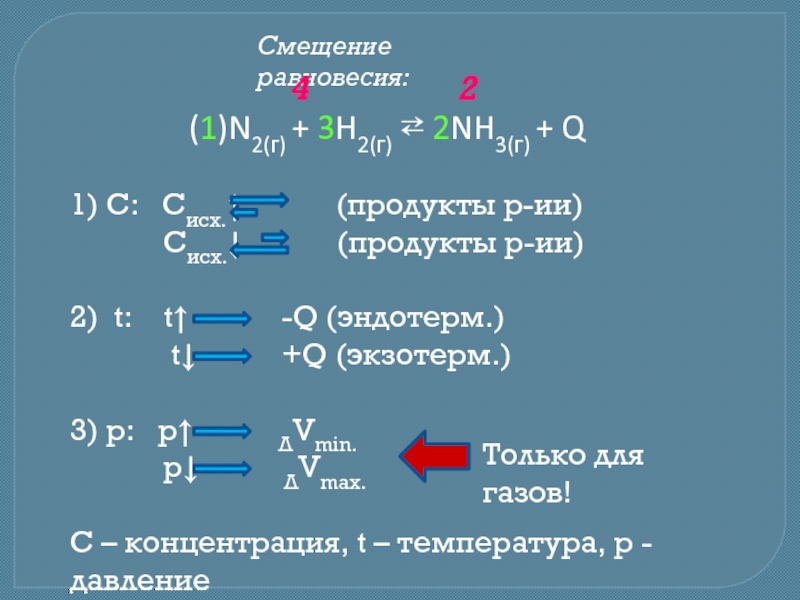
Ле-Шателье и в современной трактовке выглядит следующим образом:
Общий принцип смещения
равновесия (принцип Ле-Шателье):Если на равновесную систему оказать внешнее воздействие, то равновесие сместится так, чтобы уменьшить влияние этого воздействия.