Слайд 2Строение атома цинка
а) Формула состава атома цинка
Согласно
планетарной модели, предложенной ан -
глийским физиком Резерфордом, атом состоит из
положительно
заряжен -
ного ядра и окружаю -
щей электронной обо -
лочки, заряженной от -
рицательно.
Слайд 3 Ядро атома в свою очередь состоит из
элементар –
ных частиц двух видов: протонов и нейтронов. Протон
имеет заряд
(+1) и массу 1 ( р+). Нейтрон, как и протон,
имеет массу 1, но заряда не имеет (n0).
Слайд 4Электрон ( е -) имеет заряд (-1) и очень маленькую
массу
(1/1840). Следовательно, масса атома (А) со –
средоточена в ядре и
численно равна сумме числа
протонов (Z) и нейтронов (N), или А=Z+N.
Так как атом – электронейтральная частица, об –
щее число электронов в его электронной оболочке
равно числу протонов в ядре атома.
Таким образом, формула состава атома цинка имеет вид:
Слайд 5 б) Электронная формула атома цинка
Электроны в атоме
обладают неодинаковой энерги -
ей и в соответствии со своей энергией
располагаются
на различном расстоянии от ядра, образуя электронные
слои или энергетические уровни. Максимальное число
электронов на энергетическом уровне можно опреде –
лить как , где n – номер энергетического уровня.
Тогда электронная оболочка атома цинка состоит из 4-х энергетических уровней со следующим разме –
щением на них 30 электронов:
Слайд 6Такая запись схемы распределения электронов явля -
ется упрощенной, т.к. она
не отражает состояние
электрона в атоме и характер его движения.
Обладая различной энергией, электроны в пределах
одного и того же энергетического уровня размещаются
на различных подуровнях, называемых s, p, d, f - под -
уровнями или s, p, d, f – орбиталями, а электроны на
этих орбиталях – s, p, d, f – электронами.
С учетом состояния электрона полную электрон –
ную формулу атома цинка можно представить так:
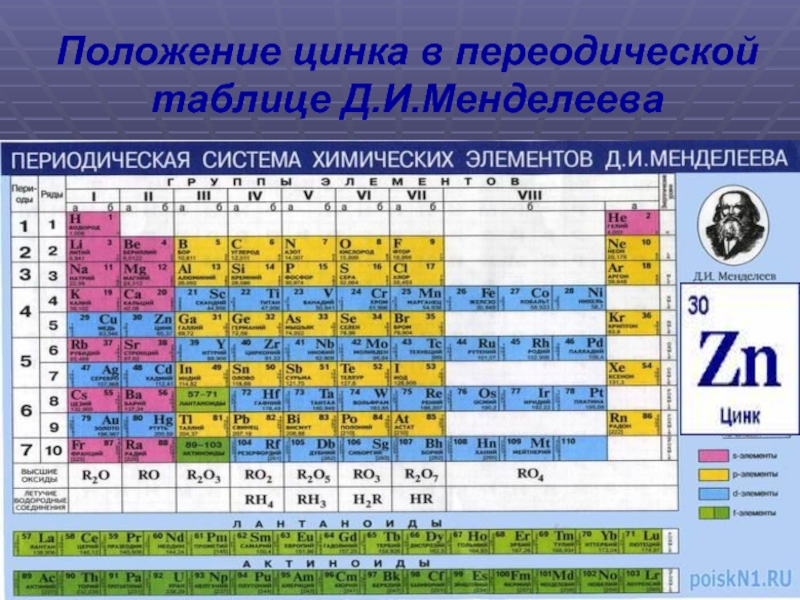
Слайд 7Положение цинка в переодической таблице Д.И.Менделеева
Слайд 8- Порядковый номер выражающий заряд ядра атома
Zn, т.е. число протонов или число электронов в
атоме, – 30.
- Номер периода, показывающий число энергетиче –
ских уровней, – 4.
- Группа, выражающая число электронов на внешнем
энергетическом уровне ( валентных электронов )
побочная группа II – группы ( II Б – группа).
- Относительная атомная масса ( А) – 65,37.
Слайд 9Физические свойства цинка
Металлический цинк обладает характерным голубоватым блеском на свежей
поверхности, который он быстро теряет во влажном воздухе. Температура плавления
419,58° С, температура кипения 906,2° С, плотность 7,133 г/см3. При комнатной температуре цинк хрупок, при 100–150° С становится пластичным и легко прокатывается в тонкие листы и проволоку, а при 200–250° С вновь становится очень хрупким и его можно быть истолочь в порошок
Слайд 10Химические свойства цинка
Цинк – химически активный металл. Он
проявляет
только восстановительные свойства. Обладая на внеш-
нем энергетическом уровне двумя валентными
элек –
тронами, во всех своих соединениях цинк имеет сте –
пень окисления (+ 2).
По химической активности цинк уступает щелоч –
ным и щелочноземельным металлам. Так, с простыми
веществами-неметаллами он реагирует только при на –
гревании:
2 Zn + O2
= 2 ZnO
Zn + Cl2 = ZnCl2
Zn + S = ZnS,
а с водой – только в раскаленном виде:
Zn + H2O = ZnO + H2
При обычных условиях эти реакции не идут, т.к. по –
верхность цинка на воздухе покрывается тонкой за –
щитной пленкой оксида.
Цинк вступает в реакции со сложными веществами:
с кислотами и основаниями.
Слайд 12 а) При взаимодействии цинка с кислотой ход реакции
зависит от концентрации кислоты. Например, из раз –бавленной серной кислоты
цинк, стоящий в ряду ак –
тивности металлов до водорода, легко вытесняет его
в ходе реакции. Окислителями в этих условиях явля –
ются ионы водорода:
Zn + H2SO4 = ZnSO4 + H2
Zn0 + 2H+ + SO42- = Zn2++ SO42- + H2
Zn0 + 2H+ = Zn2+ + H2
Слайд 13 При взаимодействии цинка с концентрированной
серной кислотой окислителем является
сера со сте –
пенью окисления (+6). Реакция идет только при
на –
гревании:
б) В отличие от типичных металлов I- и II-групп
переодической таблицы цинк может взаимодейство –
вать с основаниями в твердом виде ( при нагревании)
или в водном растворе, образуя соль или комплексное
соединение:
Слайд 14 Zn0 + 2Na+1OH = Na2ZnO2
+ H2↑
Zn0 + 2NaOH + 2H2+1O = Na2[ Zn(OH4)]
+ H2↑
В приведенных реакциях цинка с кислотами и основа -
ниями выражена двойственная природа цинка как
элемента побочной подгруппы переодической системы,
способного образовать амфотерные оксид и гидроксид.
Слайд 15Амфотерные соединения цинка
Гидроксид цинка Zn(OH)2 представляет собой не
-
растворимое в воде кристаллическое или аморфное
вещество белого цвета. Он обычно
выпадает в осадок
при взаимодействии соли цинка с щелочью:
ZnSO4 + 2NaOH = Zn(OH)2↓+ Na2SO4.
Однако осадок легко растворяется в растворе щелочи
или кислоты, проявляя характерные для гидроксида
цинка амфотерные свойства: реагировать с кислотой
.
Слайд 16Реагировать с кислотой как основание, а с основанием
как кислота, т.е.
формулу гидроксида цинка можно
представить двояко:
Zn(OH)2 = H2ZnO2
Тогда уравнения реакций гидроксида цинка с кис -
лотой и с щелочью можно записать так:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Слайд 17 H2ZnO2 + 2NaOH = Na2ZnO2 + 2H2O
В обоих случаях образуются растворимые соли:
хлорид цинка и цинкат
натрия.
Оксид цинка ZnO – это белые шелковистые блестя –
щие иглы или призмы, которые можно получить, на –
пример, окислением цинка на воздухе при нагревании,
как было показано ранее.
Аналогично гидроксиду оксид цинка также прояв –
ляет амфотерный характер – образует растворимые в
Воде соли при взаимодействии как с кислотами, про –
Слайд 18являя себя в роли основного оксида:
ZnO + 2HCl = ZnCl2 + H2O
Так и с
основаниями, выступая в качестве кислотного
Оксида:
ZnO + 2KOH = K2ZnO2 +H2O.
Слайд 19Нахождение цинка в природе и его получение
Цинк в
природе встречается только в составе соеди -
нений цинковых руд, например,цинковая
обманка ZnS,
цинковый шпат ZnCO3, цинкит ZnO. Массовая доля
цинка в земной коре составляет 0,005%.
Для получения цинка его руды подвергают обжигу:
2ZnS + 3O2 = 2ZnO + 2SO2↑
ZnCO3 = ZnO + CO2↑
Слайд 20Далее оксид цинка при нагревании восстанавливают
Углем:
ZnO + C
= Zn + CO↑
Слайд 21Применение цинка и его соединений
Ввиду того, что
на цинк при обычных условиях не
действует ни кислород воздуха, ни
вода, большая часть
цинка расходуется на защитные от коррозии покрытия
железных листов, стальных и чугунных изделий, а
также для получения специальных сплавов с повы –
шенной антикоррозионной активностью, для произ –
водства цинково-угольных
гальванических элементов
в батареях разного назна –
чения.
Оксид цинка применяют
в производстве красок
Слайд 22(цинковых белил) и как полупроводниковый материал, а в медицине и
косметике – как мазь, шампунь.
Сульфат цинка применяют
в качестве электролита
при получении цинковых покрытий и как микроудо –
брение в сельском хозяйстве.