Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основания
Содержание
- 1. Основания
- 2. Основания – это сложные вещества, состоящиеиз атома
- 3. Классификация основанийРастворимые в воде (щёлочи)NaOH, LiOH, KOH, Ca(OH)2, Sr(OH)2Нерастворимые в водеCu(OH)2, Fe(OH)2,Ni(OH)2
- 4. Получение основанийПолучение растворимых оснований.взаимодействие щелочных и щелочноземельных
- 5. Свойства растворимых основанийВзаимодействие с кислотами (реакция нейтрализации)KOH
- 6. 2KOH + SO2 = K2SO3 + H2O
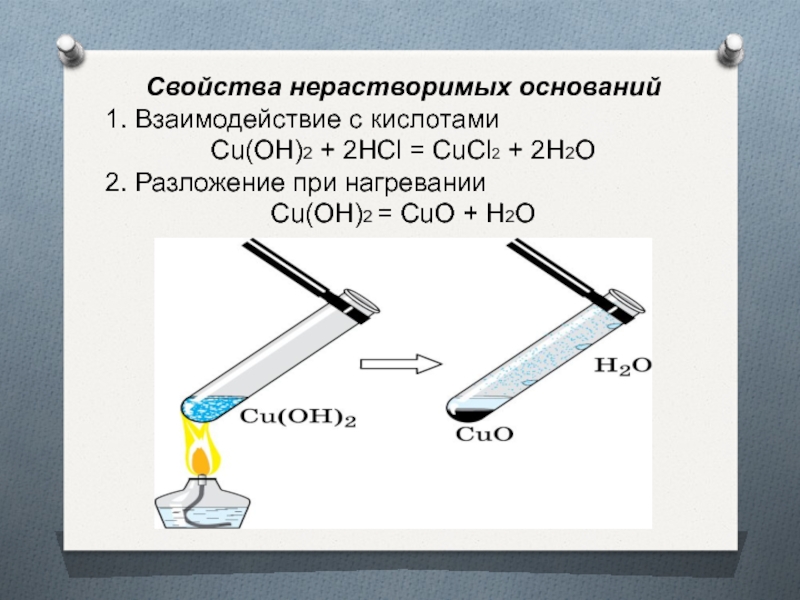
- 7. Свойства нерастворимых оснований1. Взаимодействие с кислотамиCu(OH)2 +
- 8. Выполните заданияРаспределите основания на две группы: растворимые
- 9. Литература и интернет-источникиРазложение гидроксида меди (II); взаимодействие оксида серы (IV) с гидроксидом калияhttp://cdapps.drofa.ru/chemistry_8_fragment/Chapter40.xhtml
- 10. Скачать презентанцию
Основания – это сложные вещества, состоящиеиз атома металла и одной или нескольких гидроксогрупп ОН.NaOH – гидросксид натрияCaOH – гидроксид кальцияAl(OH)3 – гидроксид алюминия
Слайды и текст этой презентации
Слайд 2Основания – это сложные вещества, состоящие
из атома металла и одной
или нескольких
– гидроксид алюминияСлайд 3Классификация оснований
Растворимые в воде
(щёлочи)
NaOH, LiOH, KOH,
Ca(OH)2, Sr(OH)2
Нерастворимые в
воде
Cu(OH)2, Fe(OH)2,
Ni(OH)2
Слайд 4Получение оснований
Получение растворимых оснований.
взаимодействие щелочных и щелочноземельных металлов с водой.
2 Na + 2H2O = 2 NaOH +
H2взаимодействие оксидов щелочных и щелочноземельных металлов с водой.
СаО + Н2О = Са(ОН)2
2. Получение нерастворимых оснований.
взаимодействие растворимых солей с растворимыми основаниями.
CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
Слайд 5Свойства растворимых оснований
Взаимодействие с кислотами (реакция нейтрализации)
KOH + HCl =
KCl + H2O
2. Взаимодействие с кислотными оксидами
Ca(OH)2 + CO2 =
CaCO3 + H2O3. Взаимодействиие с растворами солей, если образуется осадок
FeCl2 + 2KOH = Fe(OH)2 + 2KCl
Слайд 7Свойства нерастворимых оснований
1. Взаимодействие с кислотами
Cu(OH)2 + 2HCl = CuCl2
+ 2H2O
2. Разложение при нагревании
Cu(OH)2 = CuO + H2O
Слайд 8Выполните задания
Распределите основания на две группы: растворимые и нерастворимые
CsOH, Mg(OH)2,
Al(OH)3, Ba(OH)2, RbOH
2. Запишите уравнения реакций взаимодействия между:
гидроксидом алюминия и
серной кислотой, соляной кислотой, азотной кислотой;гидроксидом натрия и оксидом фосфора (V), кремниевой кислотой, сульфатом меди (II)