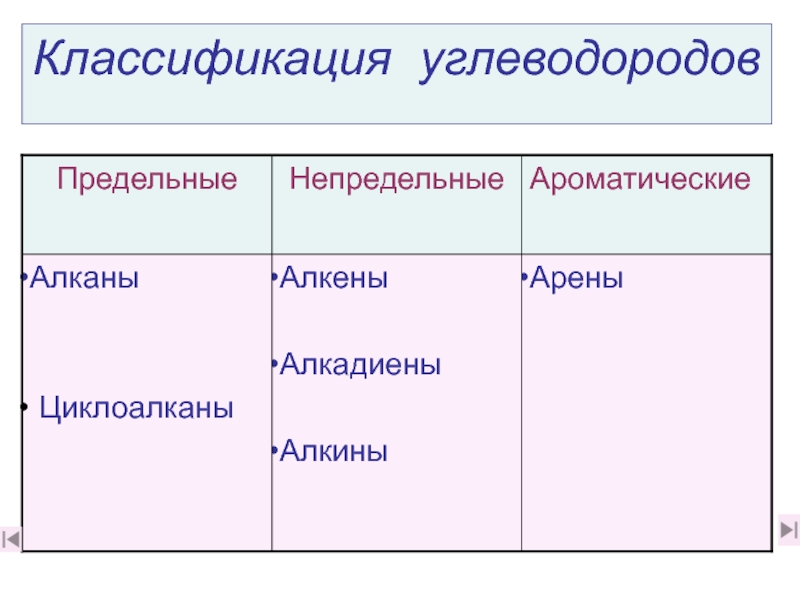
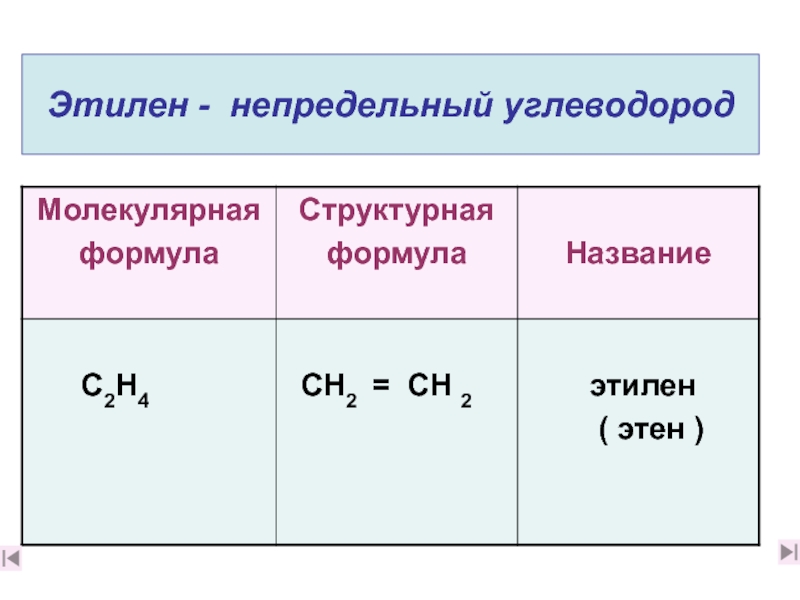
углеводородов он относится? (слайды 6, 1. Какова молекулярная формула
этилена? К какой группе углеводородов он относится? (слайды 6, 71. Какова молекулярная формула этилена? К какой группе углеводородов он относится? (слайды 6, 7)
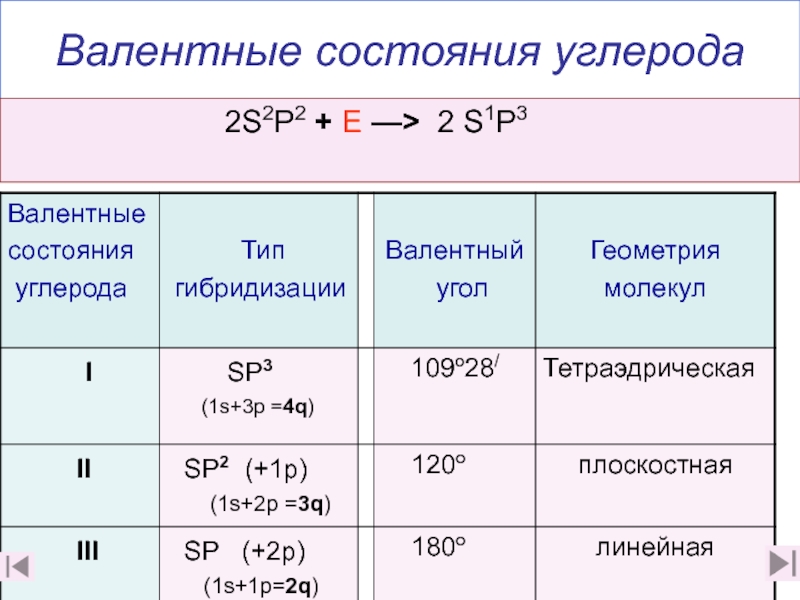
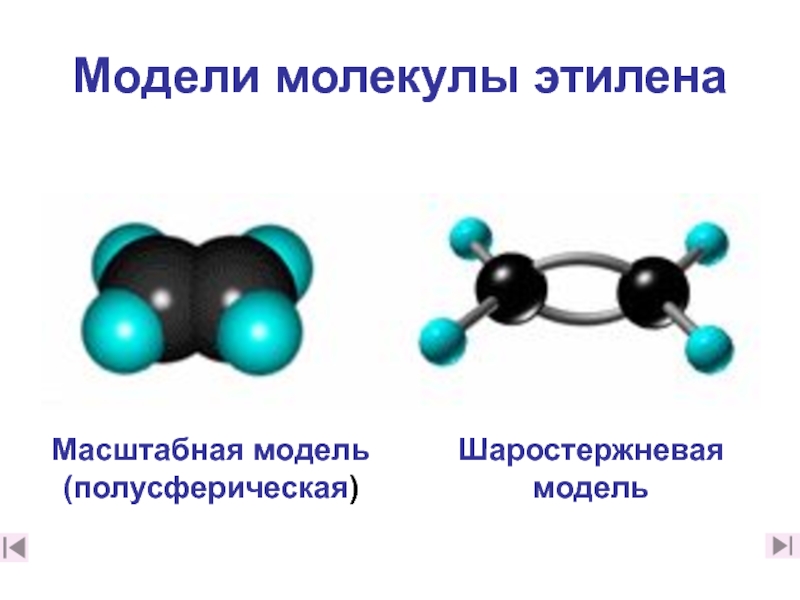
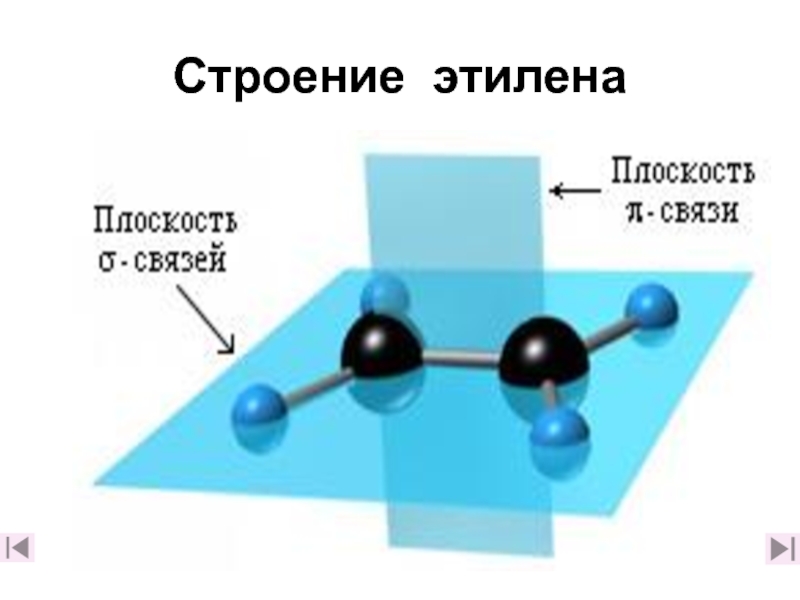
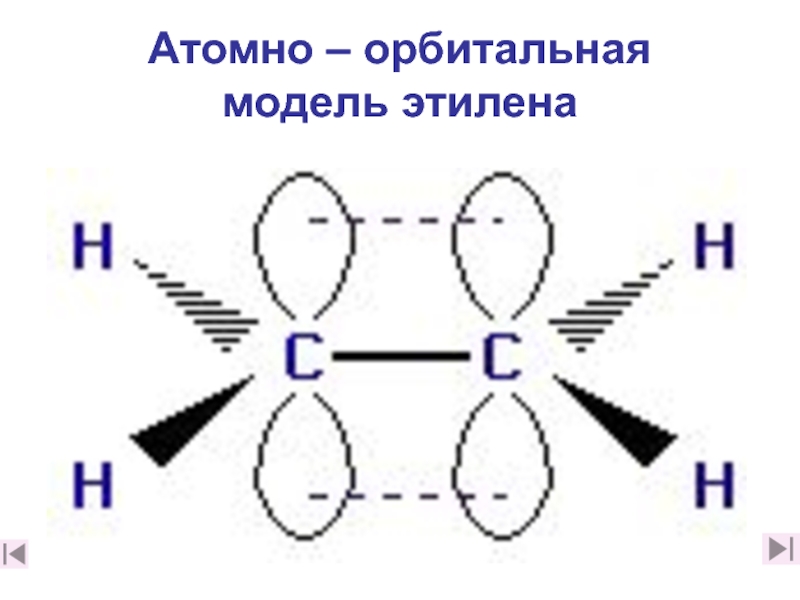
2. Каковы особенности строения этилена? (слайды 7-10,2. Каковы особенности строения этилена? (слайды 7-10,182. Каковы особенности строения этилена? (слайды 7-10,18)
3. Какую геометрическую форму имеет этилен и почему? (слайд 9)
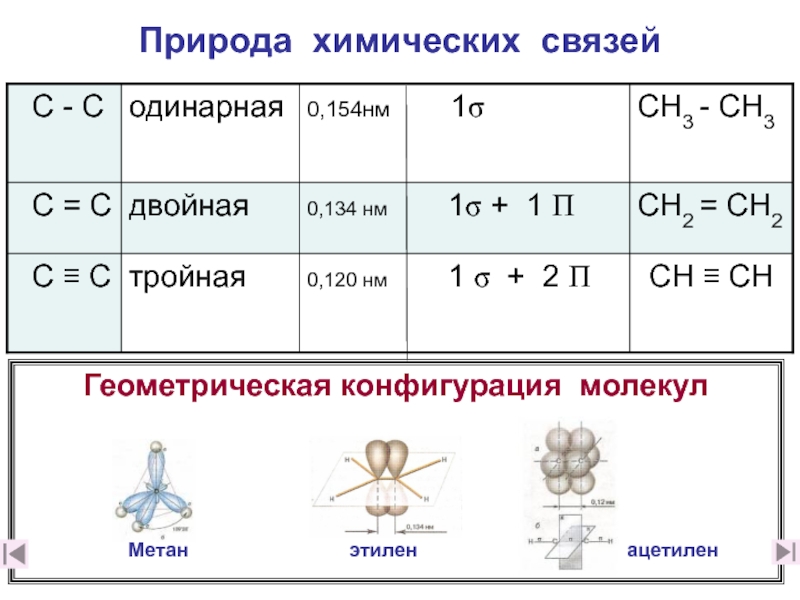
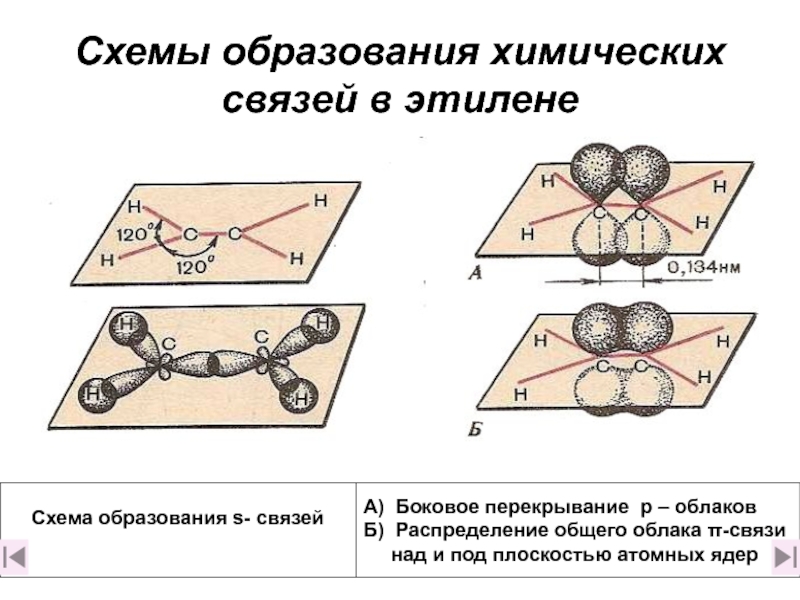
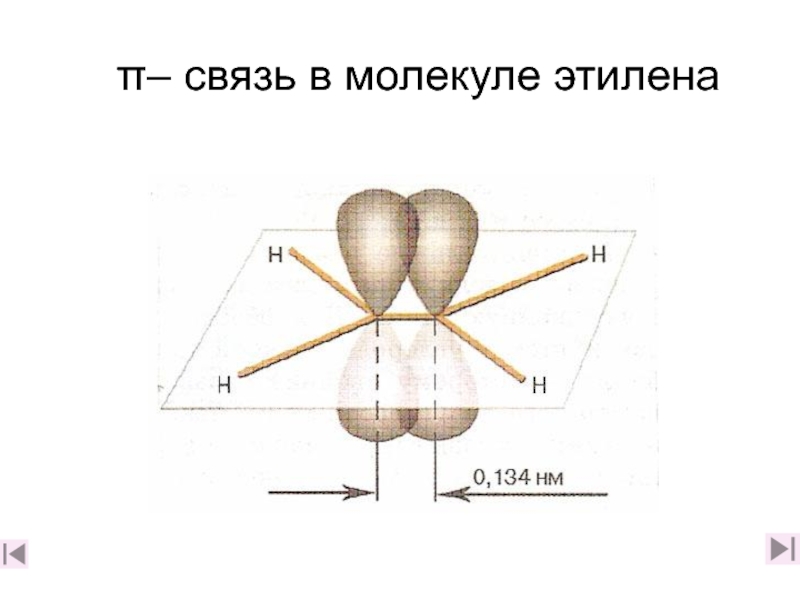
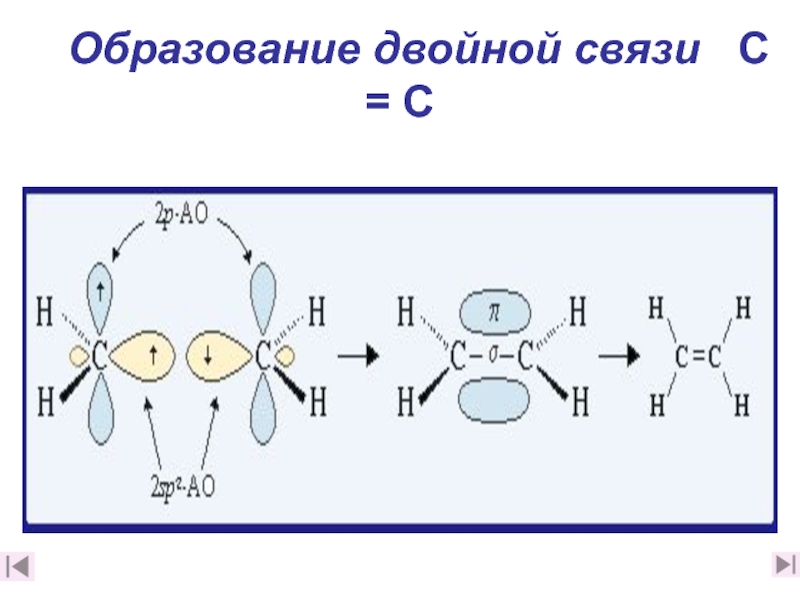
4. Какова природа двойной связи? (слайды 11-16)
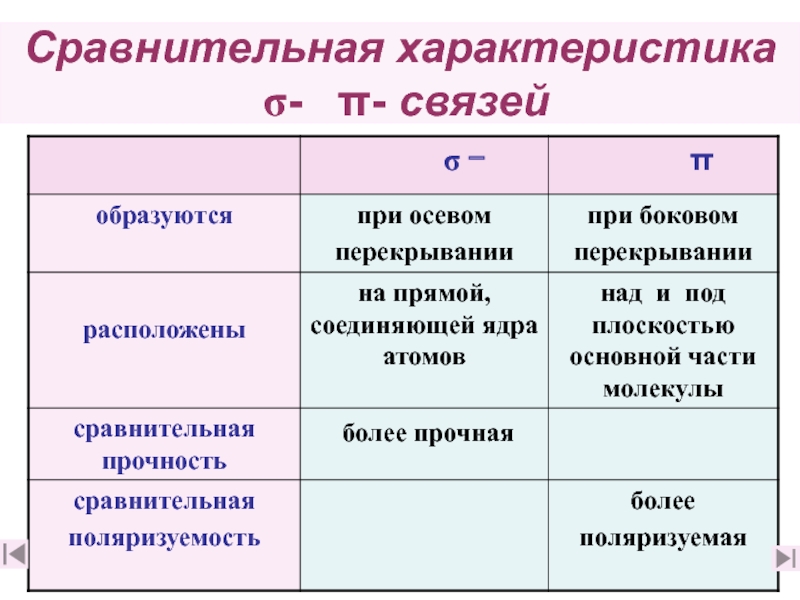
5. Чем отличаются σ– и π– связи? (слайд 17)
6. Какая связь прочнее: а) одинарная или б) двойная и почему? (слайд 17)
7. Дайте краткое описание электронного строения этилена (слайд 18)
8. Перечислите физические свойства этилена (слайд 19)
9. Что вам известно о распространенности этилена в природе? ( слайды 209. Что вам известно о распространенности этилена в природе? ( слайды 20, 219. Что вам известно о распространенности этилена в природе? ( слайды 20, 21)
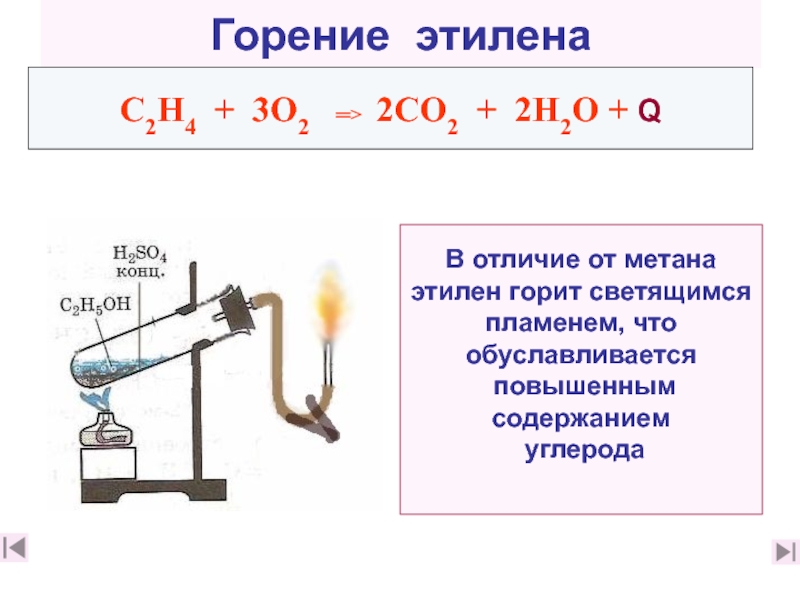
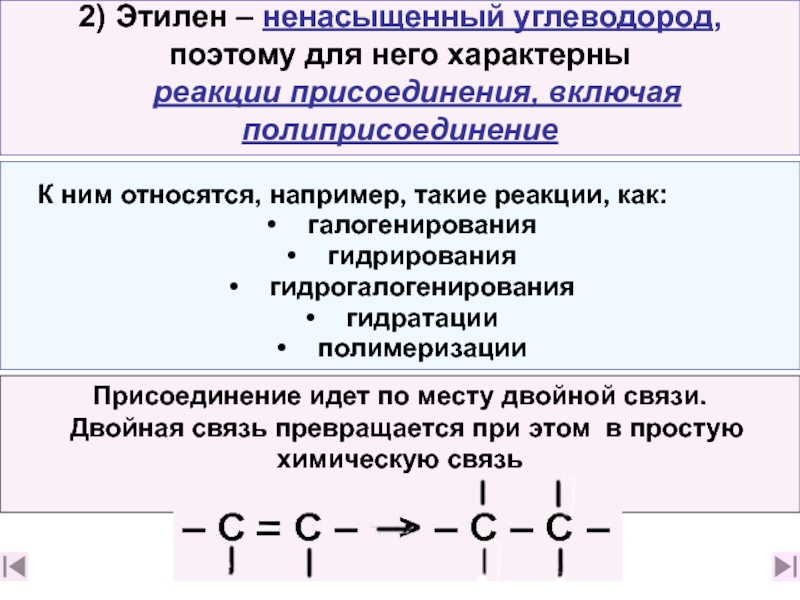
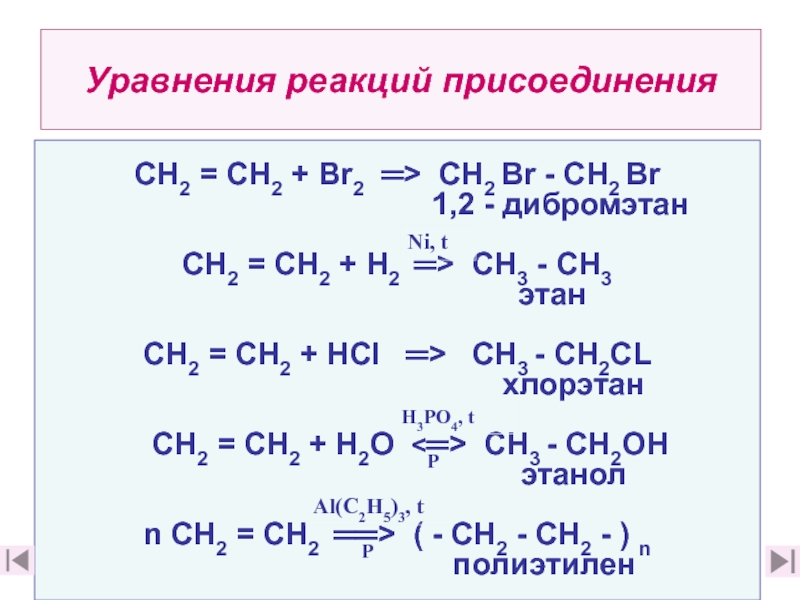
10. Перечислите химические свойства этилена (слайд 22)
11. Какие типы реакций отвечают особенностям строения этилена, почему? (слайд 11. Какие типы реакций отвечают особенностям строения этилена, почему? (слайд 23)
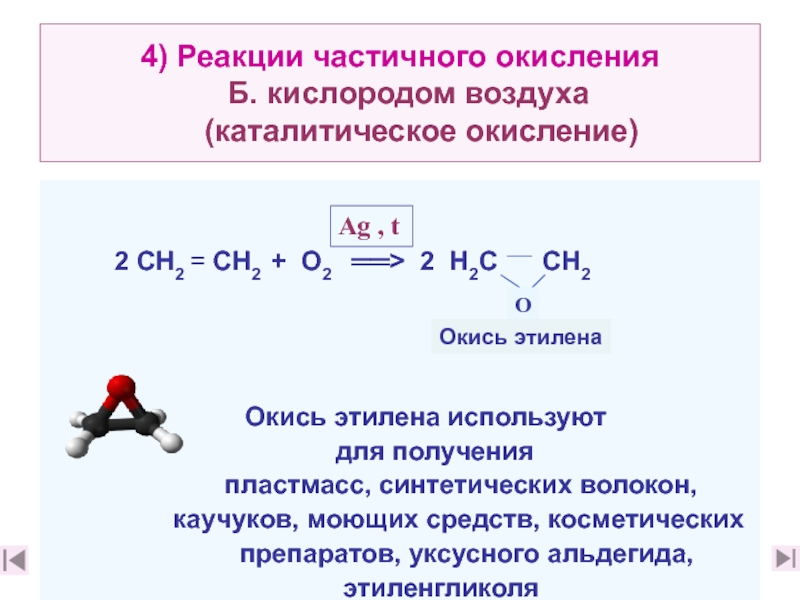
12. Приведите примеры химических реакций, характерных для этилена ( слайды 23, 24, 12. Приведите примеры химических реакций, характерных для этилена ( слайды 23, 24, 2812. Приведите примеры химических реакций, характерных для этилена ( слайды 23, 24, 28,30)
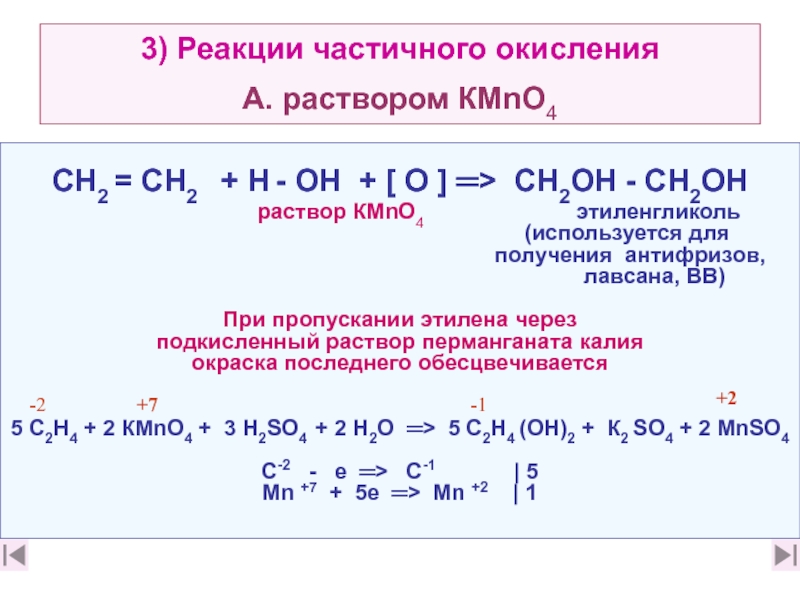
13. Какие реакции можно использовать для подтверждения непредельного
характера этилена? Каковы признаки этих реакций? (слайды 28 характера этилена? Каковы признаки этих реакций? (слайды 28, 29, характера этилена? Каковы признаки этих реакций? (слайды 28, 29, 36, 37)
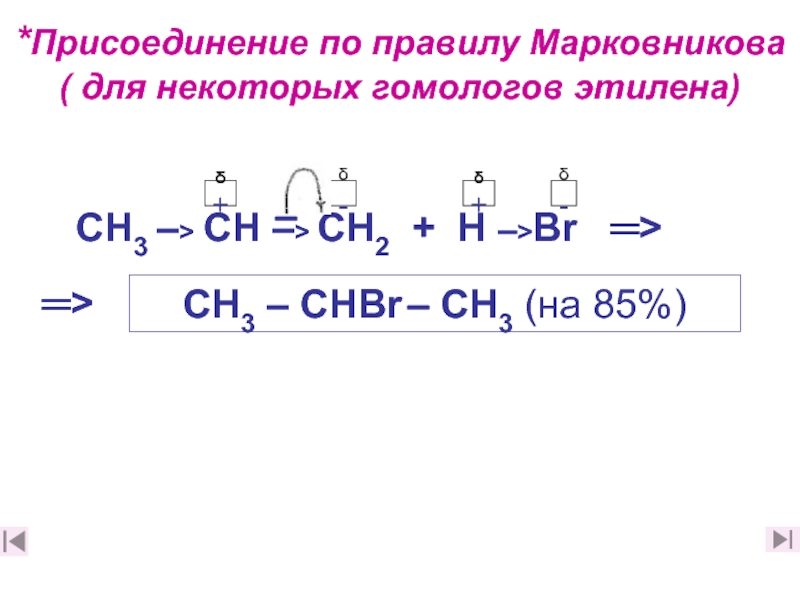
14. По какому механизму протекают реакции бромирования и гидрогалогенирования
этилена и его некоторых гомологов? (слайды 25 этилена и его некоторых гомологов? (слайды 25, этилена и его некоторых гомологов? (слайды 25, 26 этилена и его некоторых гомологов? (слайды 25, 26, 27)
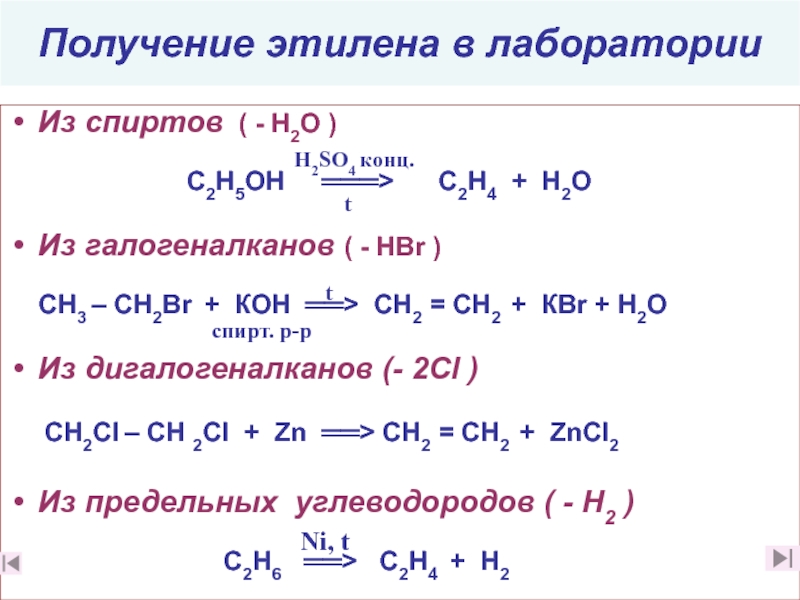
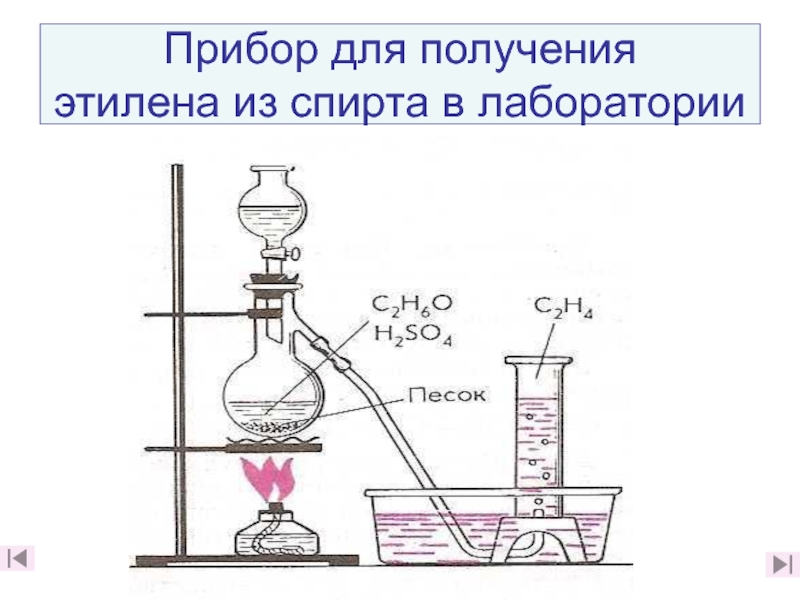
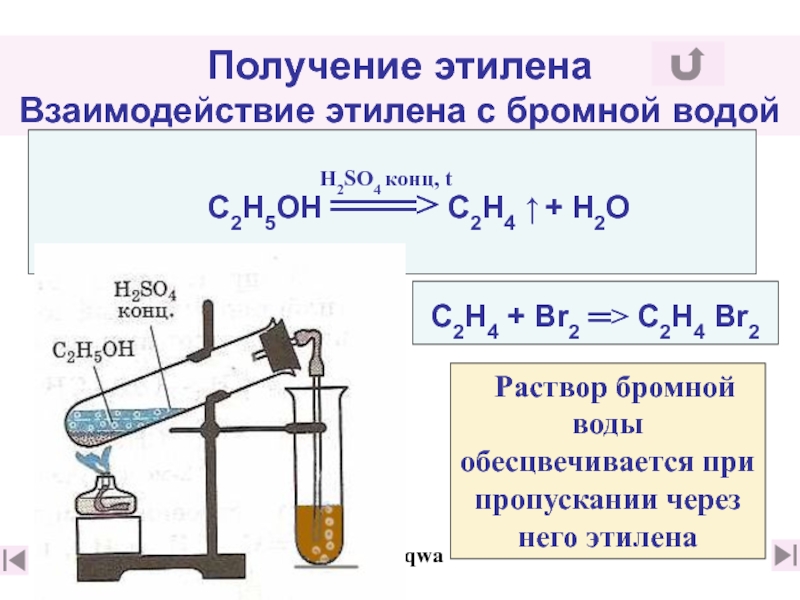
15. Из каких веществ и в ходе каких реакций можно получить этилен в лаборатории?
(слайды 31 (слайды 31, 32)
16. Какие безопасные опыты с этиленом можно провести в лаборатории? (слайды 33 - 38)
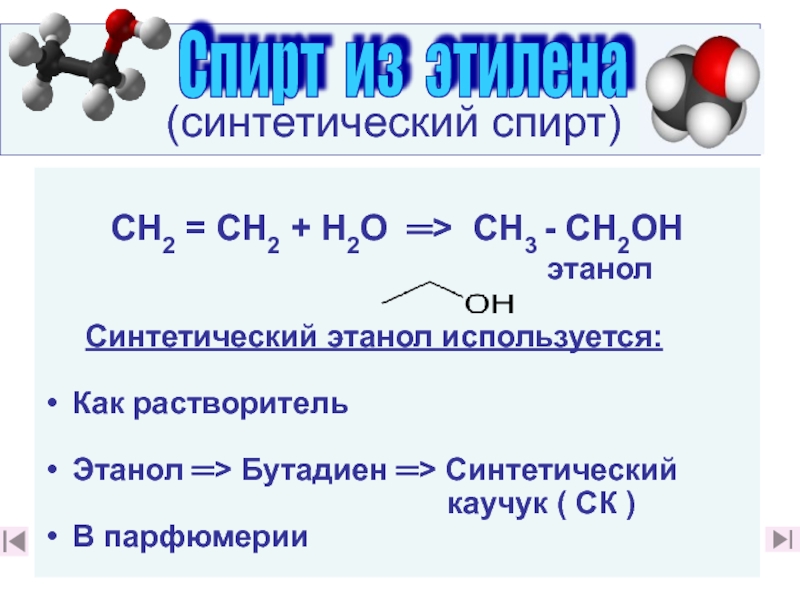
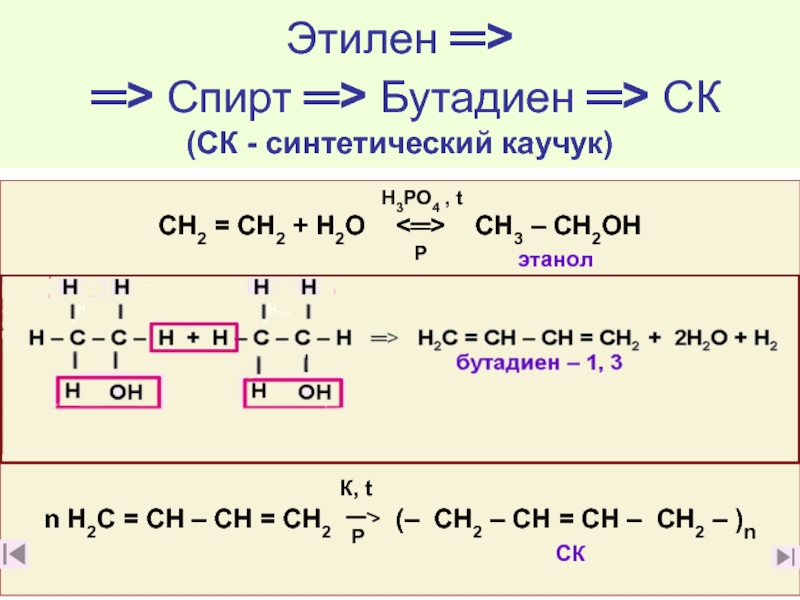
17. Почему этилен относят к веществам «Большой химии»? (слайды 3917. Почему этилен относят к веществам «Большой химии»? (слайды 39, 40)
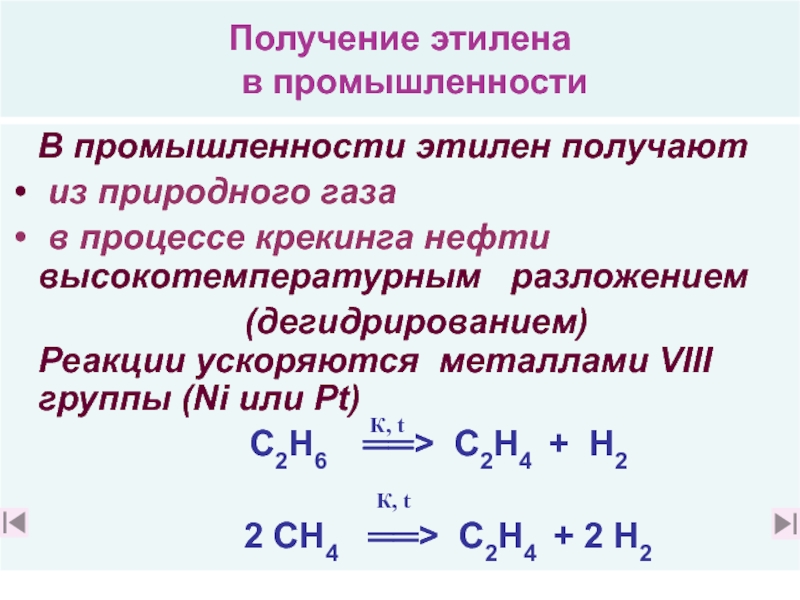
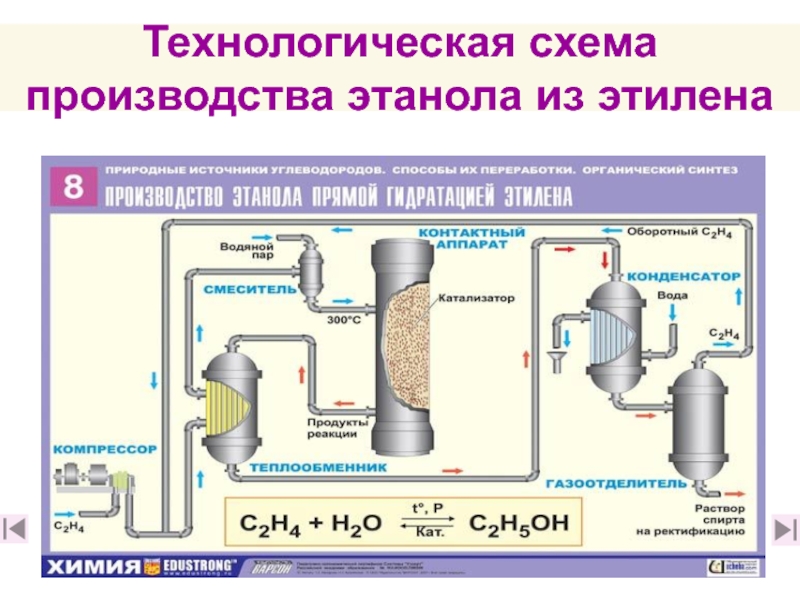
18. Какое сырье можно использовать для промышленного получения этилена
и какие реакции лежат в основе его получения? (слайд 41)
19. Какой мощности заводы по производству этилена функционируют в России? (слайды 42 19. Какой мощности заводы по производству этилена функционируют в России? (слайды 42 -4419. Какой мощности заводы по производству этилена функционируют в России? (слайды 42 -44- 46)
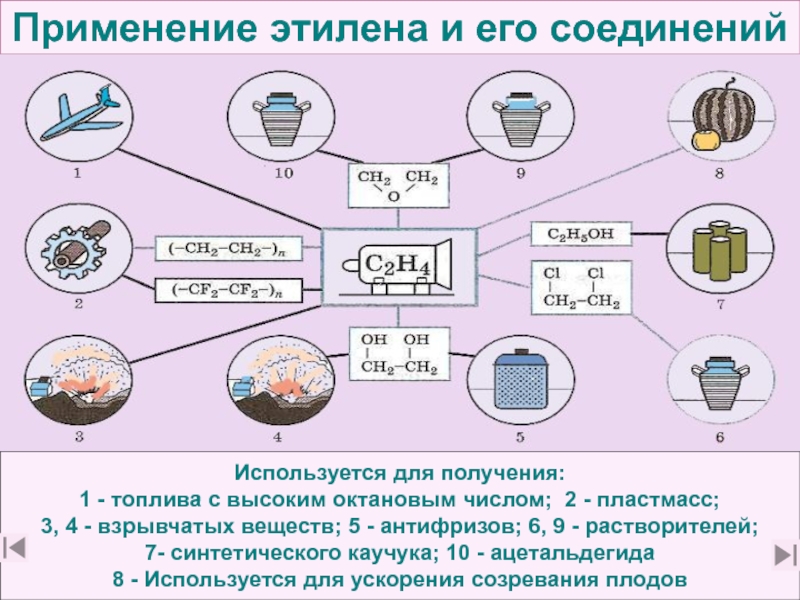
20. Какие производства на основе этилена известны вам? (слайд 40)
21. Какие химические производства на основе этилена и его соединений вы считаете наиболее
важными важными для народного хозяйства и почему? (слайды 48 - 68)

















![Этилен Взаимодействие этилена с перманганатом калияCН2 = CН2 + Н - ОН Взаимодействие этилена с перманганатом калияCН2 = CН2 + Н - ОН + [ О ] ═>](/img/thumbs/278ee6ee9342d07dd5c16f5d6eaada5a-800x.jpg)