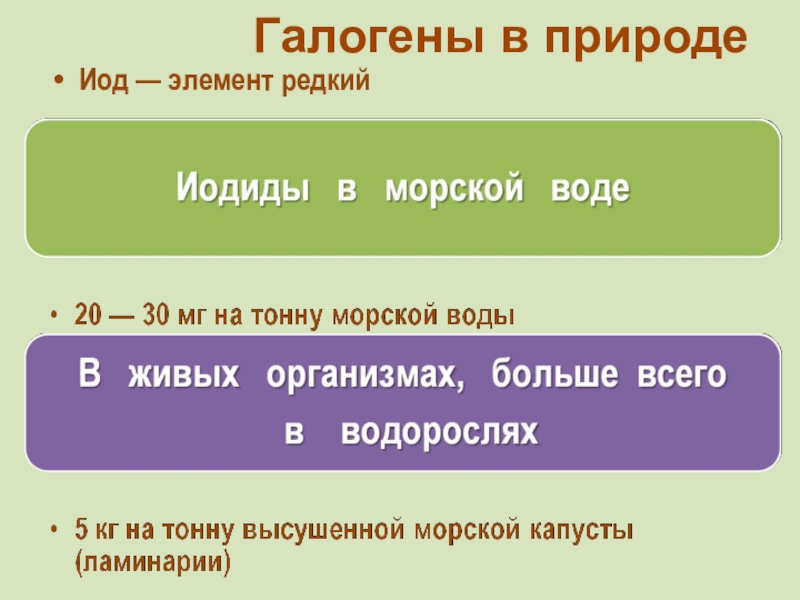
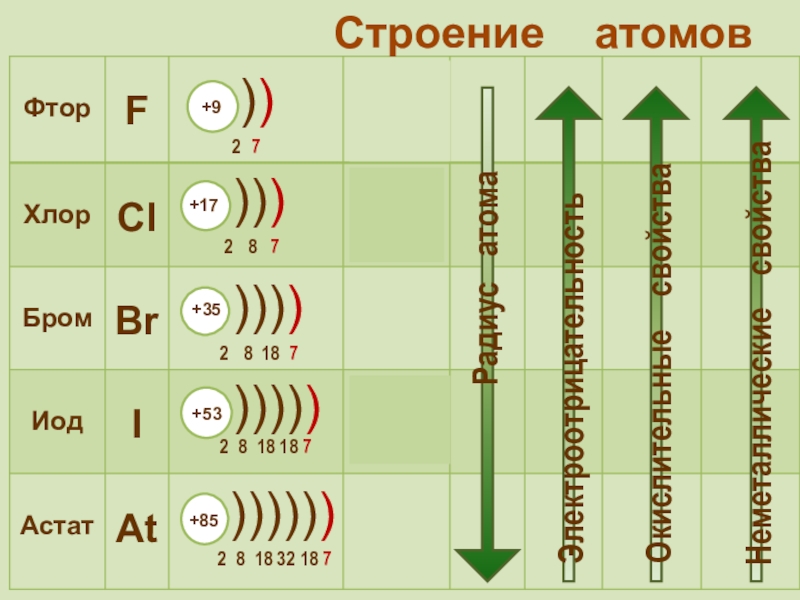
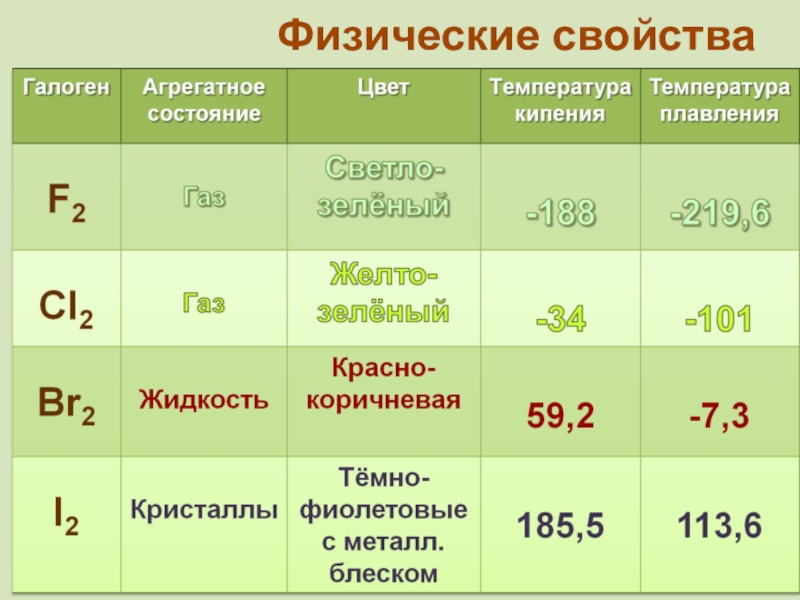
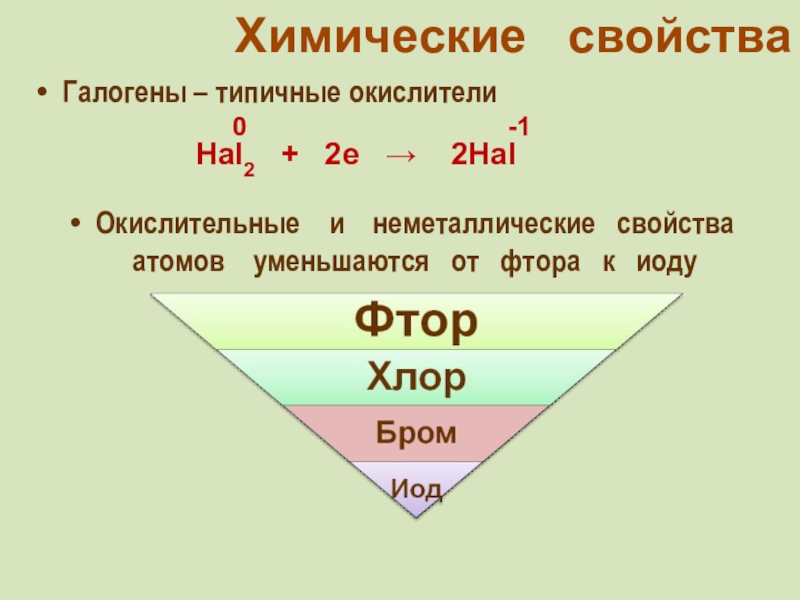
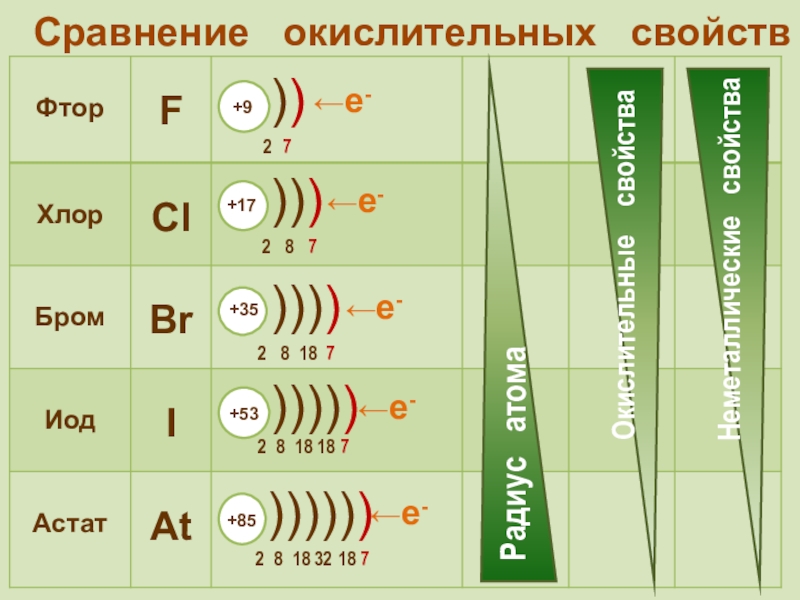
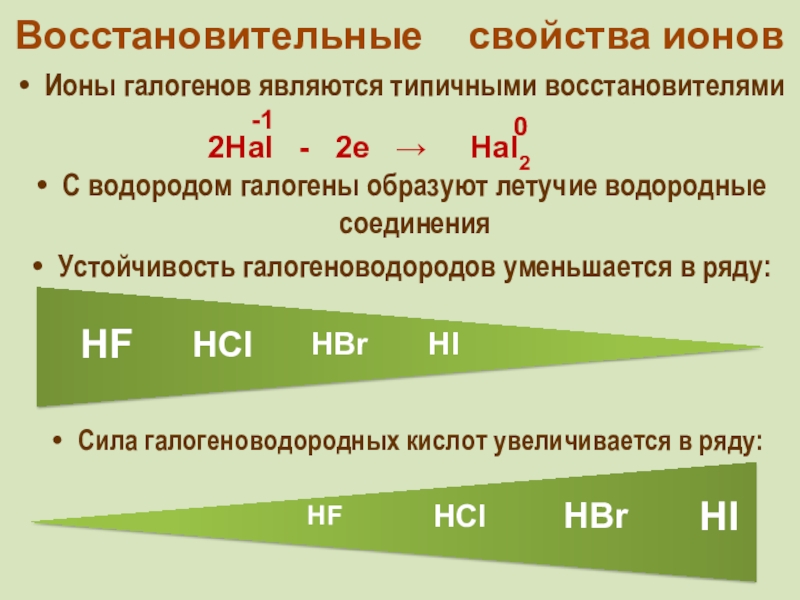
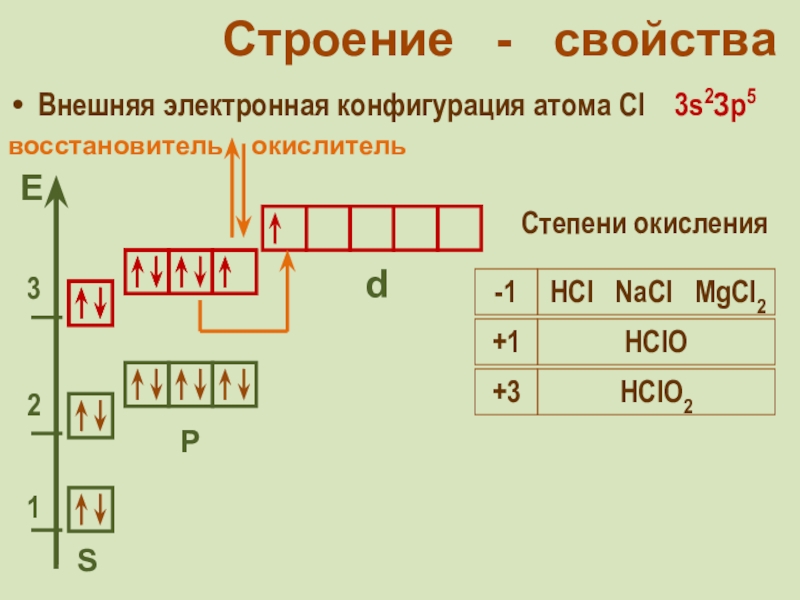
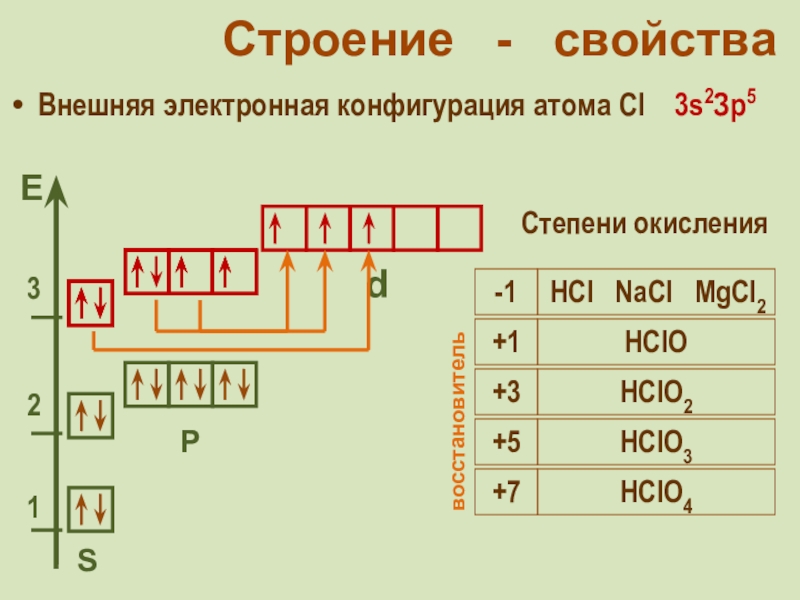
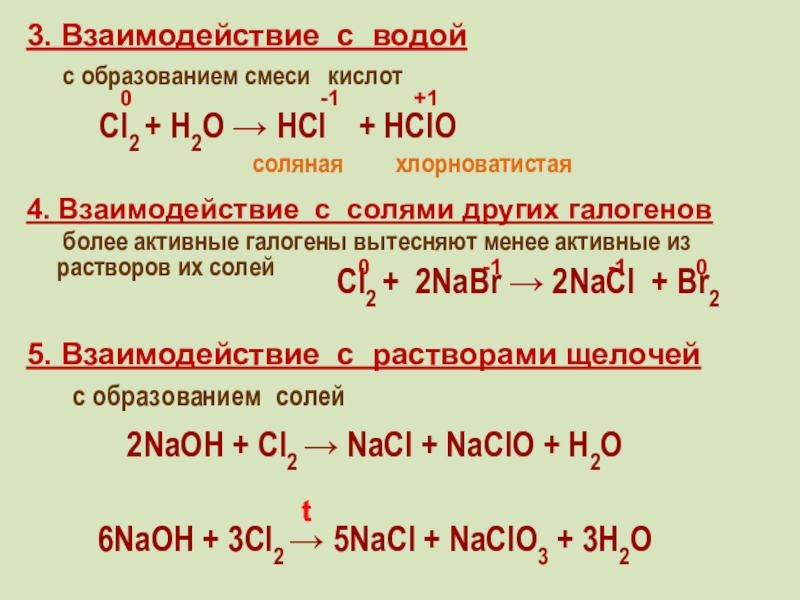
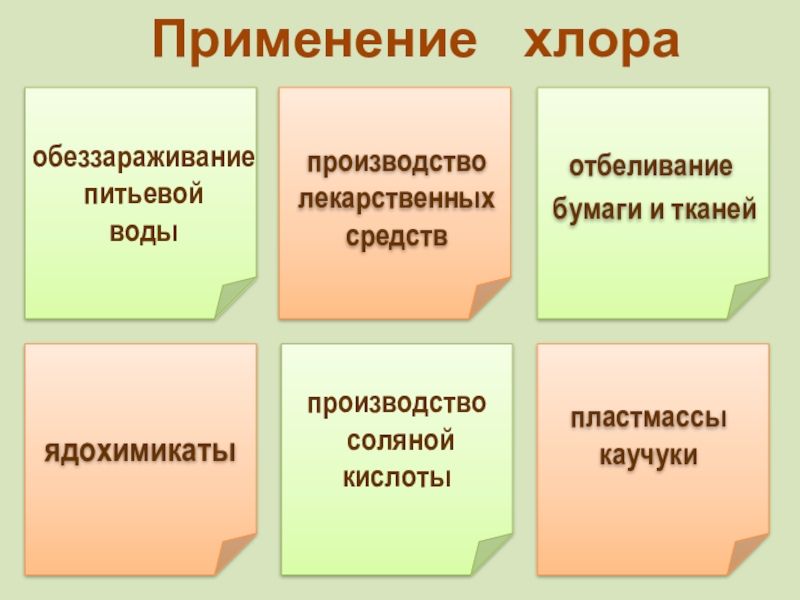
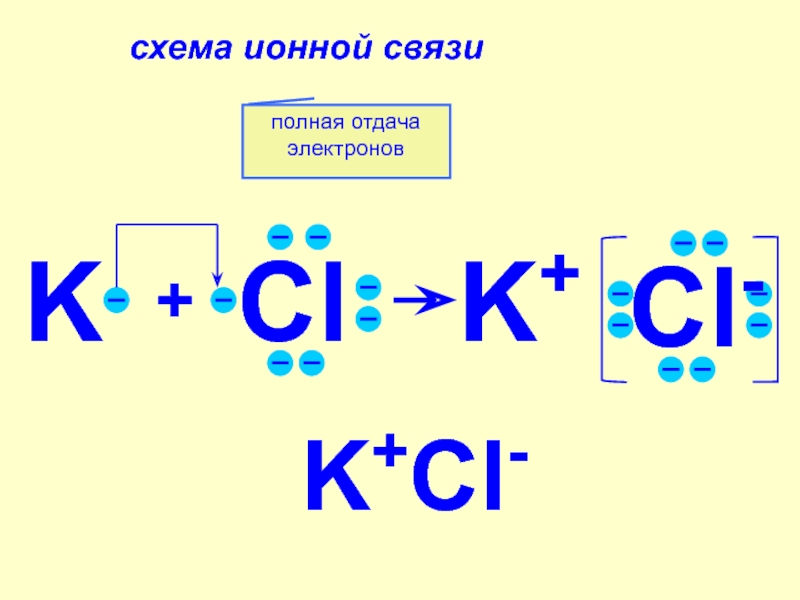
фтор F, хлор Cl, бром
Br, иод I, астат At Общее название - галогены (греч. «солеобразующие») - большинство их соединений с металлами представляют собой типичные соли (KCl, NaCl и т.д.).