Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Тема "Неметаллы" 9 класс
Содержание
- 1. Тема "Неметаллы" 9 класс
- 2. ПОЯСНИТЕЛЬНАЯ ЗАПИСКАМетодическая разработка обеспечивает реализацию программы О.С.Габриеляна
- 3. ЦЕЛИ РАЗДЕЛАформирование у учащихся целостного представления о
- 4. ЗАДАЧИ РАЗДЕЛА Обучающие:повторить строение атомов неметаллов и
- 5. ЗАДАЧИ РАЗДЕЛА Развивающие: способствовать развитию логического
- 6. ЗАДАЧИ РАЗДЕЛА Воспитательные:формировать положительные отношения к знаниям
- 7. ОСОБЕННОСТИ
- 8. ОЖИДАЕМЫЕ РЕЗУЛЬТАТЫ ОСВОЕНИЯ РАЗДЕЛА ПРОГРАММЫ ЗНАНИЯУМЕНИЯ И
- 9. МЕТОДЫ ОБУЧЕНИЯДЕДУКТИВНЫЕИНДУКТИВНЫЕСЛОВЕСНЫЕНАГЛЯДНЫЕПРАКТИЧЕСКИЕРЕПРОДУКТИВНЫЕУСТНОГО И ПИСЬМЕННОГО КОНТРОЛЯ И САМОКОНТРОЛЯПРОБЛЕМНО-ПОИСКОВЫЕСТИМУЛИРОВАНИЕ ИНТЕРЕСА К УЧЕНИЮ
- 10. КЛЮЧЕВЫЕ КОМПЕТЕНЦИИЦЕННОСТНО-СМЫСЛОВЫЕСОЦИАЛЬНЫЕИНФОРМАЦИОННЫЕКОМПЕТЕНЦИИ САМОСОВЕРШЕНСТВОВАНИЯЭМОЦИОНАЛЬНО -ПСИХОЛОГИЧЕСКИЕКОММУНИКАТИВНЫЕУЧЕБНО-ПОЗНАВАТЕЛЬНЫЕЗДОРОВЬЕСБЕРЕГАЮЩИЕ
- 11. ТЕХНОЛОГИИ ПРЕПОДАВАНИЯ ТЕМЫДифференцированное обучениеКритическое мышление Исследовательский подходИнформационные Проблемно-поисковый подходЗдоровьесберегающие Личностно-ориентированный подход
- 12. КОНТРОЛЬ ЗНАНИЙ УЧАЩИХСЯВИДЫ КОНТРОЛЯИНДИВИДУАЛЬНЫЙФРОНТАЛЬНЫЙТЕКУЩИЙИТОГОВЫЙТЕМАТИЧЕСКИЙГРУППОВОЙ
- 13. КОНТРОЛЬ ЗНАНИЙ УЧАЩИХСЯФОРМЫ КОНТРОЛЯТВОРЧЕСКИЕ ЗАДАНИЯДИФФЕРЕНЦИРО-ВАННЫЕ ПРОВЕРОЧНЫЕ РАБОТЫКОНТРОЛЬНАЯ
- 14. МЕЖПРЕДМЕТНЫЕ СВЯЗИХИМИЯМЕДИЦИНАГЕОГРАФИЯИСТОРИЯЭКОЛОГИЯБИОЛОГИЯФИЗИКАМАТЕМАТИКАОБЖ
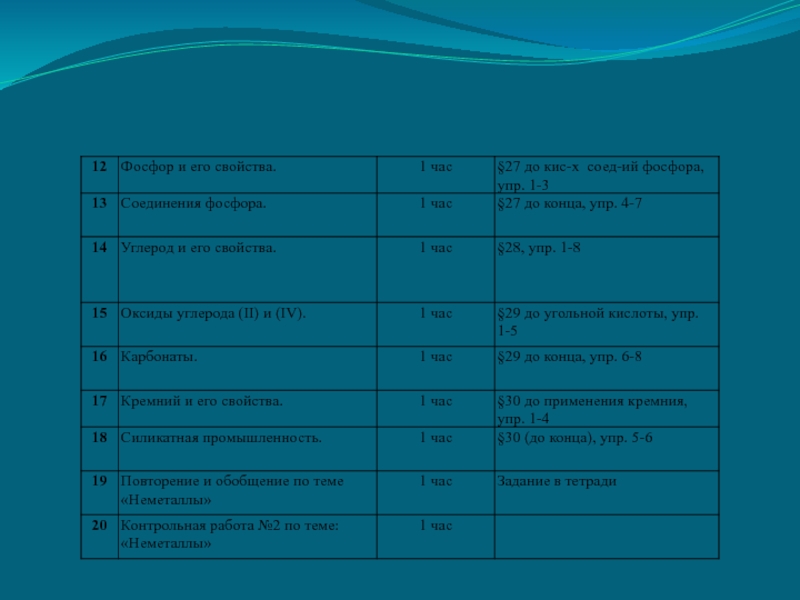
- 15. ПОУРОЧНОЕ ПЛАНИРОВАНИЕ ТЕМЫ: «НЕМЕТАЛЛЫ»Составлено в соответствии с
- 16. ПОУРОЧНОЕ ПЛАНИРОВАНИЕ РАЗДЕЛА
- 17. Слайд 17
- 18. «Едва ли найдется другое, искусственно добываемое вещество,
- 19. РАЗРАБОТКА УРОКА ПО ТЕМЕ
- 20. ХОД УРОКАПОВТОРЕНИЕ МАТЕРИАЛА ПРЕДЫДУЩИХ УРОКОВДОПИСАТЬ УРАВНЕНИЯ РЕАКЦИЙ,
- 21. ИЗУЧЕНИЕ НОВОГО МАТЕРИАЛАУравнения, лежащие в основе производства
- 22. ХИМИЧЕСКИЕ СВОЙСТВА СЕРНОЙ КИСЛОТЫОБРАЗОВАНИЕ ГИДРАТОВ: H2SO4 + n
- 23. ХИМИЧЕСКИЕ СВОЙСТВА СЕРНОЙ КИСЛОТЫВЗАИМОДЕЙСТВИЕ С ОСНОВАНИЯМИ (ЩЕЛОЧАМИ
- 24. ДЕМОНСТРАЦИОННЫЙ ОПЫТ: «ОБУГЛИВАНИЕ САХАРА»
- 25. СОЛИ СЕРНОЙ КИСЛОТЫКРИСТАЛЛИЧЕСКИЙ СУЛЬФАТ НАТРИЯ (ГЛАУБЕРОВА СОЛЬ) Na2SO4•
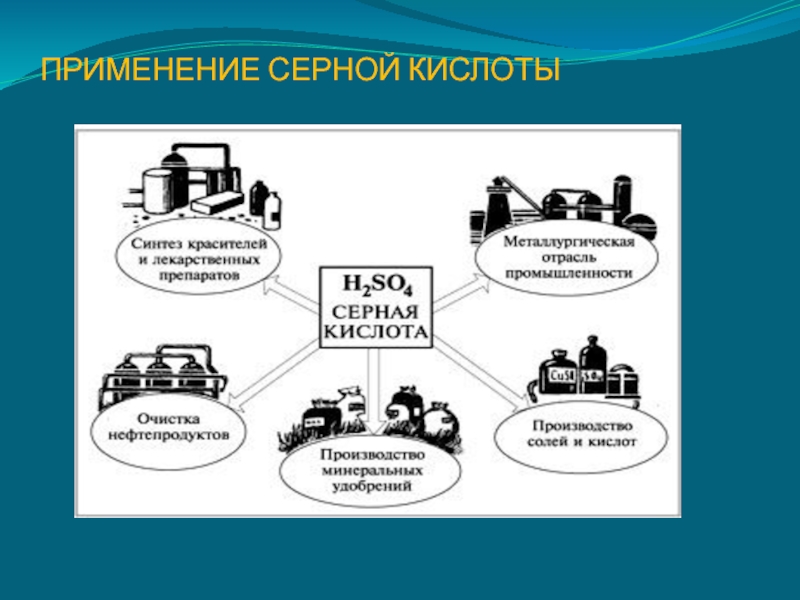
- 26. ПРИМЕНЕНИЕ СЕРНОЙ КИСЛОТЫ
- 27. ЗАКРЕПЛЕНИЕ МАТЕРИАЛАОСУЩЕСТВИТЬ ХИМИЧЕСКИЕ ПРЕВРАЩЕНИЯ ВЕЩЕСТВ:S →
- 28. ДЕМОНСТРАЦИОННЫЙ ОПЫТ: «КАЧЕСТВЕННАЯ РЕАКЦИЯ НА СУЛЬФАТ-ИОН»
- 29. Скачать презентанцию
ПОЯСНИТЕЛЬНАЯ ЗАПИСКАМетодическая разработка обеспечивает реализацию программы О.С.Габриеляна по химии для учащихся 9 класса основной школы по теме «Неметаллы».Основным содержанием раздела является характеристика положения элементов –неметаллов IV –VII групп (главных подгрупп) в
Слайды и текст этой презентации
Слайд 1 МЕТОДИЧЕСКАЯ РАЗРАБОТКА РАЗДЕЛА ПРОГРАММЫ ПО ХИМИИ
В 9 КЛАССЕ
«НЕМЕТАЛЛЫ»
ХИМИИ МОУ СОШ №6 ШАЛАВИНА ЕЛЕНА СЕРГЕЕВНАСлайд 2ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Методическая разработка обеспечивает реализацию программы О.С.Габриеляна по химии для
учащихся 9 класса основной школы по теме «Неметаллы».
Основным содержанием раздела
является характеристика положения элементов –неметаллов IV –VII групп (главных подгрупп) в Периодической системе химических элементов Д.И.Менделеева, раскрываются свойства простых веществ -неметаллов; свойства сложных веществ, образованных элементами-неметаллами и области их применения.Методический аппарат (учебник, рабочая тетрадь, дидактические материалы) ориентирован на развитие познавательных, аналитических, творческих и практических способностей учащихся, предоставляет возможности для контроля и углубления полученных знаний.
Слайд 3ЦЕЛИ РАЗДЕЛА
формирование у учащихся целостного представления о мире, основанного на
приобретенных знаниях, умениях и навыках;
развитие познавательных, интеллектуальных и созидательных
способностей личности в процессе самостоятельного приобретения химических знаний
с использованием различных источников информации;воспитание отношения к химии как к одному из фундаментальных компонентов естествознания и элементу общечеловеческой культуры.
Слайд 4ЗАДАЧИ РАЗДЕЛА
Обучающие:
повторить строение атомов неметаллов и закономерности изменения их
свойств в периодической системе;
углубить, обобщить, расширить знания учащихся;
закрепить
у учащихся навыки составления уравнений в свете ТЭД и ОВР и решения задач; аргументировано защищать свою точку зрения.
Слайд 5ЗАДАЧИ РАЗДЕЛА
Развивающие:
способствовать развитию логического мышления и интеллектуальных умений;
продолжить формировать умения наблюдать и делать выводы, грамотно и красиво
оформлять свою работу;развивать воображение и фантазию, умение слушать при объяснении учителя;
формировать самостоятельность, гибкость, глубину и критичность мышления, творческие и индивидуальные способности учащихся
Слайд 6ЗАДАЧИ РАЗДЕЛА
Воспитательные:
формировать положительные отношения к знаниям по химии и
эксперименту;
воспитывать аккуратности в работе с реактивами,
работе в группах и
индивидуально;привитие высоких нравственных принципов;
воспитывать такие качества личности учащегося, как требовательность к себе, критическое отношение к результатам своей работы, настойчивость в достижении цели;
развивать чувство самокритичности и самоконтроля.
Слайд 7ОСОБЕННОСТИ
ПОДРОСТКОВОГО
ВОЗРАСТА
восприятие более целенаправленно, организованно и планомерно, чем у младшего
школьниказапоминание связано с осмыслением, анализом, систематизацией информации
характерна критичность мышления, улучшает способность к абстрактному мышлению
в оценке труда определяющими становятся критерии: степень трудности и проблемности решаемой задачи, самостоятельность и творчество
усвоение норм человеческих личных и деловых отношений; нравственных убеждений, соответствующих им форм поведения
Слайд 8ОЖИДАЕМЫЕ РЕЗУЛЬТАТЫ ОСВОЕНИЯ РАЗДЕЛА ПРОГРАММЫ
ЗНАНИЯ
УМЕНИЯ И НАВЫКИ
положение неметаллов в
ПС химических элементов, строение их атомов
свойства и применение простых веществ-неметаллов
свойства
и применение соединений элементов –неметалловработа с ПС химических элементов Д.И.Менделеева
составление уравнений химических реакций в свете ТЭД и ОВР
сравнительный анализ химических свойств веществ
проектная деятельность
решение задач
выполнение лабораторных опытов
решение экспериментальных задач
Слайд 9МЕТОДЫ ОБУЧЕНИЯ
ДЕДУКТИВНЫЕ
ИНДУКТИВНЫЕ
СЛОВЕСНЫЕ
НАГЛЯДНЫЕ
ПРАКТИЧЕСКИЕ
РЕПРОДУКТИВНЫЕ
УСТНОГО И ПИСЬМЕННОГО КОНТРОЛЯ И САМОКОНТРОЛЯ
ПРОБЛЕМНО-ПОИСКОВЫЕ
СТИМУЛИРОВАНИЕ ИНТЕРЕСА К УЧЕНИЮ
Слайд 10КЛЮЧЕВЫЕ КОМПЕТЕНЦИИ
ЦЕННОСТНО-СМЫСЛОВЫЕ
СОЦИАЛЬНЫЕ
ИНФОРМАЦИОННЫЕ
КОМПЕТЕНЦИИ САМОСОВЕРШЕНСТВОВАНИЯ
ЭМОЦИОНАЛЬНО -ПСИХОЛОГИЧЕСКИЕ
КОММУНИКАТИВНЫЕ
УЧЕБНО-ПОЗНАВАТЕЛЬНЫЕ
ЗДОРОВЬЕСБЕРЕГАЮЩИЕ
Слайд 11ТЕХНОЛОГИИ ПРЕПОДАВАНИЯ ТЕМЫ
Дифференцированное обучение
Критическое мышление
Исследовательский подход
Информационные
Проблемно-поисковый подход
Здоровьесберегающие
Личностно-ориентированный
подход
Слайд 12КОНТРОЛЬ ЗНАНИЙ УЧАЩИХСЯ
ВИДЫ КОНТРОЛЯ
ИНДИВИДУАЛЬНЫЙ
ФРОНТАЛЬНЫЙ
ТЕКУЩИЙ
ИТОГОВЫЙ
ТЕМАТИЧЕСКИЙ
ГРУППОВОЙ
Слайд 13КОНТРОЛЬ ЗНАНИЙ УЧАЩИХСЯ
ФОРМЫ КОНТРОЛЯ
ТВОРЧЕСКИЕ ЗАДАНИЯ
ДИФФЕРЕНЦИРО-ВАННЫЕ ПРОВЕРОЧНЫЕ РАБОТЫ
КОНТРОЛЬНАЯ РАБОТА ПО ТЕМЕ:
«НЕМЕТАЛЛЫ»
ХИМИЧЕСКИЕ ДИКТАНТЫ
ТЕСТЫ
КОНТРОЛЬ ДОМАШНИХ ПИСЬМЕННЫХ РАБОТ И ТЕТРАДЕЙ
Слайд 15ПОУРОЧНОЕ ПЛАНИРОВАНИЕ ТЕМЫ: «НЕМЕТАЛЛЫ»
Составлено в соответствии
с программой
курса химии
для 8 – 11 классов общеобразовательных учреждений
автор О. С.
Габриелян (2009 год)
Слайд 18«Едва ли найдется другое, искусственно добываемое вещество, столь часто применяемое
в технике, как серная кислота. Там, где техническая деятельность развита,
там потребляется и много серной кислоты»Д.И.Менделеев
Слайд 19РАЗРАБОТКА УРОКА ПО ТЕМЕ «СЕРНАЯ КИСЛОТА
И ЕЕ СОЛИ»
Тип урока: изучение нового материала.
Цель урока: дать характеристику
состава и свойств серной кислоты в свете ТЭД и ОВР; сравнить свойства концентрированной и разбавленной серной кислоты. Познакомить учащихся с использованием солей серной кислоты в народном хозяйстве. Оборудование: серная кислота (конц. и раствор), цинк гранулированный, гидроксид натрия р-р, оксид меди (II), хлорид бария р-р, сульфат натрия р-р, лакмус, лучинка, термометр, сахарная пудра, спиртовка, химическая посуда.
Слайд 20ХОД УРОКА
ПОВТОРЕНИЕ МАТЕРИАЛА ПРЕДЫДУЩИХ УРОКОВ
ДОПИСАТЬ УРАВНЕНИЯ РЕАКЦИЙ, РАССМОТРЕТЬ ИХ КАК
ОВР И УКАЗАТЬ НАЗВАНИЯ ОБРАЗУЮЩИХСЯ ВЕЩЕСТВ :
S + O2―›
S +
H2 ―›S + Na ―›
S + C ―›
ВОПРОСЫ ДЛЯ ОПРОСА КЛАССА:
1) ЧТО ТАКОЕ СЕРОВОДОРОД?
2) КАКОВЫ ХИМИЧЕСКИЕ СВОЙСТВА СЕРОВОДОРОДА? МОЖЕТ ЛИ СЕРОВОДОРОД ПРОЯВЛЯТЬ ОКИСЛИТЕЛЬНЫЕ СВОЙСТВА? ПОЧЕМУ?
3) КАКОВЫ ХИМИЧЕСКИЕ СВОЙСТВА СЕРНИСТОГО ГАЗА?
4) КАКИЕ ОВ СВОЙСТВА ПРОЯВЛЯЕТ СЕРНИСТЫЙ ГАЗ, СЕРНИСТАЯ КИСЛОТА?
5)КАКОВЫ ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДА СЕРЫ (VI)? ОПИШИТЕ ЕГО ФИЗИЧЕСКИЕ СВОЙСТВА.
Слайд 21ИЗУЧЕНИЕ НОВОГО МАТЕРИАЛА
Уравнения, лежащие в основе
производства серной кислоты:
4FeS2 +
11 O2 = 8 SO2 ↑ + 2Fe2O3
2 H2S +
3 O2 = 2 SO2↑ + 2H2OSO3 + H2O = H2SO4
Структурная формула серной кислоты:
Физические свойства серной кислоты:
ρ (H2SO4) = 1,84 г/см3
ω (H2SO4) = 98,3 %
тяжелая, бесцветная, маслянистая
жидкость, хорошо растворимая
в воде
Техника безопасности при работе с серной кислотой.
Основное правило разбавления концентрированной серной кислоты.
Слайд 22ХИМИЧЕСКИЕ СВОЙСТВА СЕРНОЙ КИСЛОТЫ
ОБРАЗОВАНИЕ ГИДРАТОВ:
H2SO4 + n H2O = H2SO4
• n H2O
ГИГРОСКОПИЧНОСТЬ
C12H22O11 + H2SO4 = C + H2SO4•n H2O
СЕРНАЯ КИСЛОТА КАК ЭЛЕКТРОЛИТ:H2SO4 → 2H+ + SO42-
ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ РАЗБАВЛЕННОЙ И КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЫ:
Zn + H2SO4(р-р) = ZnSO4 + H2↑
Cu + 2H2SO4(конц.) = CuSO4 + SO2↑ + 2H2O
Слайд 23ХИМИЧЕСКИЕ СВОЙСТВА СЕРНОЙ КИСЛОТЫ
ВЗАИМОДЕЙСТВИЕ С ОСНОВАНИЯМИ (ЩЕЛОЧАМИ И НЕРАСТВОРИМЫМИ В
ВОДЕ):
2NaOH + H2SO4 = Na2SO4 + 2H2O;
H+ + OH- = H2OCu(OH)2 + H2SO4 = CuSO4 + 2H2O; Cu(OH)2 + 2H+ = Cu2+ + 2H2O
ВЗАИМОДЕЙСТВИЕ С ОСНОВНЫМИ И АМФОТЕРНЫМИ ОКСИДАМИ:
CuO + H2SO4 = CuSO4 + H2O; CuO + 2H+ = Cu2+ + H2O
Al2O3 + 3H2SO4 =Al2(SO4)3 + 3H2O; Al2S3 + 6H+ = 2Al3+ + 3H2O
КАЧЕСТВЕННАЯ РЕАКЦИЯ НА СУЛЬФАТ-ИОН:
Ba2+ + SO42- = BaSO4↓ (ОСАДОК БЕЛОГО ЦВЕТА)
Слайд 25СОЛИ СЕРНОЙ КИСЛОТЫ
КРИСТАЛЛИЧЕСКИЙ СУЛЬФАТ НАТРИЯ (ГЛАУБЕРОВА СОЛЬ)
Na2SO4• 10 H2O
ГИПС
CaSO4• 2H2O
СУЛЬФАТ БАРИЯ
BaSO4МЕДНЫЙ КУПОРОС CuSO4•5 H2O
СУЛЬФАТ МАГНИЯ (СЕРНОКИСЛАЯ МАГНЕЗИЯ) MgSO4
Слайд 27 ЗАКРЕПЛЕНИЕ МАТЕРИАЛА
ОСУЩЕСТВИТЬ ХИМИЧЕСКИЕ ПРЕВРАЩЕНИЯ ВЕЩЕСТВ:
S → FeS → SO2
→ SO3 → … → BaSO4
(уравнения разобрать в свете ОВР
и ТЭД)В СХЕМЕ ОВР РАССТАВИТЬ КОЭФФИЦИЕНТЫ МЕТОДОМ ЭЛЕКТРОННОГО БАЛАНСА, УКАЖИТЕ ОКИСЛИТЕЛЬ И ВОССТАНОВИТЕЛЬ:
Zn + H2SO4(конц.) → ZnSO4 + … + H2O
ДОМАШНЕЕ ЗАДАНИЕ
§ 22 (ДО КОНЦА), УПР. 3,4,8