Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация к уроку химии "Одноатомные спирты", 10 класс
Содержание
- 1. Презентация к уроку химии "Одноатомные спирты", 10 класс
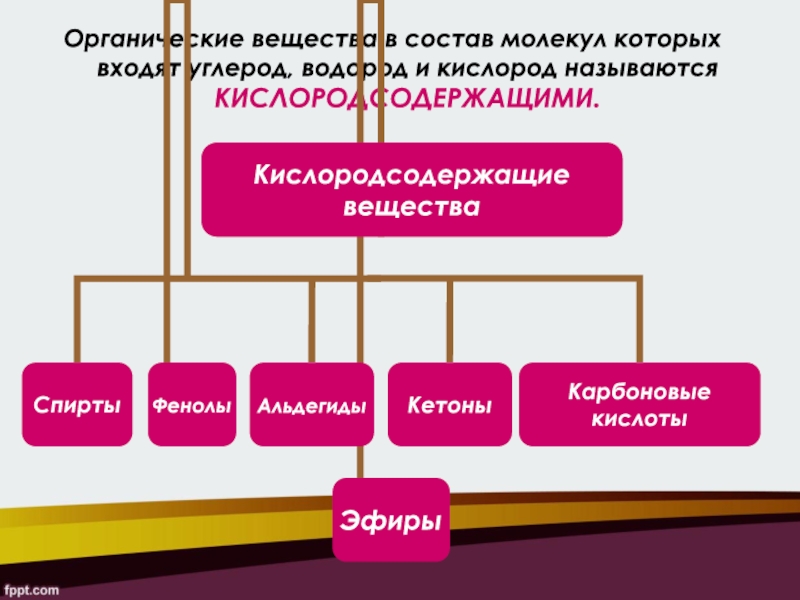
- 2. Органические вещества в состав молекул которых входят углерод, водород и кислород называются КИСЛОРОДСОДЕРЖАЩИМИ.
- 3. Спирты – это производные углеводородов, в молекулах
- 4. НАХОЖДЕНИЕ В ПРИРОДЕСпирты имеют самое широкое распространение
- 5. В эфирных маслах зеленых частей многих растений
- 6. По числу гидроксильных группОдноатомные (СН3-CH2-ОН)ДвухатомныеНО-СН2-СН2-ОНТрехатомные СН2-СН-СН2
- 7. По характеру атома углерода, с которым связана
- 8. Строение спиртовСвязи О–Н и С–О - полярные
- 9. Изомерия спиртов
- 10. ИЗОМЕРИЯСН3-СН2-СН2-СН2 -ОНСН3 – СН – СН2 -ОНБутанол
- 11. СН3-СН2-СН2-СН2- ОНСН3 - СН -СН2- СН
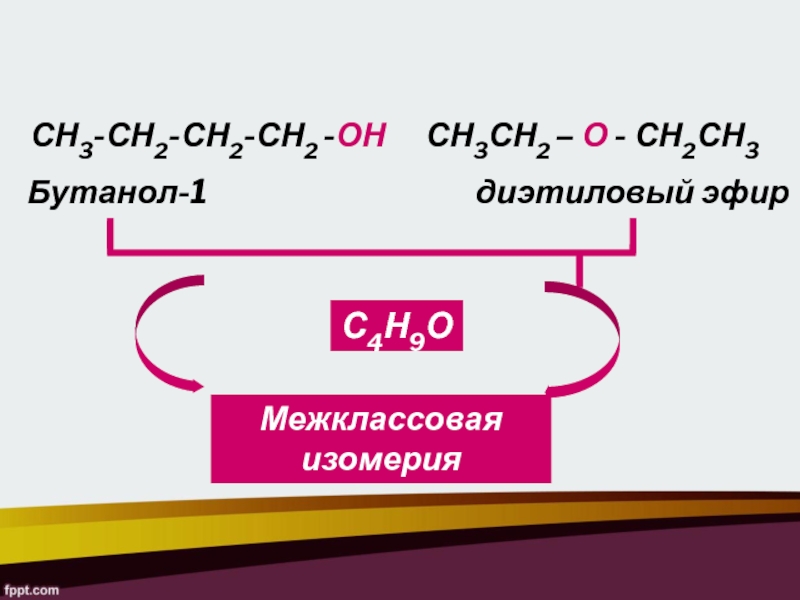
- 12. СН3СН2 – О - СН2СН3Бутанол-1
- 13. Физические свойстваНизшие спирты (до C15) — жидкости,
- 14. Водородная связь между атомами водорода одной
- 15. Благодаря полярности гидроксильной группы и наличию в
- 16. Получение1. Самый общий способ получения спиртов, имеющий
- 17. 2. Другой общий способ получения спиртов —
- 18. Получение3. Восстановление карбонильных соединений. При восстановлении альдегидов
- 19. 4. Действие реактивов Гриньяра на карбонильные соединения
- 20. ХИМИЧЕСКИЕ СВОЙСТВАХимические свойства спиртов определяются присутствием в
- 21. проявляются слабые кислотные свойства спиртовСкорость реакций, при
- 22. Кислотные свойства спиртов выражены очень слабо. Низшие
- 23. 2. При действии на спирты минеральных и
- 24. Реакции с разрывом связи О-Н3. Спирты окисляются
- 25. Реакции с разрывом связи С-О. Реакции дегидратации
- 26. Спирты обратимо реагируют с галогеноводородными кислотами (здесь
- 27. Применение
- 28. Слайд 28
- 29. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Органические вещества в состав молекул которых входят углерод, водород и
кислород называются КИСЛОРОДСОДЕРЖАЩИМИ.
Слайд 3Спирты – это производные углеводородов, в молекулах которых один или
нескольких атомов водорода замещены гидроксильными группами –ОН.
СЛОВАРЬ
Группа -ОН обусловливает свойства
спиртов, поэтому данную группу атомов называют функциональной группой
R – OH
Слайд 4НАХОЖДЕНИЕ В ПРИРОДЕ
Спирты имеют самое широкое распространение в природе, особенно
в виде сложных эфиров, однако и в свободном состоянии их
можно встретить достаточно часто.Метиловый спирт в небольшом количестве содержится в некоторых растениях, например: борщевике.
Этиловый спирт — естественный продукт спиртового брожения органических продуктов, содержащих углеводороды, часто образующийся в прокисших ягодах и фруктах без всякого участия человека. Этанол содержится в тканях и крови животных и человека.
Бисаболол — входит в состав эфирного масла ромашки, тополя .
Слайд 5В эфирных маслах зеленых частей многих растений содержится «спирт листьев»,
придающий им характерный запах.
Фенилэтиловый спирт — душистый компонент розового эфирного
масла.Очень широко представлены в растительном мире терпеновые спирты, многие из которых являются душистыми веществами, например: Линалоол — содержится во многих цветочных эфирных маслах.
НАХОЖДЕНИЕ В ПРИРОДЕ
Слайд 6
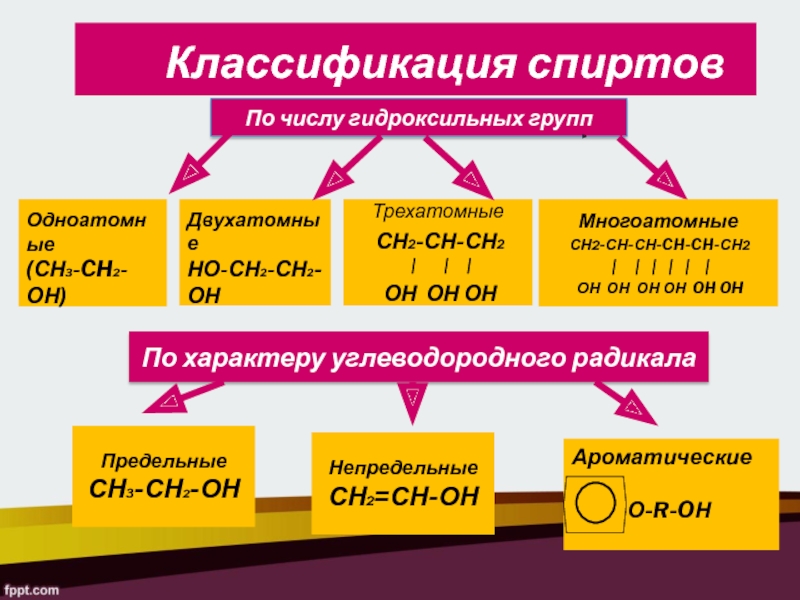
По числу гидроксильных групп
Одноатомные
(СН3-CH2-ОН)
Двухатомные
НО-СН2-СН2-ОН
Трехатомные
СН2-СН-СН2
|
| |
ОН ОН ОН
По характеру
углеводородного радикалаПредельные
СН3-СН2-ОН
Непредельные
СН2=СН-ОН
Ароматические
-СН2-О-R-OН
Классификация спиртов
Многоатомные
СН2-СН-СН-CH-CH-СН2
| | | | | |
ОН ОН ОН ОН OH OH
Слайд 7
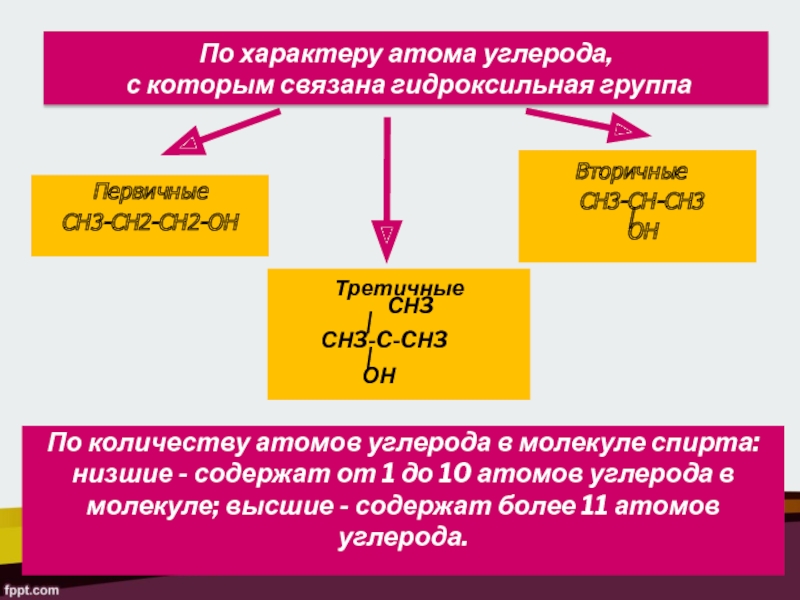
По характеру атома углерода,
с которым связана гидроксильная группа
Первичные
СН3-СН2-СН2-ОН
Вторичные
СН3-СН-СН3
|ОН
Третичные
СН3
|
СН3-C-CН3
|
ОН
По количеству атомов углерода в молекуле спирта: низшие - содержат от 1 до 10 атомов углерода в молекуле; высшие - содержат более 11 атомов углерода.
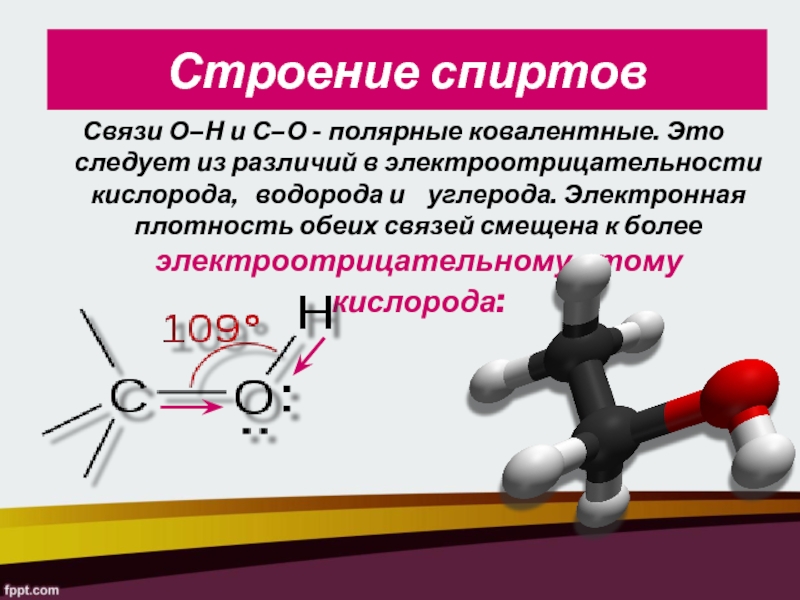
Слайд 8Строение спиртов
Связи О–Н и С–О - полярные ковалентные. Это следует
из различий в электроотрицательности кислорода, водорода и
углерода. Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:Слайд 10ИЗОМЕРИЯ
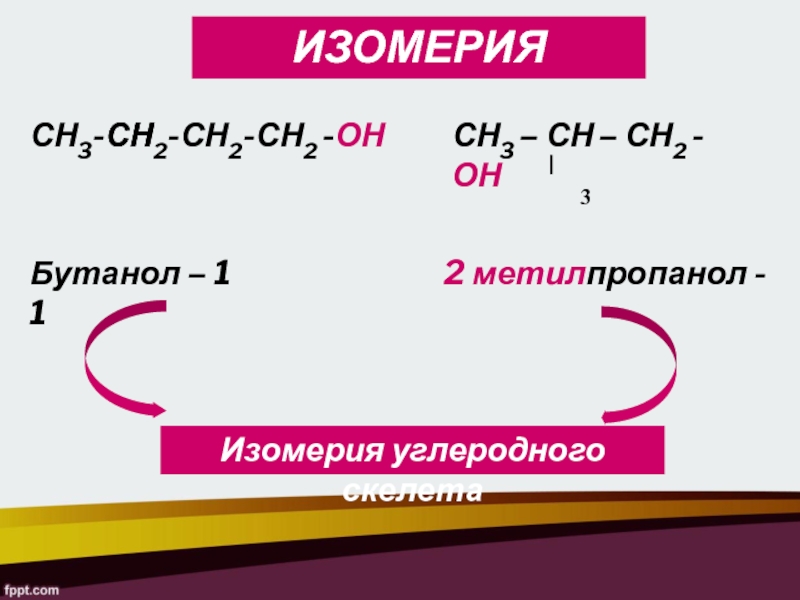
СН3-СН2-СН2-СН2 -ОН
СН3 – СН – СН2 -ОН
Бутанол – 1
2 метилпропанол - 1
Изомерия углеродного скелета
СН
3
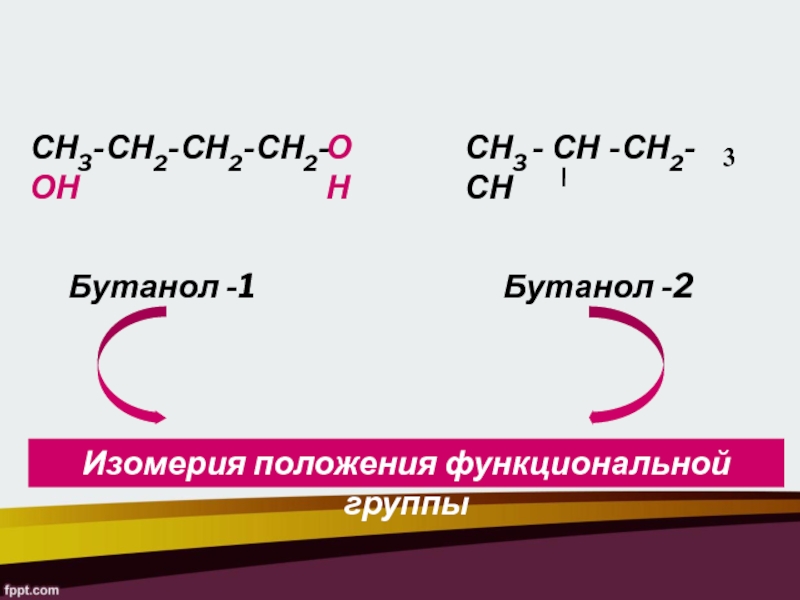
Слайд 11СН3-СН2-СН2-СН2- ОН
СН3 - СН -СН2- СН
3
ОН
Бутанол -1
Бутанол -2
Изомерия положения функциональной группы
Слайд 13Физические свойства
Низшие спирты (до C15) — жидкости, высшие — твердые
вещества.
Метанол и этанол смешиваются с водой в любых соотношениях.
С ростом молекулярной массы растворимость спиртов в воде падает.По сравнению с соответствующими углеводородами, спирты имеют высокие температуры плавления и кипения, что объясняется сильной ассоциацией молекул спирта в жидком состоянии за счет образования водородных связей .
Слайд 14 Водородная связь между атомами водорода одной молекулы и атомом сильно
электроотрицательных элементов (кислорода, фтора) другой молекулы.
▪ ▪ ▪ О-Н ▪
▪ ▪ О-Н ▪ ▪ ▪ О-Н ▪ ▪ ▪│ │ │
R R R
Почему возможна водородная связь у спиртов??
Слайд 15Благодаря полярности гидроксильной группы и наличию в ней электродефицитного атома
водорода, между молекулами спирта возникают водородные связи. Поэтому их молекулы
более ассоциированы – нет твердых веществ, способность образовывать водородные связи с молекулами воды – хорошая растворимость в воде!Слайд 16Получение
1. Самый общий способ получения спиртов, имеющий промышленное значение, —
гидратация алкенов. Реакция идет при пропускании алкена с парами воды
над фосфорнокислым катализатором: H3PO4СН2=СН2 + Н2О → СН3—СН2—ОН
Из этилена получается этиловый спирт, из пропена — изопропиловый. Присоединение воды идет по правилу Марковникова, поэтому из первичных спиртов по данной реакции можно получить только этиловый спирт.
Слайд 172. Другой общий способ получения спиртов — гидролиз алкилгалогенидов под
действием водных растворов щелочей:
R—Br + NaOH → R—OH + NaBr.
По этой реакции можно получать первичные, вторичные и третичные спирты.Получение
Слайд 18Получение
3. Восстановление карбонильных соединений. При восстановлении альдегидов образуются первичный спирты,
при восстановлении кетонов — вторичные:
R—CH=O + Н2 → R—CH2—OH, (1)
R—CO—R'
+ Н2 → R—CH(OH) —R'. (2)Реакцию проводят, пропуская смесь паров альдегида или кетона и водорода над никелевым катализатором.
Слайд 19
4. Действие реактивов Гриньяра на карбонильные соединения .
5. Этанол получают
при спиртовом брожении глюкозы
С6Н12О6 → 2С2Н5ОН + 2СО2↑.
Получение
Слайд 20ХИМИЧЕСКИЕ СВОЙСТВА
Химические свойства спиртов определяются присутствием в их молекулах гидроксильной
группы ОН-.
Связи С-О и О- Н сильно полярны и
способны к разрыву.Различают два основных типа реакций спиртов с участием функциональной группы –ОН-:
Слайд 21проявляются слабые кислотные свойства спиртов
Скорость реакций, при которых разрывается связь
О-Н, уменьшается в ряду: первичные спирты > вторичные > третичные.
Реакции
с разрывом связи О-Н
Слайд 22Кислотные свойства спиртов выражены очень слабо.
Низшие спирты бурно реагируют
со щелочными металлами:
2С2Н5-ОН + 2K→ 2С2Н5-ОK + Н2↑
С увеличением
длины углеводородного радикала скорость этой реакции замедляетсяВ присутствии следов влаги соли спиртов (алкоголяты) разлагаются до исходных спиртов:
С2Н5ОK + Н2О → С2Н5ОН + KОН.
Это доказывает, что спирты — более слабые кислоты, чем вода.
Реакции с разрывом связи О-Н
Спирты не взаимодействуют со щелочами
Слайд 232. При действии на спирты минеральных и органических кислот образуются
сложные эфиры.
Образование сложных эфиров протекает по механизму нуклеофильного присоединения-отщепления
:С2Н5ОН + СН3СООН СН3СООС2Н5 + Н2О Этилацетат
C2H5OH + HONO2 C2H5ONO2 + Н2O Этилнитрат
Отличительной особенностью первой из этих реакций является то, что атом водорода отщепляется от спирта, а группа ОН-- от кислоты).
Реакции с разрывом связи О-Н
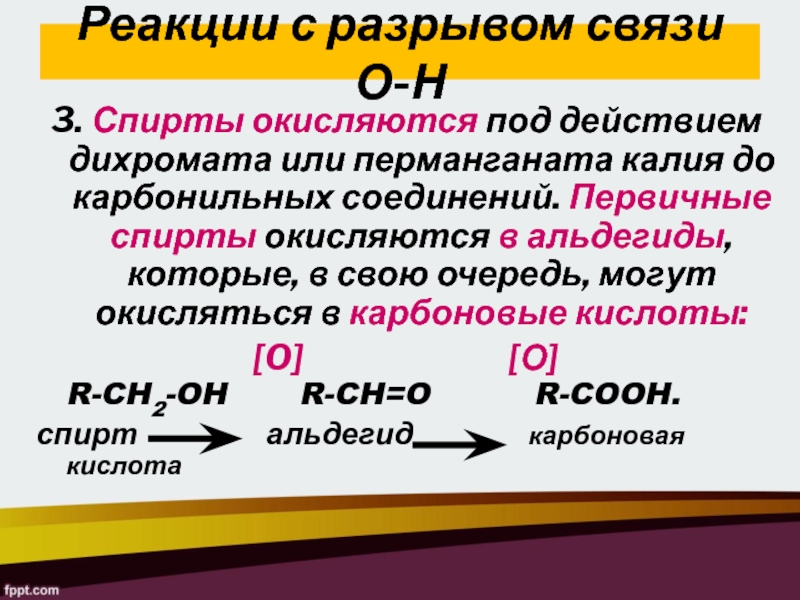
Слайд 24Реакции с разрывом связи О-Н
3. Спирты окисляются под действием дихромата
или перманганата калия до карбонильных соединений. Первичные спирты окисляются в
альдегиды, которые, в свою очередь, могут окисляться в карбоновые кислоты:[O] [О] R-CH2-OH R-CH=O R-COOH.
спирт альдегид карбоновая кислота
Слайд 25Реакции с разрывом связи С-О.
Реакции дегидратации протекают при нагревании
спиртов с водоотнимающими веществами. При сильном нагревании происходит внутримолекулярная дегидратация
с образованием алкенов:H2SO4 ,t >140°С
СН3-СН2-СН2-ОН СН3-СН=СН2 + Н2О.
При более слабом нагревании происходит межмолекулярная дегидратация с образованием простых эфиров:
H2SO4,t< 140°С
2CH3-CH2-OH C2H5-O-C2H5 + H2O.
Слайд 26Спирты обратимо реагируют с галогеноводородными кислотами (здесь проявляются слабые основные
свойства спиртов):
ROH + HCl
RCl + Н2ОТретичные спирты реагируют быстро, вторичные и первичные - медленно.
Реакции с разрывом связи С-О.