Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Серная кислота, свойства серной кислоты
Содержание
- 1. Серная кислота, свойства серной кислоты
- 2. Состав Кислоты - это сложные вещества, в
- 3. Классификация кислотОдноосновные кислоты, например, HCl, HNO3 (отщепляют
- 4. Разбавление серной кислотыОтносительно смешивания серной кислоты с
- 5. S+6O3 – оксид серы (VI), кислотный оксид
- 6. Химические свойства серной кислоты разбавленная серная кислота
- 7. Качественная реакция на ион –SO42-Реактивом на серную
- 8. Концентрированная серная кислотаМе+Н2SO4(кoнц)→МеSO4+H2O+(Н2S,S,SO2)Серная кислота(конц) восстанавливается до(Н2S,S,SO2) в
- 9. Применение серной кислоты.
- 10. Сульфат натрия.
- 11. Сульфат никеля
- 12. Сульфат медидать классификацию химическим реакциям.
- 13. Слайд 13
- 14. Скачать презентанцию
Состав Кислоты - это сложные вещества, в молекулах которых содержат атомы водорода и кислотный остатокH-R, где R-кислотный остатокПри электролитической диссоциации кислот в водном растворе образуются катионы водорода и анион кислотного остатка
Слайды и текст этой презентации
Слайд 2Состав
Кислоты - это сложные вещества, в молекулах которых содержат
атомы водорода и кислотный остаток
кислот в водном растворе образуются катионы водорода и анион кислотного остаткаСлайд 3Классификация кислот
Одноосновные кислоты, например, HCl, HNO3 (отщепляют при диссоциации один
атом водорода)
Многоосновные кислоты, например, H2SO4, H3PO4 (отщепляют при диссоциации несколько
атомов водорода)Кислородные кислоты, например, H2CO3, H3PO4 (отвечают кислотным оксидам и являются фактически кислотными гидроксидами)
Бескислородные кислоты, например, HBr, H2S (относятся к числу бинарных соединений)
Слайд 4Разбавление серной кислоты
Относительно смешивания серной кислоты с водой с давних
пор существует строгое правило: «Сначала вода, потом кислота, иначе произойдет
ужасное».Если же сделать наоборот, то первые же порции воды, оставшись наверху (вода легче кислоты) и взаимодействуя с кислотой, разогреваются так сильно, что вскипают и разбрызгиваются вместе с кислотой; могут попасть в глаза, на лицо и одежду.
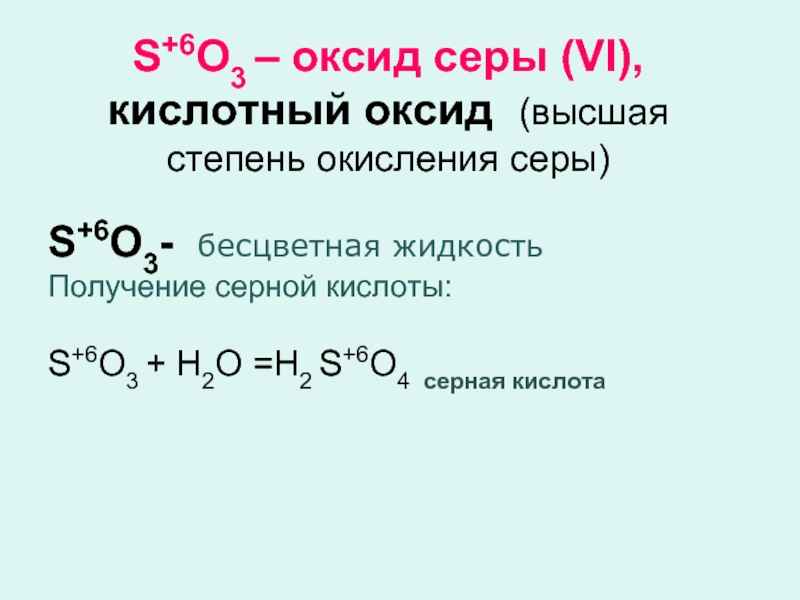
Слайд 5S+6O3 – оксид серы (VI), кислотный оксид (высшая степень окисления
серы)
S+6O3- бесцветная жидкость
Получение серной кислоты:
S+6O3 + Н2О =Н2 S+6O4 серная
кислотаСлайд 6Химические свойства серной кислоты разбавленная серная кислота проявляет все характерные свойства
кислот:
С оксидами металлов.(реакция обмена)
Н2SO4+MeO→MeSO4+H2O
2. С основаниями.(реакция обмена, реакция нейтрализации)
Н2SO4+Me(OН)n→MeSO4+H2O
3. С
металлами.Н2SO4+Me(до Н)→MeSO4(р)+H2↑(реакция замещения)
4.С солями( реакция обмена)
Н2SO4+MeR(Р)→MeSO4 (Р)+HR
(протекает в том случае, если образуется осадок или газ)
Слайд 7Качественная реакция на ион –SO42-
Реактивом на серную кислоту и ее
соли является катион бария , т.к. с ионами бария сульфат
ион образует белый нерастворимый сульфат бария, выпадающий в осадок.Ва2++SO42- = BaSO4↓
Слайд 8Концентрированная серная кислота
Ме+Н2SO4(кoнц)→МеSO4+H2O+(Н2S,S,SO2)
Серная кислота(конц) восстанавливается до
(Н2S,S,SO2) в зависимости от активности
металла и условий протекания реакции.
Железо и алюминий пассивируются кислотой, т.е
покрываются защитной пленкой, поэтому кислоту(конц) можно перевозить в стальных и алюминиевых цистернах.Сu+2H2SO4(конц)→CuSO4+2H2O+SO2
4Zn+5H2SO4(конц)→4ZnSO4+4H2O+H2S
Концентрированная серная кислота способна отнимать воду из молекул органических веществ, обугливая их.
Взаимодействие кислоты с сахарозой(C12H22O11)
C12H22O11 + 2H2SO4(конц) = 11C + 13H2O↑ +2SO2↑ +CO2↑
Теги