Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Типы Химических реакций.
Содержание
- 1. Типы Химических реакций.
- 2. ЦЕЛЬ УРОКА:ПОВТОРИТЬ И ОБОБЩИТЬ ЗНАНИЯ УЧАЩИХСЯ О
- 3. Вопросы для повторенияЧто изучает химия?Что такое химические превращения или химические реакции?Каковы признаки химических реакций?
- 4. ГОРЕНИЕ СВЕЧИПризнак химической реакции: выделение тепла и света
- 5. Реакция между раствором хлорида кальция и раствором щелочи.Признак химической реакции:выпадение белого осадка.
- 6. Действие индикаторов на растворы кислоты, щелочи и воды.Признак химической реакции:изменение окраски индикатора.
- 7. Реакция между раствором перманганата калия и раствором хлорида хрома (II)Признак химической реакции:выпадение зеленого осадка.
- 8. Реакция между раствором хлорида железа (III) и раствором щелочи.Признак химической реакции:выпадение бурого осадка.
- 9. ГОРЕНИЕ СТАЛЬНОЙ ПРОВОЛОКИ В КИСЛОРОДЕПризнак химической реакции: выделение тепла и света
- 10. РЕАКЦИЯ МЕДИ С АЗОТНОЙ КИСЛОТОЙПризнак химической реакции: выделение бурого газа
- 11. *Условия, необходимые для осуществления химической реакции:Соприкосновение веществПеремешивание веществОпределенная температура
- 12. *Вопросы для повторенияЧто такое химическое уравнение? Какие
- 13. Типы химических реакций: Соединение РазложениеЗамещение Обмен
- 14. Реакция соединения. АВ+Реакция соединения -это реакция,
- 15. Реакция соединения. CuO2+Реакция соединения -это реакция,
- 16. Реакция разложенияАВ+Реакция разложения - это реакция,
- 17. Реакция разложенияH2O2+Реакция разложения - это реакция,
- 18. Реакция замещенияА +ВС Реакция
- 19. Реакция замещенияFe +HCl Реакция
- 20. Реакция обменаAВ+СДРеакция обмена - это реакция, при которой два сложных вещества обмениваются своими составными частями.
- 21. Реакция обменаAgNO3+HClРеакция обмена - это реакция, при которой два сложных вещества обмениваются своими составными частями.
- 22. С какими типами химических реакций мы сегодня
- 23. Определите типы реакцийCu + CI2 → CuCI2 2Fe + 3CI2 → 2FeCI3
- 24. Определите типы реакцийSiO2 + Mg → MgO + SiSiO2 + 2Mg → 2MgO + SiРеакция замещения
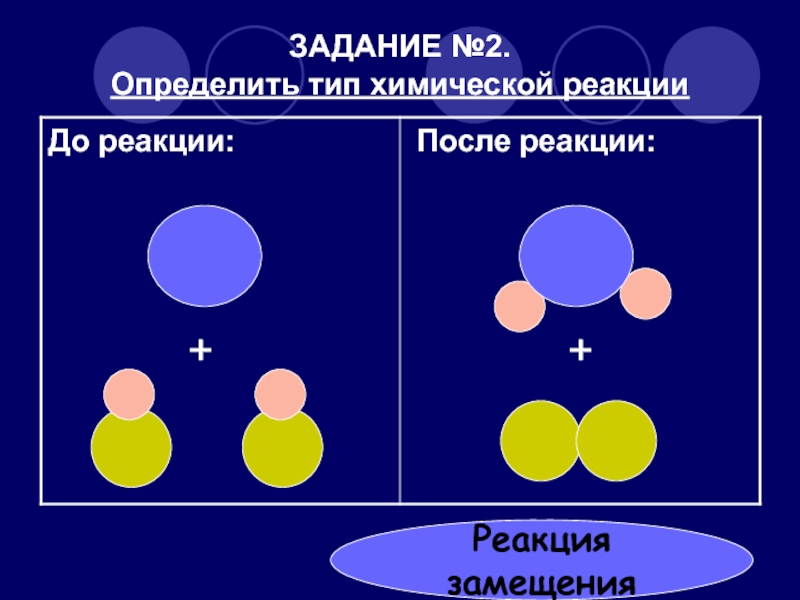
- 25. ЗАДАНИЕ №2. Определить тип химической реакции++Реакция замещения
- 26. Игра «ТРЕТИЙ ЛИШНИЙ-1»1. 2NaCl = 2Na +
- 27. Игра «ТРЕТИЙ ЛИШНИЙ-2»1.2CuO + C = 2Cu
- 28. ЗАДАНИЕЦарь зовет к себе Стрельца - удалого
- 29. AI + S = AI2S3 2AI + 3S = AI2S3 реакция соединения
- 30. Лабораторная работа
- 31. Техника безопасности
- 32. Лабораторный опыт
- 33. Напишите уравнение реакции и определите тип реакцииCuSO4
- 34. Лабораторный опыт t0 →
- 35. Напишите уравнение реакции и определите тип реакции
- 36. Проверочная работа
- 37. Задание № 1 Расставьте коэффициенты и определите тип реакции в следующих уравнениях реакций:
- 38. 1 вариантРасставьте коэффициенты и определите тип реакции
- 39. 2 вариантРасставьте коэффициенты и определите тип реакции
- 40. 1 вариант2. Приведены схемы реакций. Составьте уравнения химических
- 41. 2 вариант2. Приведены схемы реакций. Составьте уравнения химических
- 42. 1 вариант3. Выберите на ваш взгляд, правильный ответ.
- 43. 2 вариант3. Выберите на ваш взгляд, правильный ответ.
- 44. Проверка выполненной работы
- 45. 1 вариантА) 2Cu + O2 =
- 46. 2 вариантА) 2Ва + O2 =
- 47. Домашнее задание:§ 29; § 30, упр. 1
- 48. Что вам сегодня понравилось на уроке?
- 49. Спасибо за работу на уроке!Урок окончен. До свидания!
- 50. Скачать презентанцию
ЦЕЛЬ УРОКА:ПОВТОРИТЬ И ОБОБЩИТЬ ЗНАНИЯ УЧАЩИХСЯ О ХИМИЧЕСКИХ ПРЕВРАЩЕНИЯХ, ПРИЗНАКАХ И ТИПАХ ХИМИЧЕСКИХ РЕАКЦИЙ. ЗАКРЕПИТЬ НАВЫКИ СОСТАВЛЕНИЯ ХИМИЧЕСКИХ УРАВНЕНИЙ. ПРОДОЛЖИТЬ ФОРМИРОВАНИЕ ПРАКТИЧЕСКИХ НАВЫКОВ ПРИ ВЫПОЛНЕНИИ ЛАБОРАТОРНЫХ ОПЫТОВ.
Слайды и текст этой презентации
Слайд 3Вопросы для повторения
Что изучает химия?
Что такое химические превращения или химические
реакции?
Каковы признаки химических реакций?
Слайд 5Реакция между раствором хлорида кальция и раствором щелочи.
Признак химической реакции:
выпадение
белого осадка.
Слайд 6Действие индикаторов на растворы кислоты, щелочи и воды.
Признак химической
реакции:
изменение окраски индикатора.
Слайд 7Реакция между раствором перманганата калия и раствором хлорида хрома (II)
Признак
химической реакции:
выпадение зеленого осадка.
Слайд 8Реакция между раствором хлорида железа (III) и раствором щелочи.
Признак химической
реакции:
выпадение бурого осадка.
Слайд 11*
Условия, необходимые для осуществления химической реакции:
Соприкосновение веществ
Перемешивание веществ
Определенная температура
Слайд 12*
Вопросы для повторения
Что такое химическое уравнение?
Какие реакции называются реакциями
соединения?
Какие реакции называются реакциями разложения?
Какие реакции называются реакциями замещения?
Какие
реакции называются реакциями обмена?Слайд 14 Реакция соединения.
А
В
+
Реакция соединения -это реакция, при которой из
двух или нескольких простых веществ образуется одно сложное вещество.
Слайд 15 Реакция соединения.
Cu
O
2
+
Реакция соединения -это реакция, при которой из
двух или нескольких простых веществ образуется одно сложное вещество.
Слайд 16 Реакция разложения
А
В
+
Реакция разложения - это реакция, при которой одно
сложное вещество распадается на два или несколько простых или сложных
веществ.Слайд 17 Реакция разложения
H2
O
2
+
Реакция разложения - это реакция, при которой одно
сложное вещество распадается на два или несколько простых или сложных
веществ.Слайд 18 Реакция замещения
А
+
В
С
Реакция замещения -это реакция,
при которой атомы простого вещества замещают атомы в сложном веществе
Слайд 19 Реакция замещения
Fe
+
H
Cl
Реакция замещения -это реакция,
при которой атомы простого вещества замещают атомы в сложном веществе
2
2
Слайд 20Реакция обмена
A
В
+
С
Д
Реакция обмена - это реакция, при которой два сложных
вещества обмениваются своими составными частями.
Слайд 21Реакция обмена
Ag
NO3
+
H
Cl
Реакция обмена - это реакция, при которой два сложных
вещества обмениваются своими составными частями.
Слайд 22С какими типами химических реакций мы сегодня познакомились?
Соединение
Разложение
Замещение
Обмен
Слайд 26Игра «ТРЕТИЙ ЛИШНИЙ-1»
1. 2NaCl = 2Na + Cl2
2. CaO +
CO2 = CaCO3
3. C + O2 =CO2
Ответ:
2NaCl = 2Na +
Cl2Слайд 27Игра «ТРЕТИЙ ЛИШНИЙ-2»
1.2CuO + C = 2Cu + O2
2. 2NO
+ O2 = 2NO2
3. Mg +H2S = MgS + H2
Ответ:
2NO
+ O2 = 2NO2Слайд 28ЗАДАНИЕ
Царь зовет к себе Стрельца - удалого молодца
И дает
ему поручение государственного значения:
«Чтоб я стал очень богат, нужен мне
алюминия
сульфидНочь даю тебе подумать, утром буду ждать доклад!
Не смогешь – кого винить? Должен я тебя казнить.
Запиши себе названье, чтоб со страху не забыть».
Напишите уравнение реакции получения сульфида алюминия.
Укажите тип реакции.
Слайд 33Напишите уравнение реакции и определите тип реакции
CuSO4 + NaOH →
Cu(OH)2 + Na2SO4
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
Тип реакции
– реакция обменаСлайд 35Напишите уравнение реакции и определите тип реакции
t0
Cu(OH)2 → CuO
+ H2OТип реакции – реакция разложения
Слайд 37Задание № 1
Расставьте коэффициенты и определите тип реакции в следующих
уравнениях реакций:
Слайд 381 вариант
Расставьте коэффициенты и определите тип реакции в следующих уравнениях
реакций:
А) Cu + O2 =; Б) NaOH + HNO3 =;
В)
H2 + CuO =; Г) Ag2O =; Ж) MgO + HF=.
Слайд 392 вариант
Расставьте коэффициенты и определите тип реакции в следующих уравнениях
реакций: А) Ва + O2 =; Б) KOH + H3PO4 =;
В) H2 + FeO =; Г) HgO =;
Д) BaO + HBr =.
Слайд 401 вариант
2. Приведены схемы реакций. Составьте уравнения химических реакций, расставьте коэффициенты
и укажите их тип: а) нитрат серебра + хлорид железа (III)
→ → хлорид серебра + нитрат железа (III); б) гидроксид свинца (II) → оксид свинца (II) + вода.Слайд 412 вариант
2. Приведены схемы реакций. Составьте уравнения химических реакций, расставьте коэффициенты
и укажите их тип: а) нитрат бария + сульфат натрия →
→ сульфат бария + нитрат натрия; б) оксид лития + вода → гидроксид лития.Слайд 421 вариант
3. Выберите на ваш взгляд, правильный ответ.
В реакциях обмена
могут образоваться: а) несколько простых веществ; б) два сложных вещества; в) одно сложное
вещество; г) одно простое вещество.Слайд 432 вариант
3. Выберите на ваш взгляд, правильный ответ.
В реакции замещения
могут вступать: а) одно простое и одно сложное вещество; б) одно сложное
вещество; в) несколько простых веществ; г) несколько сложных веществ.Слайд 451 вариант
А) 2Cu + O2 = 2CuO – соединение
Б)
NaOH + HNO3 = NaNO3 + H2O – обмен В)
Н2 + FeO = Fe + Н2O - замещение Г) 2Ag2O= 4Ag + O2 – разложение Д) MgO + 2HF = MgF2 + H2O - обменА) 3AgNO3 + FeCI3 = 3AgCI +Fe(NO3)3 (обмен) Б) Pb(OH)2 = PbO + H 2O (разложение)
Ответ: Б
Слайд 462 вариант
А) 2Ва + O2 = 2ВаO – соединение
Б)
3КOH + H3РО4 = К3РO4 + 3H2O – обмен В)
H2 + FeO = Fe +H2 O – замещение Г) 2HgO= 2Hg + O2 – разложение Д) ВаO + 2HВr = BaBr2 + H2O - обменА) Ва(NO3)2 + FeCI 3 = 3AgCI +Fe(NO3)3 (обмен) Б) Li2O + H2O = 2LiOH (соединение)
Ответ: А