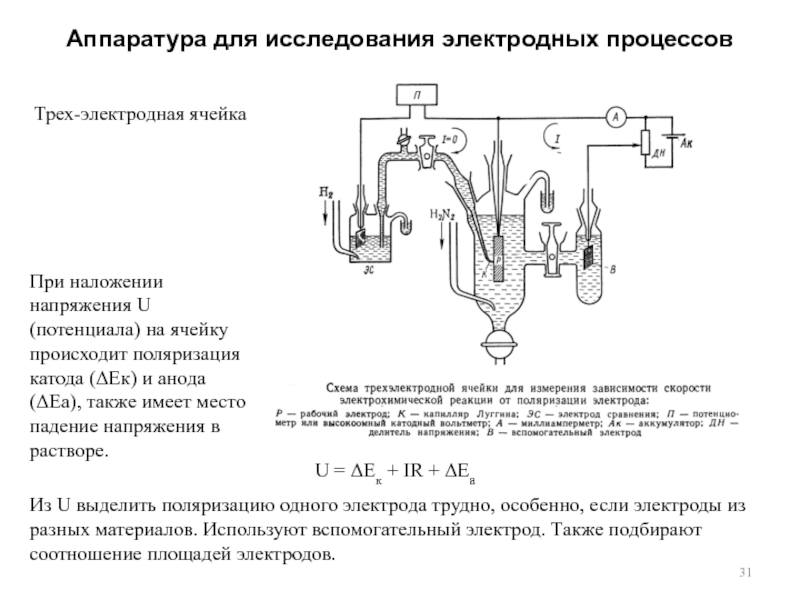
процессов. Собственно электродная реакция или стадия разряда-ионизации. Процессы, сопутствующие электродной
реакции. Процессы, осложняющие электродную реакцию.2. Кинетика электродных процессов. Факторы, оказывающие влияние на кинетику электродных процессов.
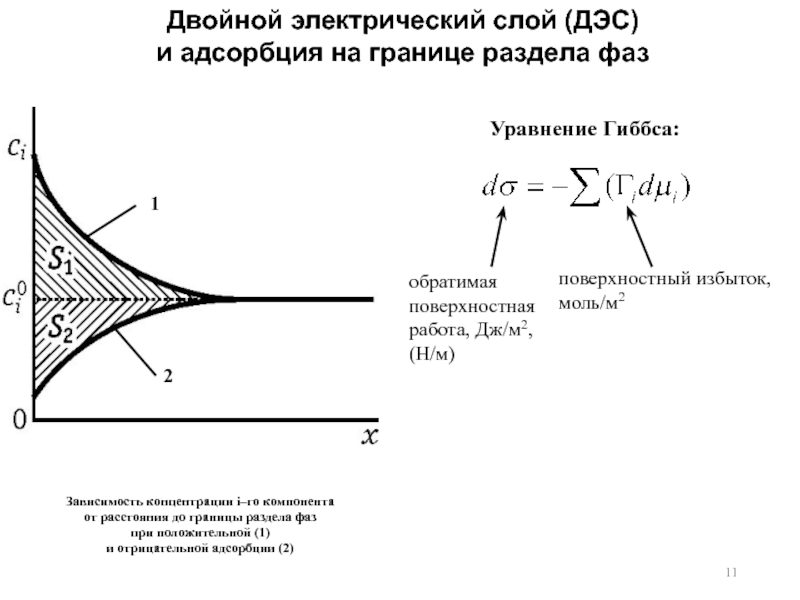
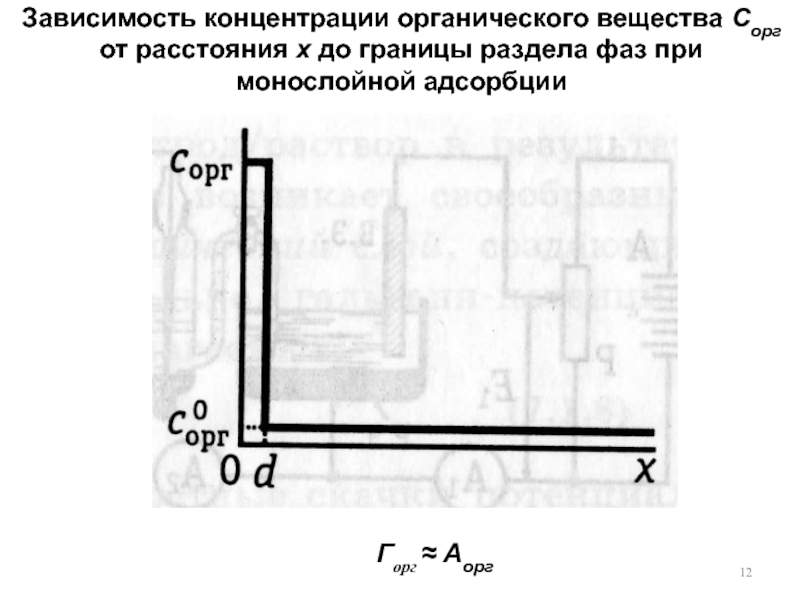
3. Двойной электрический слой (ДЭС). Причина возникновения. Примеры проявления. Потенциал нулевого заряда. Методы изучения ДЭС. Емкость ДЭС.
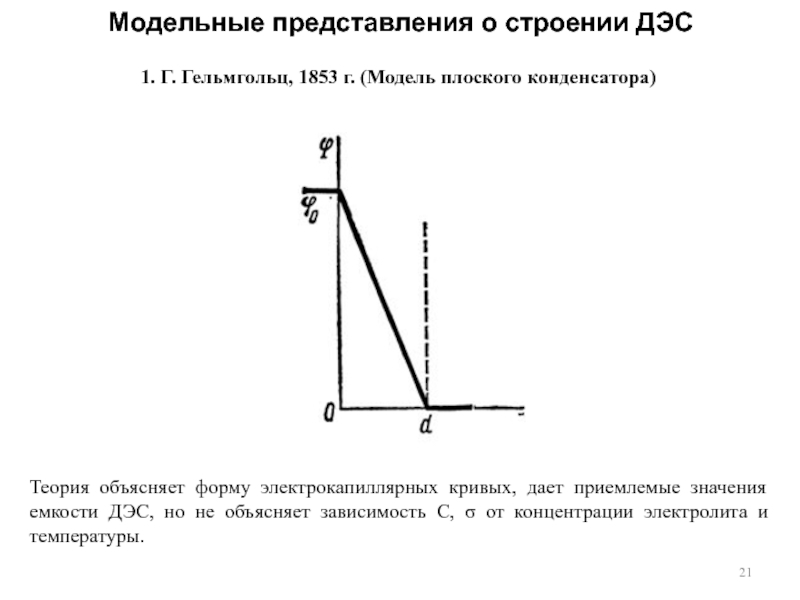
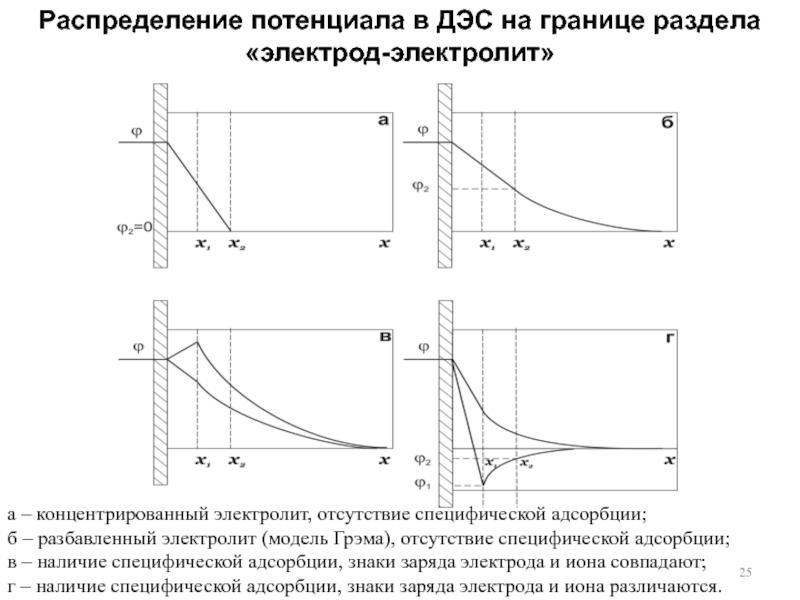
4. Структура ДЭС. Модель Гельмгольца. Модель Гуи-Чапмена. Модель Штерна. Модель Грэма.
5. Кинетические закономерности стадии разряда-ионизации. Катодные процессы, анодные процессы. Фарадеевские токи и токи заряжения. Поляризация и перенапряжение. Система знаков.