Cr2(SO4)3 + H2O + S + K2SO4
Метод электронно-ионного баланса
а) записывают формулы реагентов данной реакции
и устанавливают химическую функцию каждого из них (окислитель, кислотная среда реакции, восстановитель);б) записывают формулы реагентов в ионном виде, указывая только те ионы, молекулы и формульные единицы, которые примут участие в реакции в качестве окислителя, среды и восстановителя
в) определяют восстановленную форму окислителя и окисленную форму восстановителя, составляют электронно-ионные уравнения полуреакций восстановления и окисления
г) суммируя уравнения полуреакций, составляют ионное уравнение данной реакции,
д) на основе ионного уравнения составляют молекулярное уравнение данной реакции
е) проводят проверку подобранных коэффициентов









![1
16.05.2016
Урок 8 класса
Электронно-ионный баланс
И
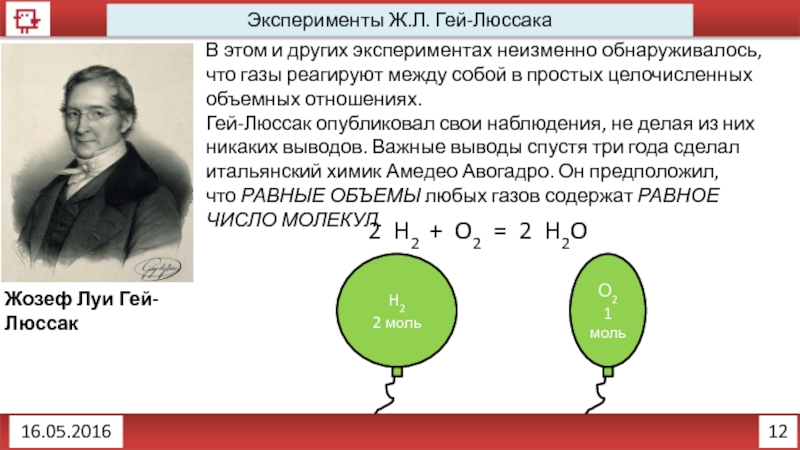
Закон Авогадро 1016.05.2016Закон состояния идеального газаPV = νRTν – количество вещества, [моль]P – 1016.05.2016Закон состояния идеального газаPV = νRTν – количество вещества, [моль]P – давление, [Па]V – объём, [м3]R –](/img/thumbs/be3a52ee701080e081ddee7f7f2a7644-800x.jpg)