Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
lektsia_5.ppt
Содержание
- 1. lektsia_5.ppt
- 2. План5.1. Реакции SE для бензоидных ароматических соединений5.2. Ориентирующее влияние заместителей5.3. Реакции SE в гетероциклических соединениях
- 3. Электрофильное замещение при атоме углерода в sp2-гибридизации
- 4. Соединения с двойными связями неароматического характера гораздо легче вступают в реакции электрофильного присоединения, чем замещения
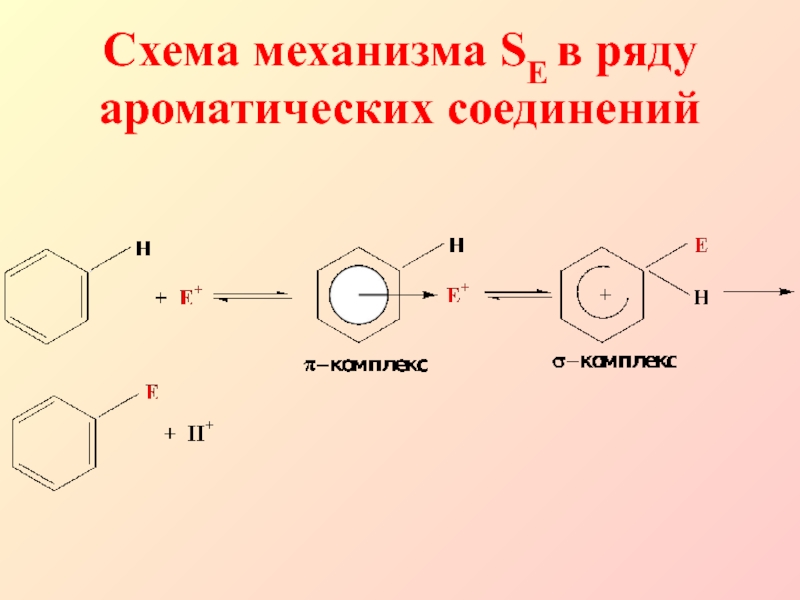
- 5. Схема механизма SE в ряду ароматических соединений
- 6. Электрофильное замещение в ароматическом ряду начинается с
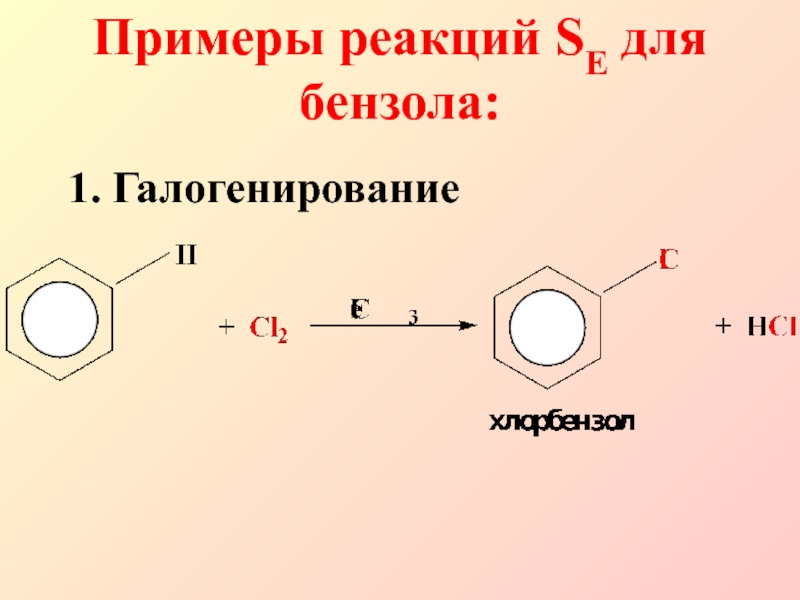
- 7. 1. ГалогенированиеПримеры реакций SE для бензола:
- 8. В качестве электрофила выступает либо комплекс галогена
- 9. В организме по механизму SЕ протекает очень
- 10. Слайд 10
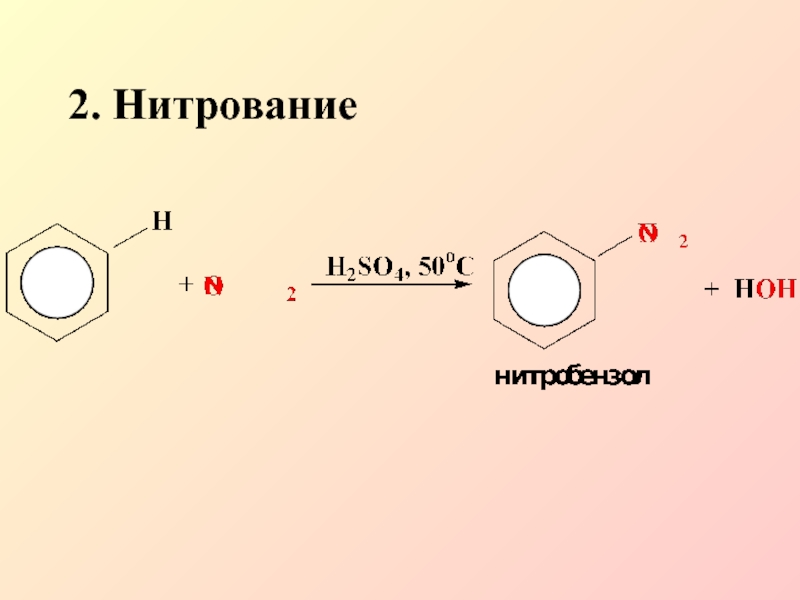
- 11. 2. Нитрование
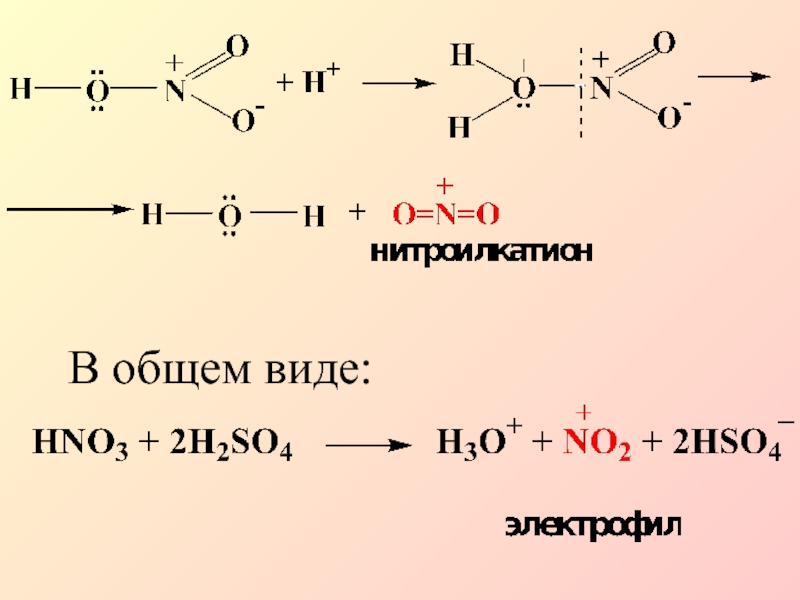
- 12. В общем виде:
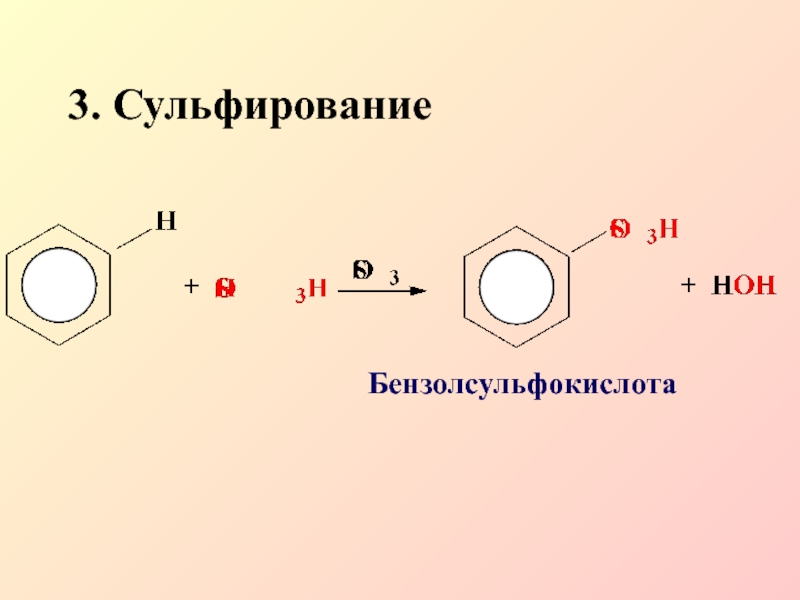
- 13. 3. СульфированиеБензолсульфокислота
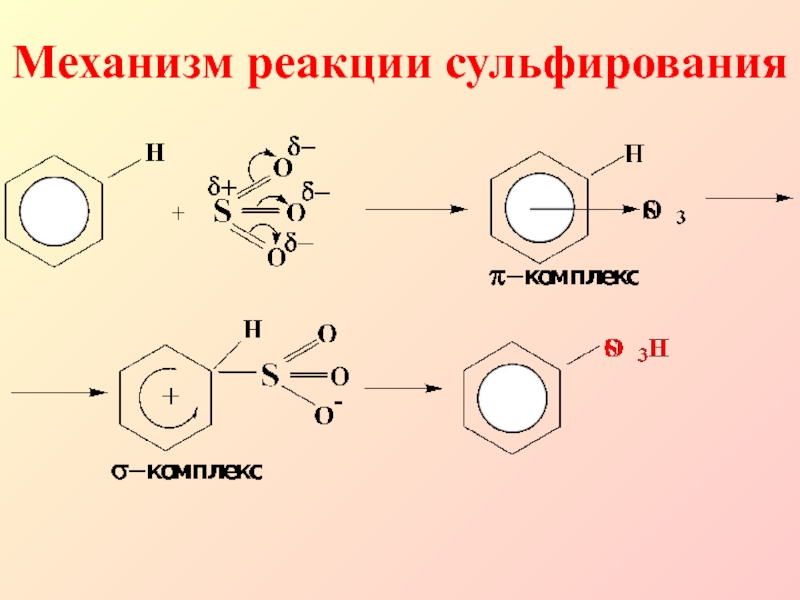
- 14. Механизм реакции сульфирования
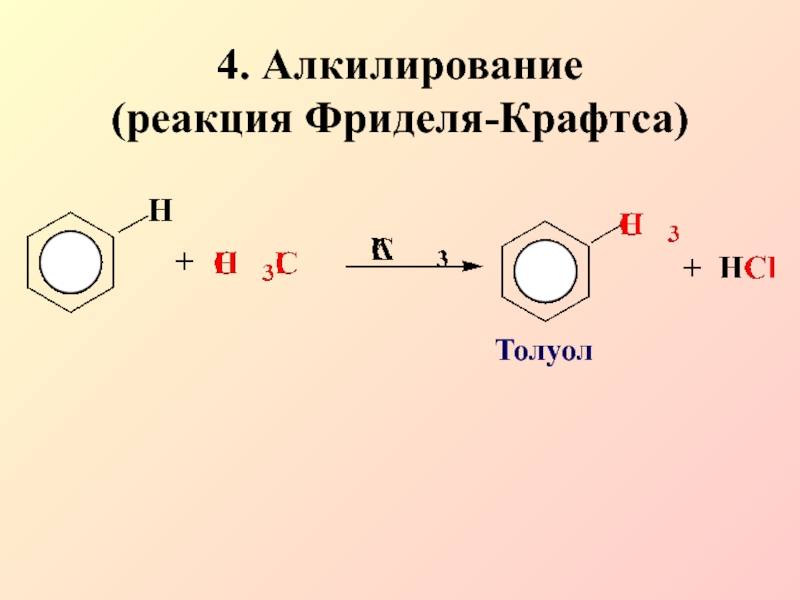
- 15. 4. Алкилирование (реакция Фриделя-Крафтса)Толуол
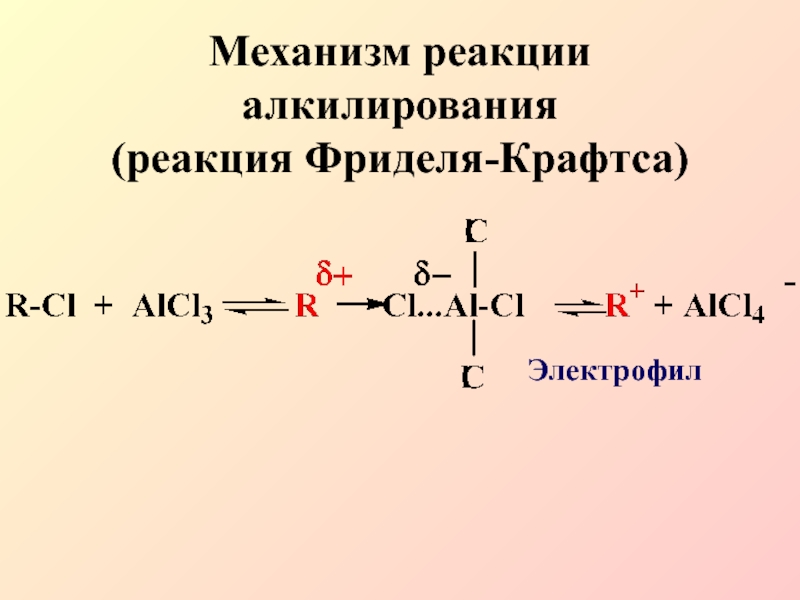
- 16. Механизм реакции алкилирования (реакция Фриделя-Крафтса)Электрофил
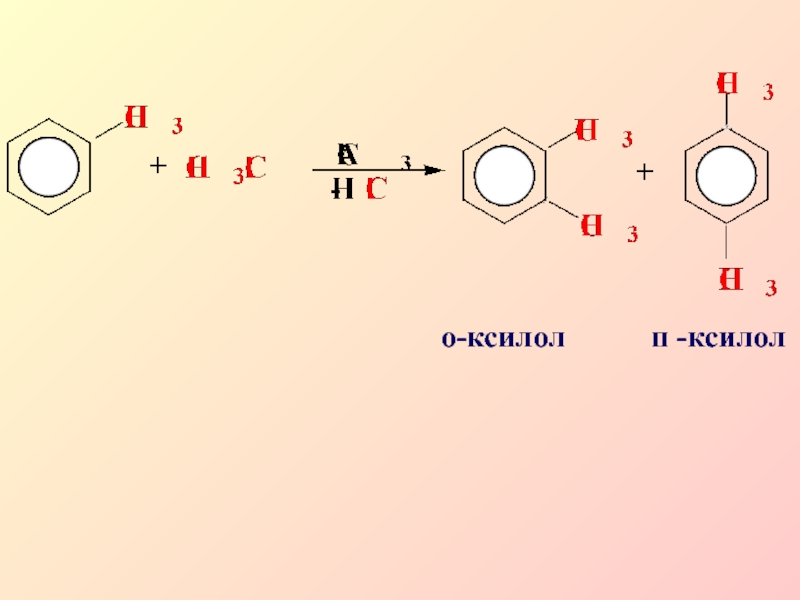
- 17. о-ксилол п -ксилол
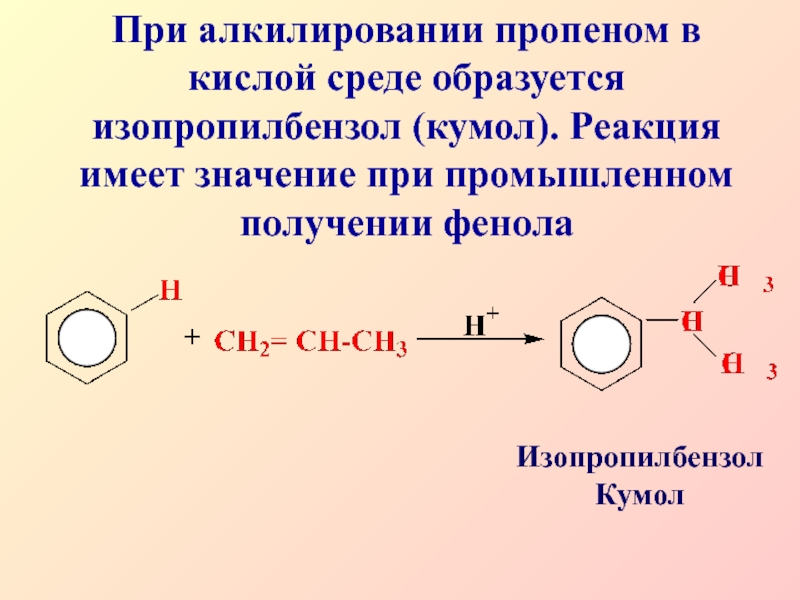
- 18. При алкилировании пропеном в кислой среде образуется
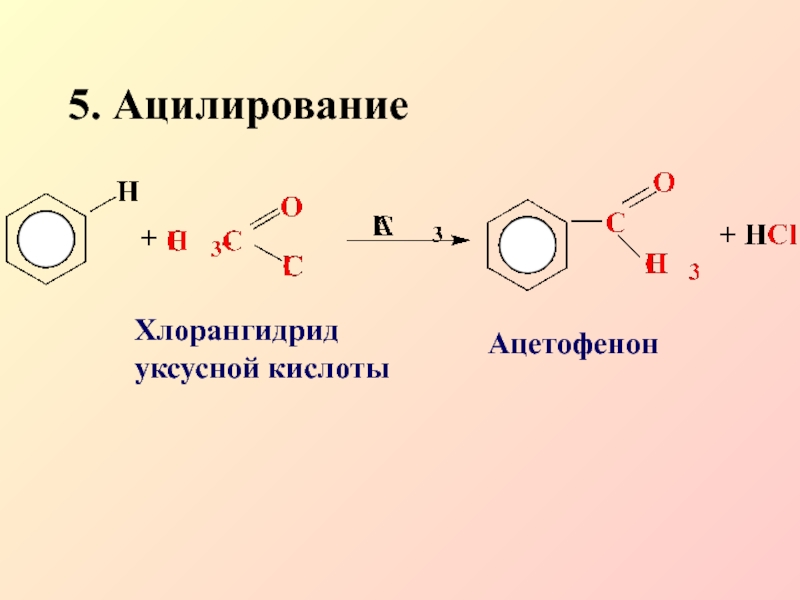
- 19. 5. АцилированиеХлорангидрид уксусной кислотыАцетофенон
- 20. 5.2. Ориентирующее влияние заместителей Заместители делят на две группы:
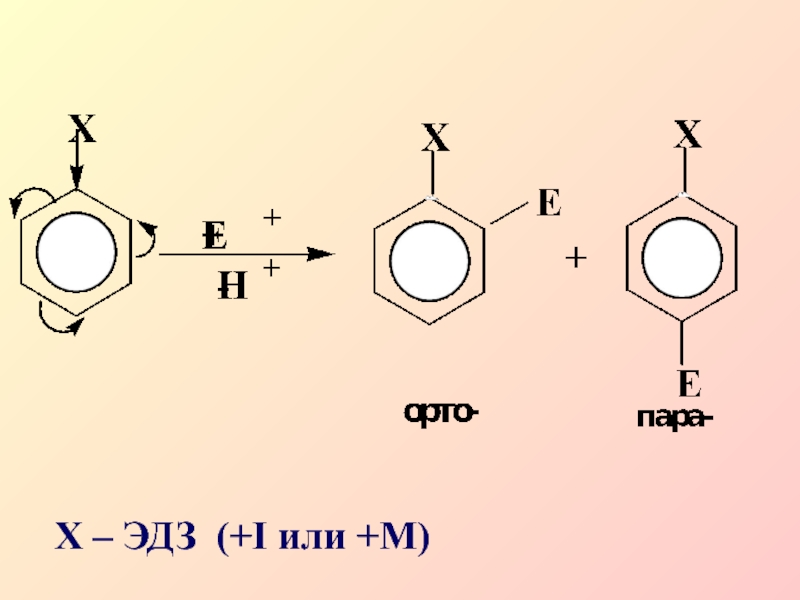
- 21. 1. Ориентанты I-рода, электронодонорные заместители
- 22. Заместители I рода облегчают электрофильное замещение по
- 23. Х – ЭДЗ (+I или +M)
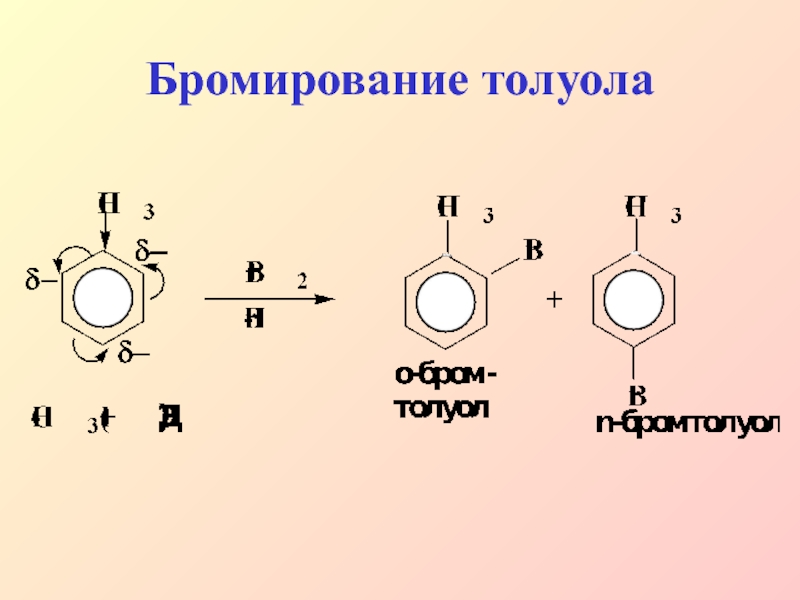
- 24. Бромирование толуола
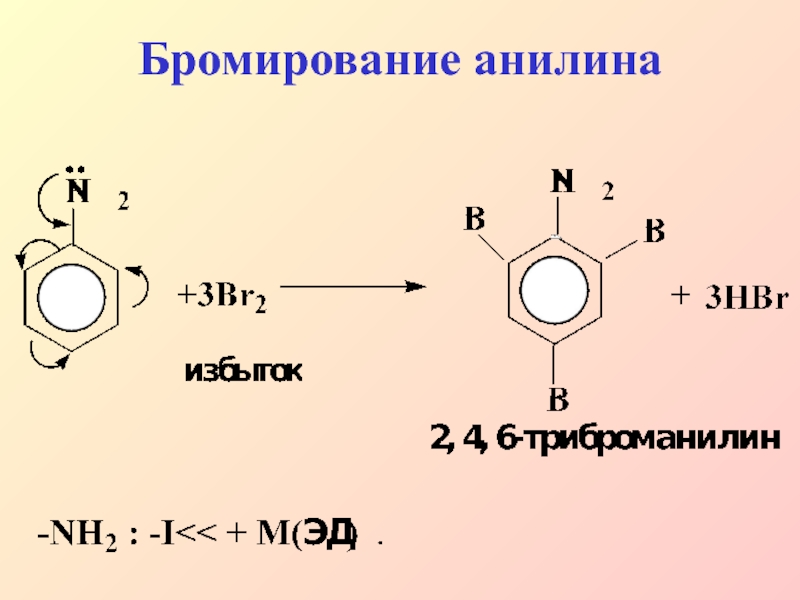
- 25. Бромирование анилина
- 26. 2.Ориентанты II рода, электроноакцепторные заместители проявляют
- 27. Заместители II рода затрудняют реакции электрофильного замещения
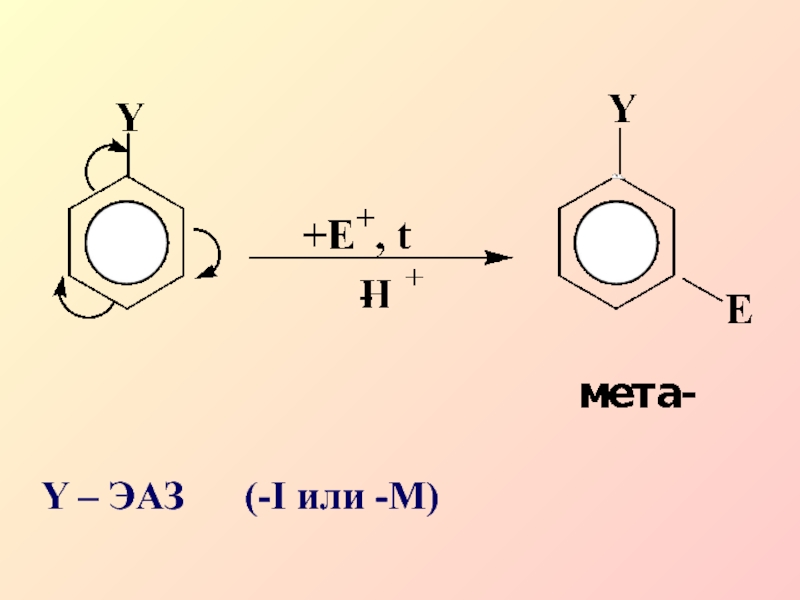
- 28. Y – ЭАЗ (-I или -M)
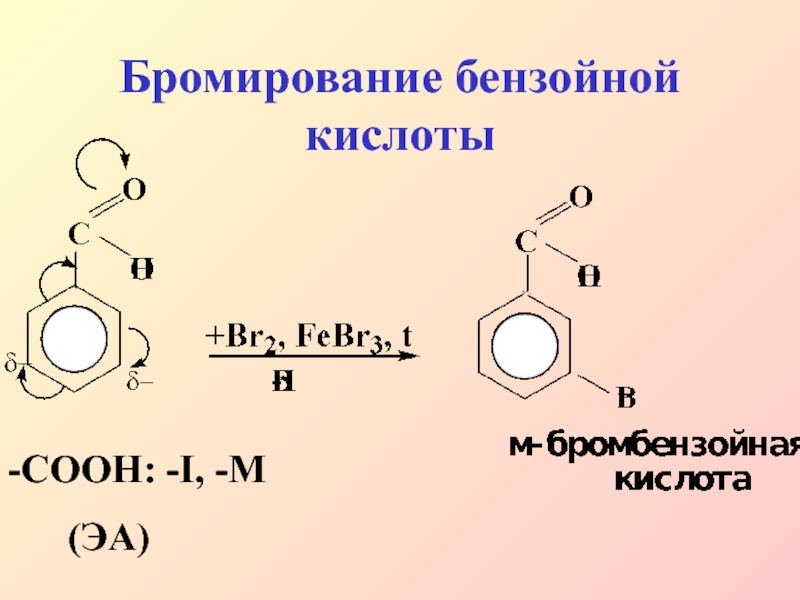
- 29. Бромирование бензойной кислоты-СООН: -I, -M (ЭА)
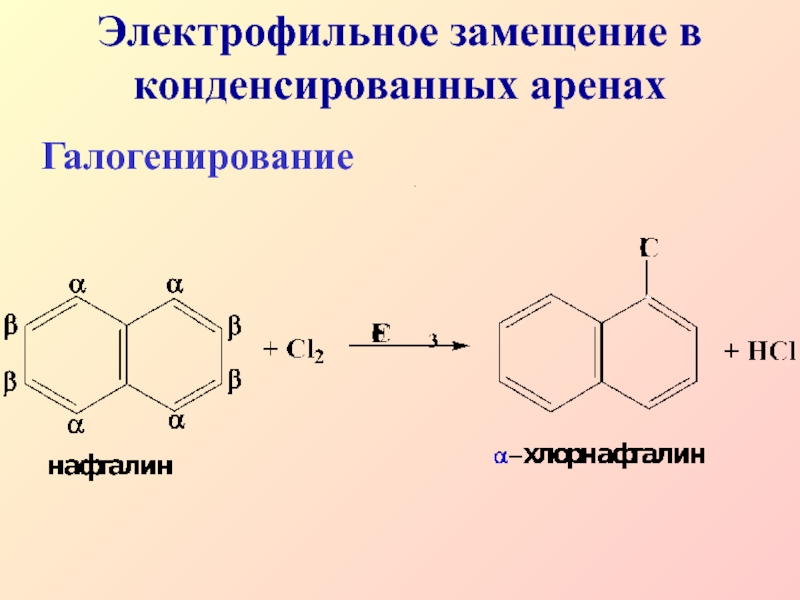
- 30. Электрофильное замещение в конденсированных аренахГалогенирование.
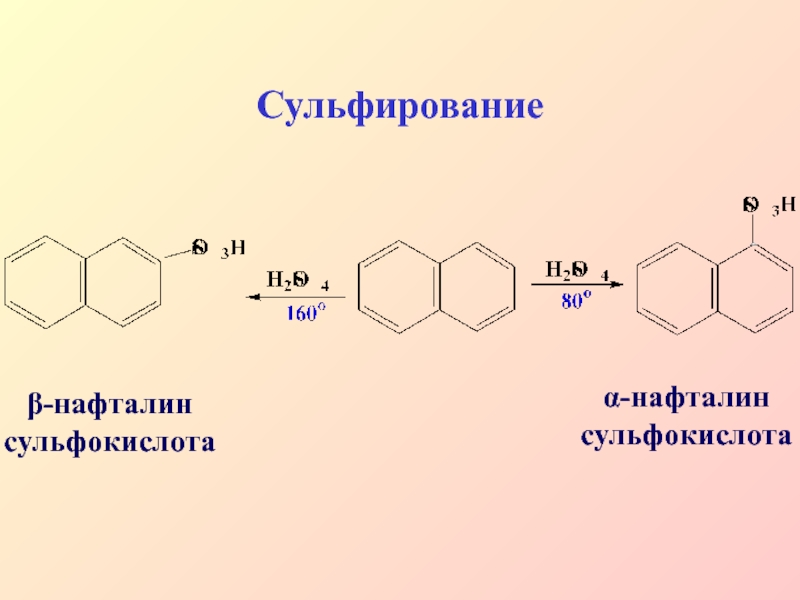
- 31. Сульфированиеα-нафталин сульфокислотаβ-нафталин сульфокислота
- 32. 5.3. Реакции SE в гетероциклических соединениях
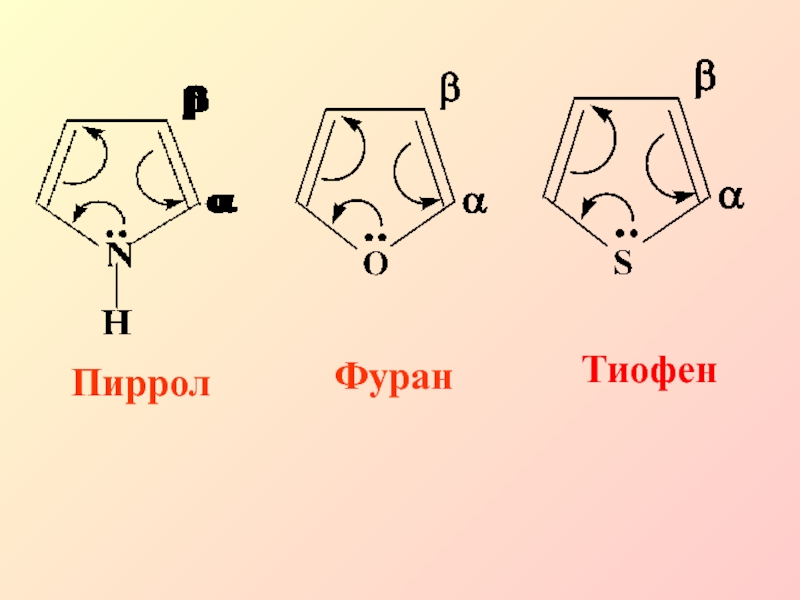
- 33. Пиррол, фуран и тиофен по сравнению с
- 34. ПирролФуранТиофен
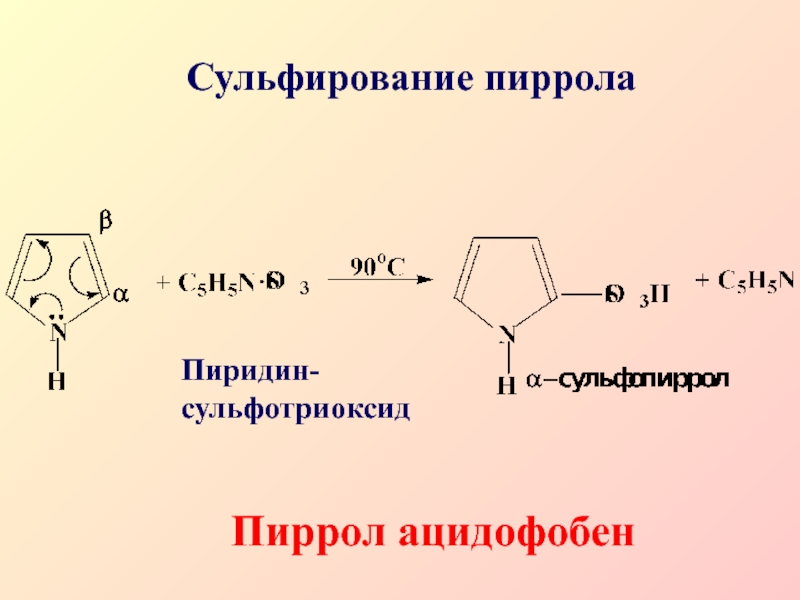
- 35. Сульфирование пиррола Пиридин- сульфотриоксидПиррол ацидофобен
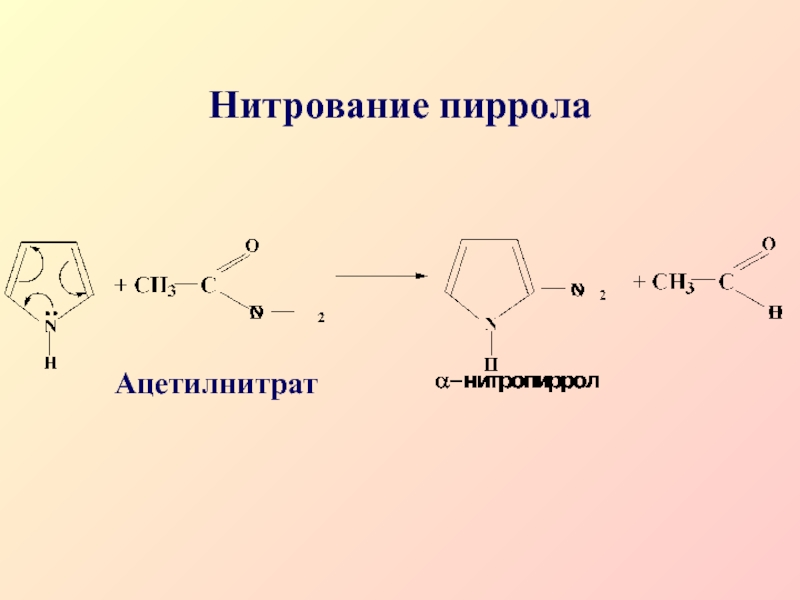
- 36. Нитрование пирролаАцетилнитрат
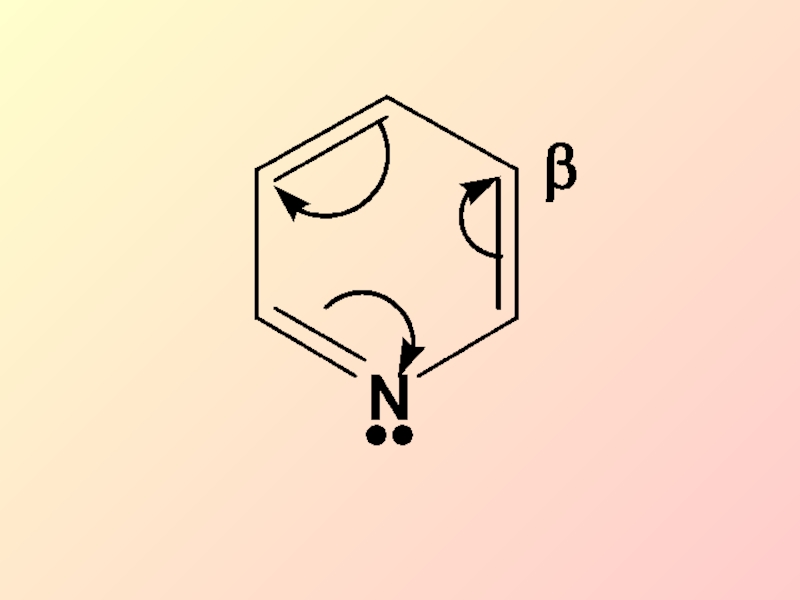
- 37. Пиридин является π-недостаточной ароматической системой. Общая электронная
- 38. Слайд 38
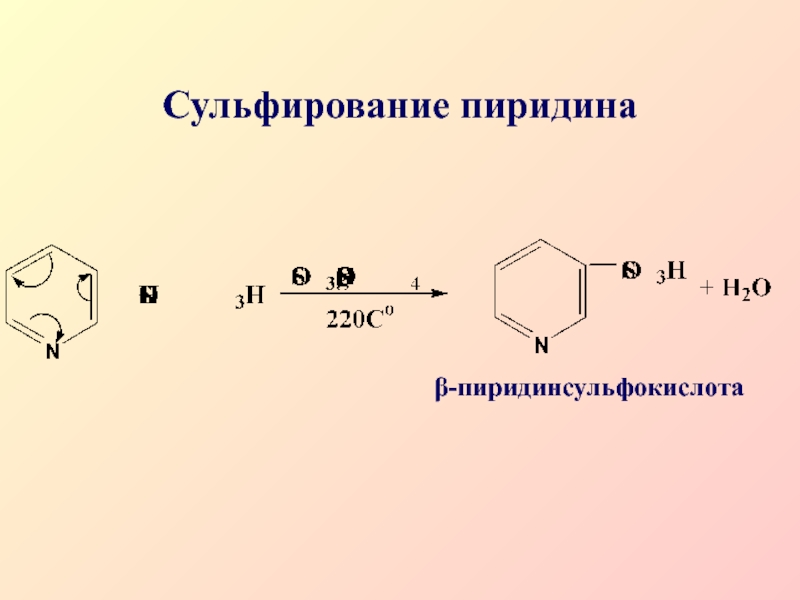
- 39. Сульфирование пиридинаβ-пиридинсульфокислота
- 40. Никотиновая кислота Пиридин-3-карбоновая
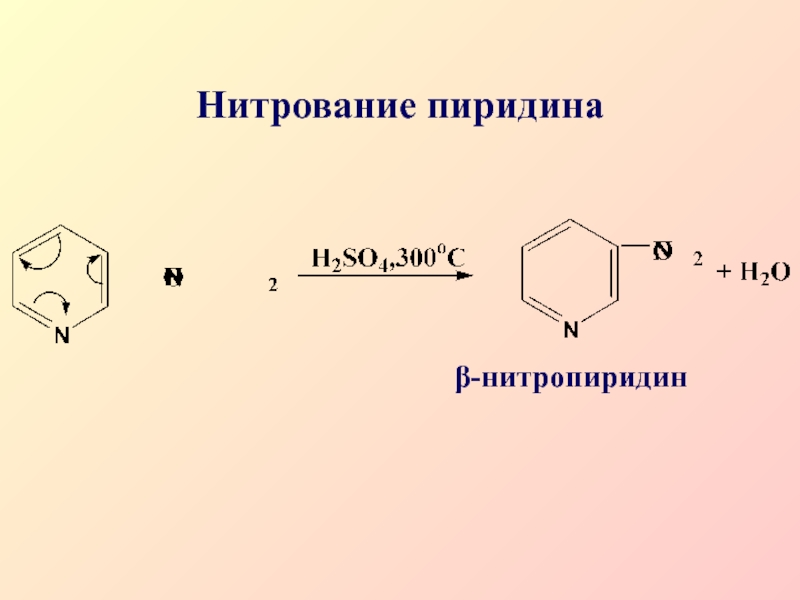
- 41. Нитрование пиридинаβ-нитропиридин
- 42. Благодарим за внимание !
- 43. Скачать презентанцию
План5.1. Реакции SE для бензоидных ароматических соединений5.2. Ориентирующее влияние заместителей5.3. Реакции SE в гетероциклических соединениях
Слайды и текст этой презентации
Слайд 2План
5.1. Реакции SE для бензоидных ароматических соединений
5.2. Ориентирующее влияние заместителей
5.3.
Реакции SE в гетероциклических соединениях
Слайд 3Электрофильное замещение при атоме углерода в sp2-гибридизации наиболее характерно для
ароматических соединений
5.1. Реакции SE для бензоидных ароматических соединений
Слайд 4Соединения с двойными связями неароматического характера гораздо легче вступают в
реакции электрофильного присоединения, чем замещения
Слайд 6Электрофильное замещение в ароматическом ряду начинается с атаки π-электронной системы
ароматического кольца электрофильной частицей (для этого нужны сильные электрофилы, которые,
как правило, генерируются с помощью катализатора)Слайд 8В качестве электрофила выступает либо комплекс галогена с кислотой Льюиса
(FeCl3), либо катион, образующийся в результате диссоциации этого комплекса
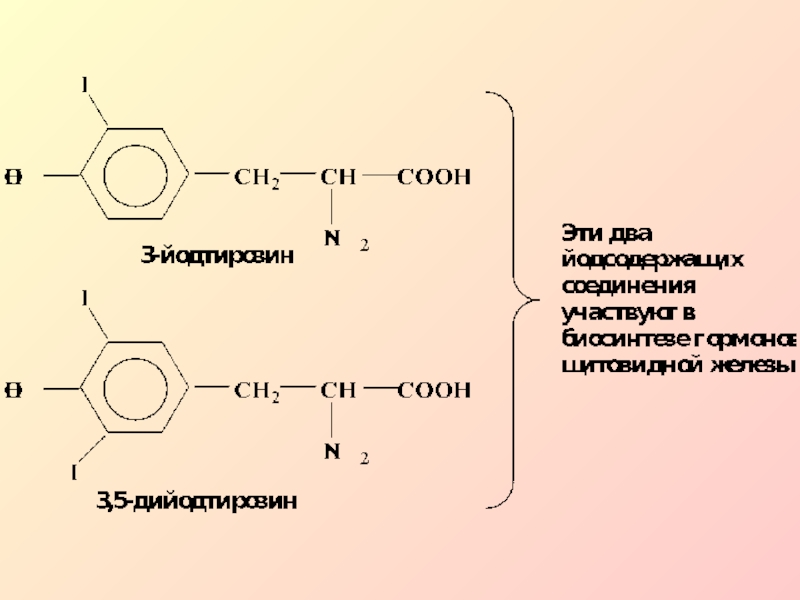
Слайд 9В организме по механизму SЕ протекает очень важная реакция иодирования.
Гормоны
щитовидной железы имеют в своем составе иодпроизводное одной из α-аминокислот
– тирозинаСлайд 18
При алкилировании пропеном в кислой среде образуется изопропилбензол (кумол). Реакция
имеет значение при промышленном получении фенола
Изопропилбензол Кумол
Слайд 21
1. Ориентанты I-рода, электронодонорные заместители
алкильные
группы, проявляющие
+I эффект и группы, проявляющие +М эффект:
–ОН; –ОR;
–NН2; –NR2Слайд 22
Заместители I рода облегчают электрофильное замещение по сравнению с незамещенным
бензолом и направляют новые заместители в орто- и пара-положения.
Слайд 262.Ориентанты II рода, электроноакцепторные заместители проявляют –I и –М эффекты:
–NO2; –SO3H; –CN; –CHO;
–COOH
Слайд 27Заместители II рода затрудняют реакции электрофильного замещения по сравнению с
незамещенным бензолом, причем входящая группа вступает в мета-положение
Слайд 32
5.3. Реакции SE в гетероциклических соединениях
.
Гетероатомы
в ароматических системах могут оказывать активирующее (пиррол, фуран, тиофен )
и дезактивирующее влияние (пиридин)Слайд 33Пиррол, фуран и тиофен по сравнению с бензолом являются π-избыточными
(суперарома-тическими системами), следствием этого является их более высокая реакционная способность
по сравнению с бензолом в SЕ-реакциях, и они протекают преимущественно в α-положенииСлайд 37Пиридин является π-недостаточной ароматической системой. Общая электронная плотность в ароматическом
кольце понижена по сравнению с бензолом и смещена к азоту,
поэтому реакции SЕ затруднены и протекают преимущественно в β-положениеСлайд 40
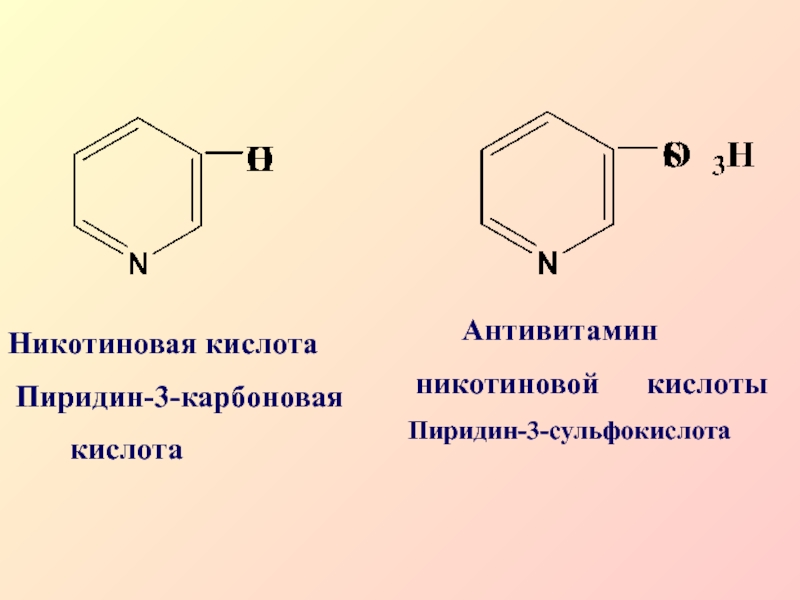
Никотиновая кислота
Пиридин-3-карбоновая
кислота
Антивитамин
никотиновой кислоты
Пиридин-3-сульфокислота