Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 2 Кислотность и основность Копия .ppt
Содержание
- 1. Лекция 2 Кислотность и основность Копия .ppt
- 2. Кислотность и основность - важные
- 3. Кислотно-основные взаимодействияА-Н + :В ↔
- 4. [НСОО-]×[Н3О+] К= [НСООН]×[Н2О]Ка
- 5. Чем ниже кислотность, тем выше рКаКа = 1,75×10-5 рКа = -lg Ка = 4,75
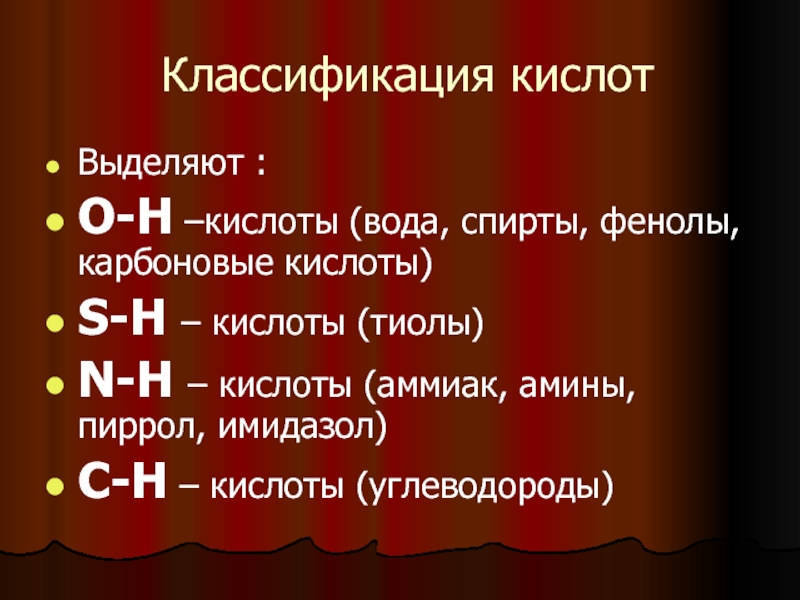
- 6. Классификация кислотВыделяют :О-Н –кислоты (вода, спирты, фенолы,
- 7. Сила кислоты определяется стабильностью образующихся ионов, которая определяется: 1.Электроотрицательнью элементов
- 8. ПОЛЯРИЗУЕМОСТЬ2. Влияние электронных эффектов δ- δ+рКа=18рКа=10рКа=12
- 9. ПоляризуемостьДля S-H кислот преобладающим фактором является поляризуемость.
- 10. Кислотность тиолов выше, чем кислотность спиртов R-S-H
- 11. CH2-S-H CH2-S-H
- 12. Делокализации заряда способствует наличие электроноакцепторных заместителей в
- 13. Атомы хлора выполняют роль электроноакцепторов
- 14. Основность –способность принимать и удерживать протоныДля образования
- 15. Сравнительная оценка основных свойствВеличина основности определяется теми
- 16. Основания образуют соли с кислотамиCH3→ NH2 +
- 17. кислотно-основные свойства аминокислотВлияние заместителя (-NH2)-группы на Аминогруппа
- 18. Несуществующая в природе формаБиполярный ион (цвиттер-ион), внутренняя
- 19. О рН>>7
- 20. Классификации аминокислот, исходя из количества карбокси-
- 21. Трипептид – глутатион - R -SH R
- 22. Липоевая кислота может уничтожать свободные радикалы (ОН.
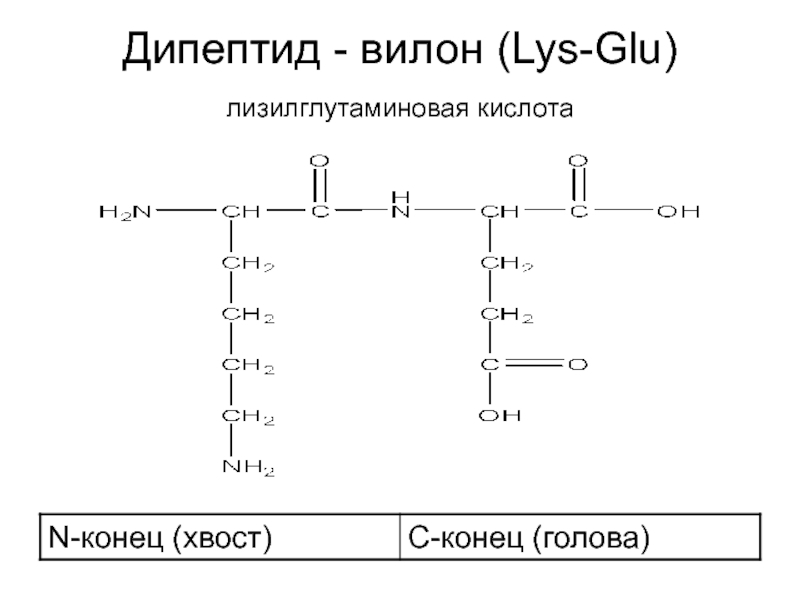
- 23. Дипептид - вилон (Lys-Glu) лизилглутаминовая кислота
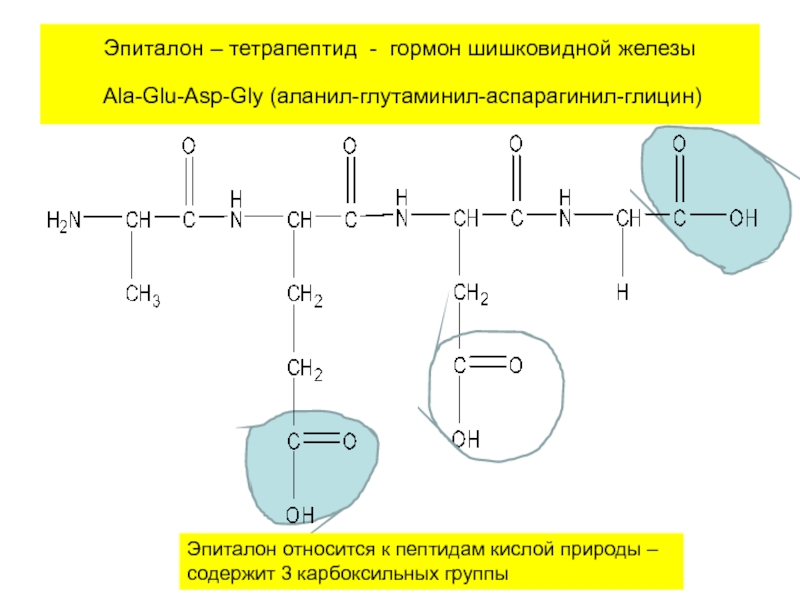
- 24. Эпиталон – тетрапептид - гормон шишковидной железы
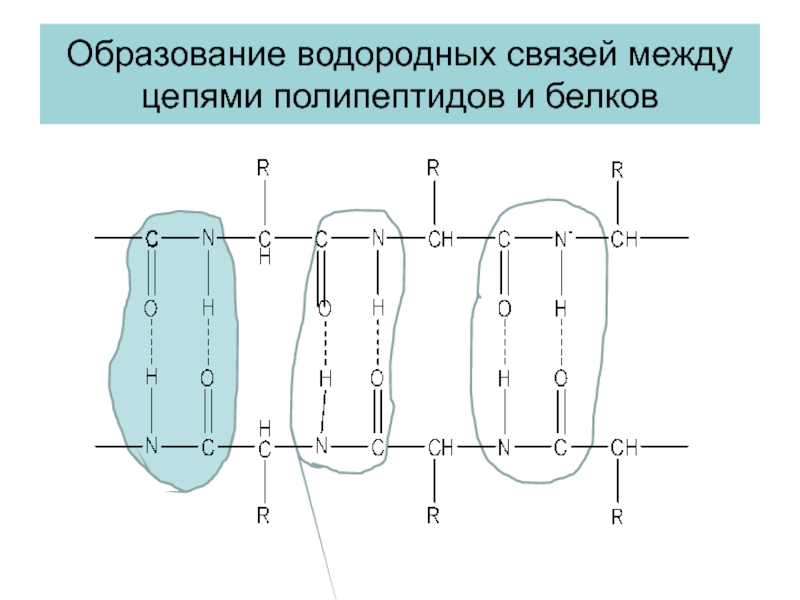
- 25. Образование водородных связей между цепями полипептидов и белков
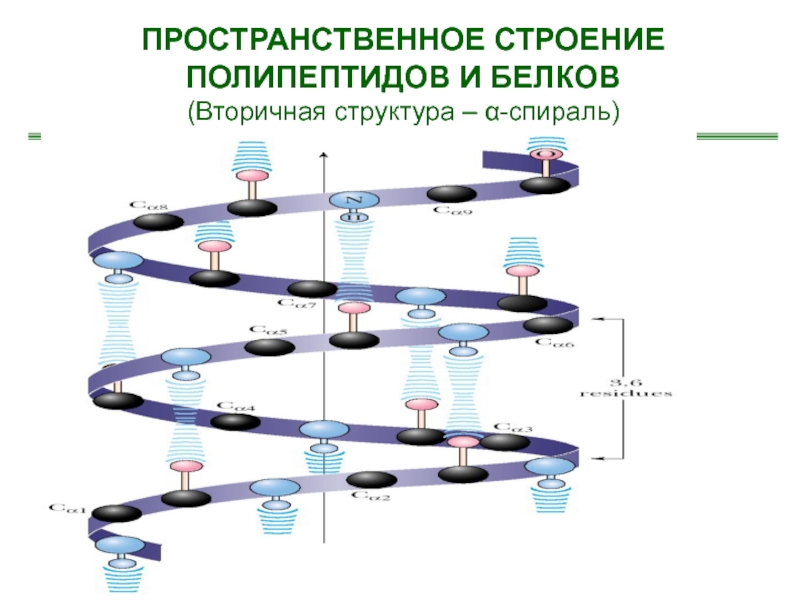
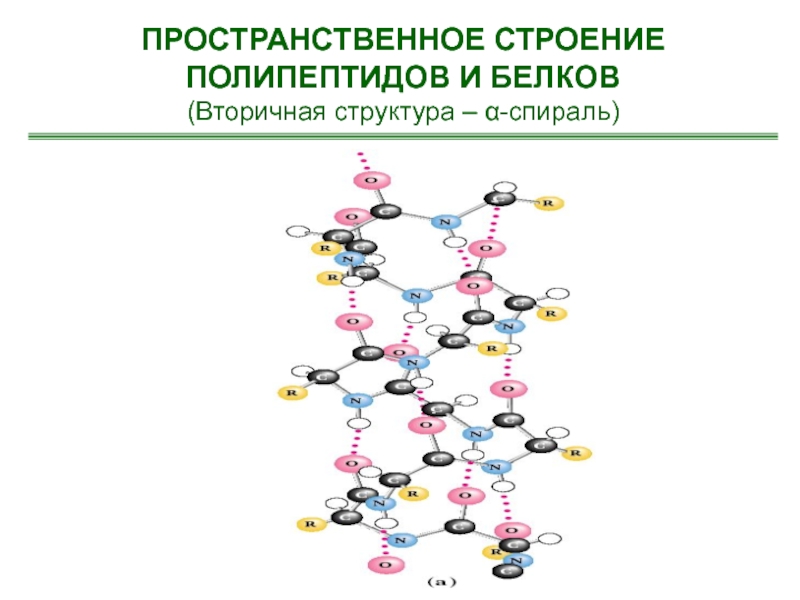
- 26. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ПОЛИПЕПТИДОВ И БЕЛКОВ(Вторичная структура – α-спираль)
- 27. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ПОЛИПЕПТИДОВ И БЕЛКОВ(Вторичная структура – α-спираль)
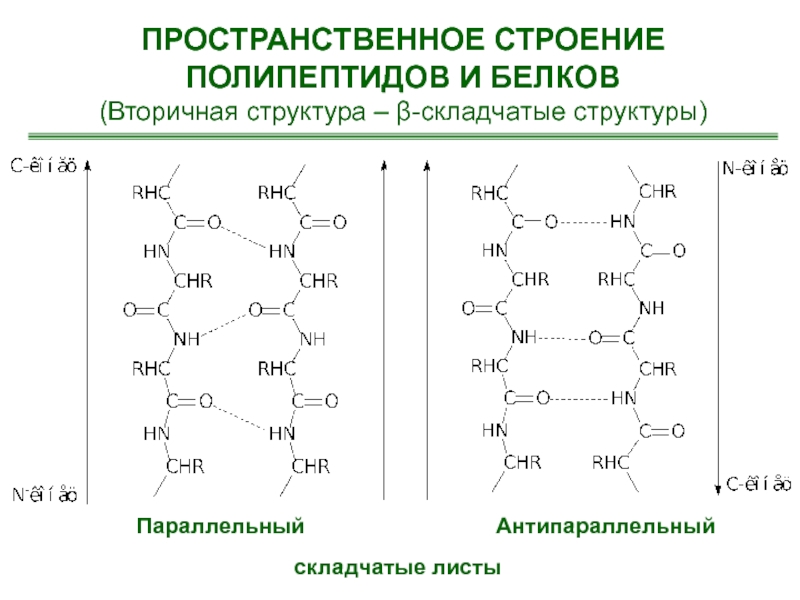
- 28. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ПОЛИПЕПТИДОВ И БЕЛКОВ(Вторичная структура – β-складчатые структуры)Параллельный Антипараллельный складчатые листы
- 29. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ПОЛИПЕПТИДОВ И БЕЛКОВ(Вторичная структура – β-складчатые структуры)
- 30. Скачать презентанцию
Кислотность и основность - важные свойства соединений, определяющие их фундаментальные физико-химические и биологические свойства. Ферментативные реакции катализиру-ются кислотами или основаниями. Слабые кислоты и основания играют важнейшую роль в метаболизме
Слайды и текст этой презентации
Слайд 3Кислотно-основные взаимодействия
А-Н + :В ↔ А- +
В-Н
кислота основание
сопряженное сопряженнаяоснование кислота
По теории Бренстеда-Лоури
Кислоты - доноры протонов,
основания- акцепторы протонов
Слайд 6Классификация кислот
Выделяют :
О-Н –кислоты (вода, спирты, фенолы, карбоновые кислоты)
S-H –
кислоты (тиолы)
N-H – кислоты (аммиак, амины, пиррол, имидазол)
С-Н – кислоты
(углеводороды)Слайд 7
Сила кислоты определяется стабильностью образующихся ионов, которая определяется:
1.Электроотрицательнью элементов
Слайд 9Поляризуемость
Для S-H кислот преобладающим фактором является поляризуемость. Атомы серы больше
по размеру и имеют вакантные d- орбитали. Следовательно, отрицательный заряд
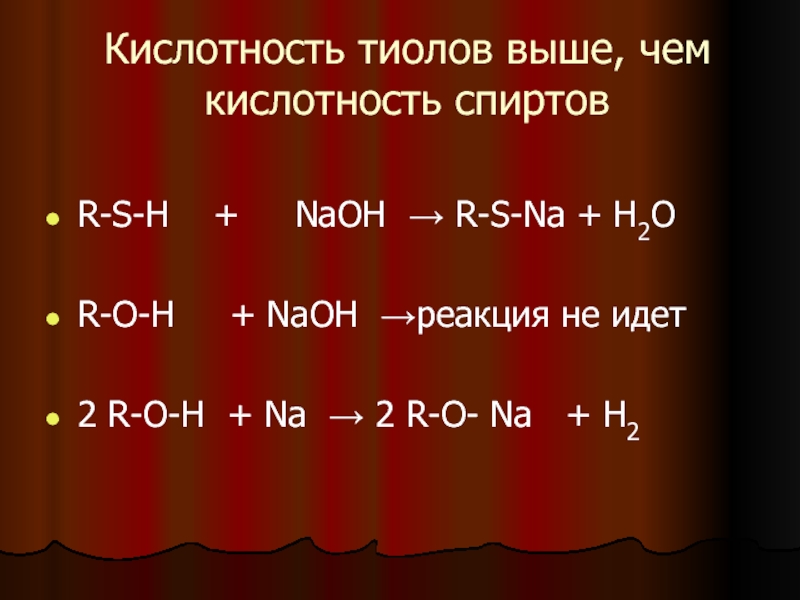
способен делокализоваться в большем орбитальном объеме, что приводит к большей стабильности аниона.Слайд 10Кислотность тиолов выше, чем кислотность спиртов
R-S-H +
NaOH → R-S-Na + H2O
R-O-H + NaOH
→реакция не идет2 R-O-H + Na → 2 R-O- Na + H2
Слайд 11
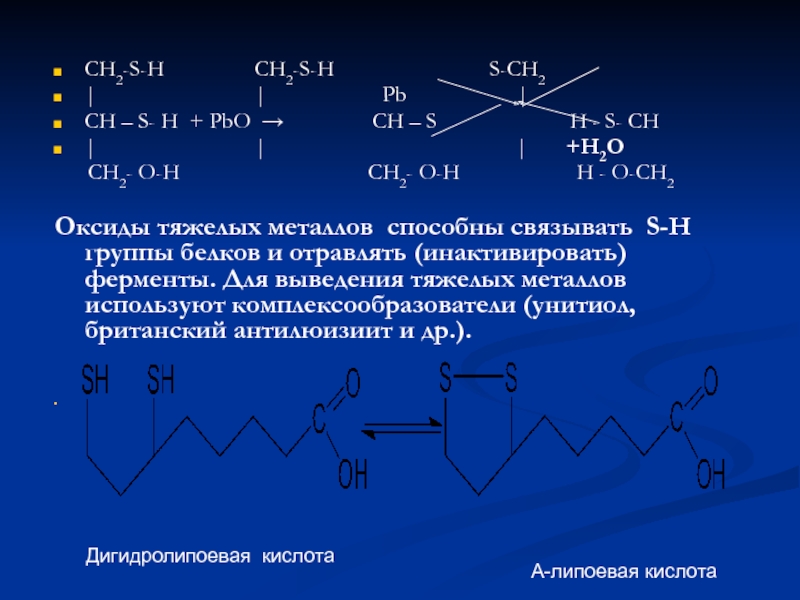
CH2-S-H CH2-S-H
S-CH2
| |
Pb |CH – S- H + PbO → CH – S H - S- CH
| | | +Н2О
CH2- O-H CH2- O-H H - O-CH2
Оксиды тяжелых металлов способны связывать S-H группы белков и отравлять (инактивировать) ферменты. Для выведения тяжелых металлов используют комплексообразователи (унитиол, британский антилюизиит и др.).
Дигидролипоевая кислота
Α-липоевая кислота
Слайд 12Делокализации заряда способствует наличие электроноакцепторных заместителей в молекуле (-J-эффект). Электроноакцепторы
стабилизируют анион и тем самым увеличивают кислотность.
пропановая кислота
молочная кислотарКа = 4,9 рКа = 3,9
Слайд 13Атомы хлора выполняют роль электроноакцепторов ( -
J )
СCl3←СООН > Cl←СH2 ←СООН >СH3→СООН
pKa =
1,20 pKa = 3,75 pKa = 4,75Электронодонорные заместители, напротив, уменьшают кислотность (+J )
Н – СООН > СН3-СООН > СН3-СН2 СООН
pKa = 3,7 pKa = 4,7 pKa = 4,9
Слайд 14Основность –способность принимать и удерживать протоны
Для образования ковалентной связи с
протоном Н+ органические основания должны либо иметь неподеленную пару электронов
у гетероатома (n-основания), либо быть анионами.Слайд 15Сравнительная оценка основных свойств
Величина основности определяется теми же факторами, что
и кислотность, но действие этих факторов имеет противоположную направленность
1. С
увеличением электроотрицательности атомов основность уменьшается, поскольку атом прочнее удерживанет пару электронов и она становится менее доступной для связи с протоном.N>O >S R-NH2> R-O-H > R-S-H
Слайд 16Основания образуют соли с кислотами
CH3→ NH2 + HCl →
[CH3→ N+H3 ] Cl-
хлорид метиламмонияCH3→ ОН + H2SO4 → [CH3→ O+H2 ] HSO4 -
гидроcульфат метилоксония
Соли органических соединений с минеральными и органическими кислотами, как правило, растворимы в воде, что используется при приготовлении фармпрепаратов.
Слайд 17
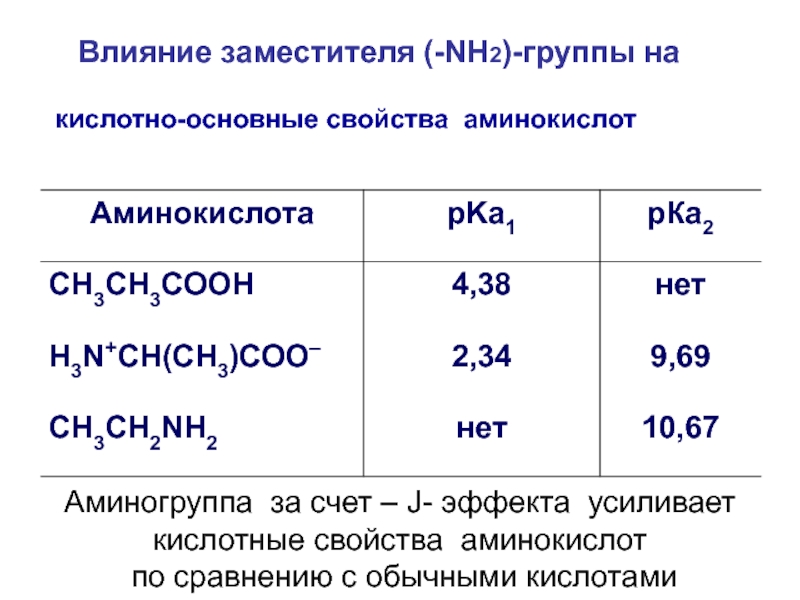
кислотно-основные свойства аминокислот
Влияние заместителя (-NH2)-группы на
Аминогруппа за счет –
J- эффекта усиливает
кислотные свойства аминокислот
по сравнению с
обычными кислотамиСлайд 18
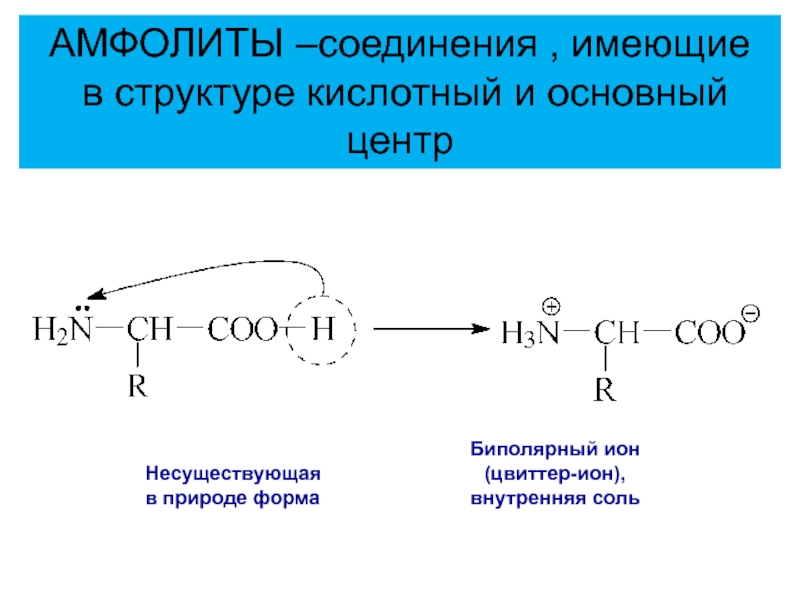
Несуществующая
в природе форма
Биполярный ион
(цвиттер-ион),
внутренняя соль
АМФОЛИТЫ –соединения ,
имеющие
в структуре кислотный и основный центр
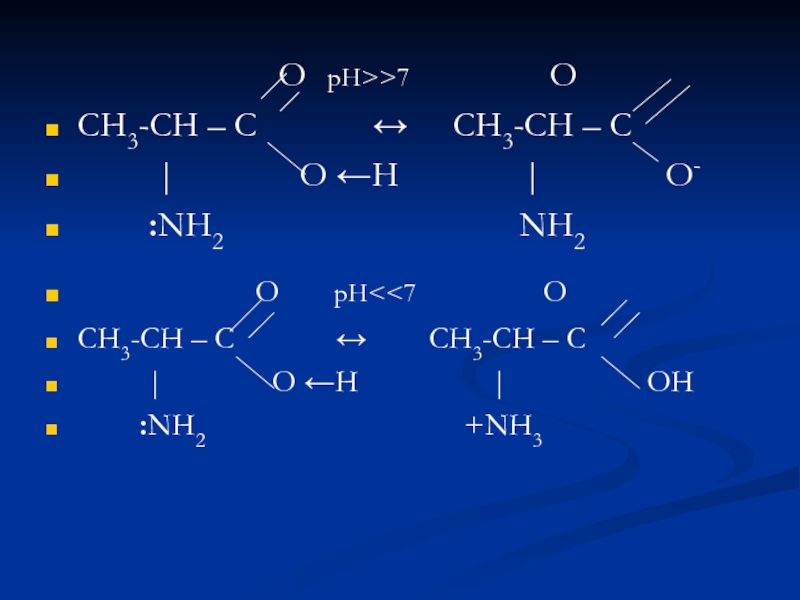
Слайд 19 О рН>>7 O
СН3-СН
– С ↔
СН3-СН – С| O ←H | O-
:NH2 NH2
О рН<<7 O
СН3-СН – С ↔ СН3-СН – С
| O ←H | OН
:NH2 +NH3
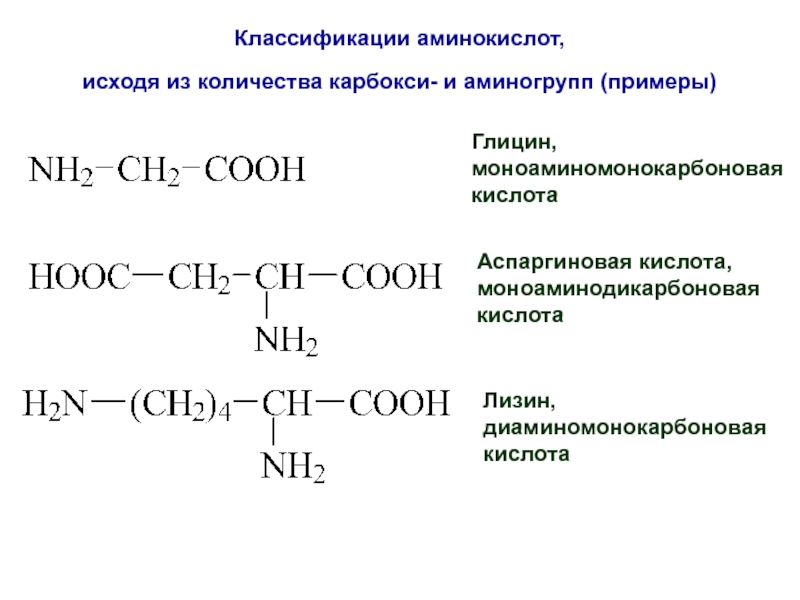
Слайд 20Классификации аминокислот,
исходя из количества карбокси- и аминогрупп (примеры)
Глицин,
моноаминомонокарбоновая
кислота
Аспаргиновая кислота,
моноаминодикарбоновая
кислота
Лизин,
диаминомонокарбоновая
кислота
Слайд 21
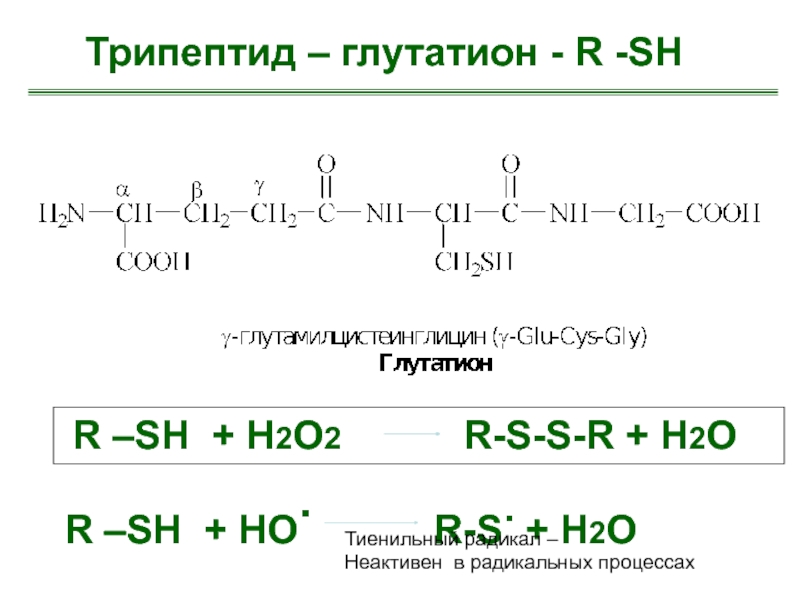
Трипептид – глутатион - R -SH
R –SH +
H2О2 R-S-S-R + H2O
R –SH + HО. R-S. + H2O
Тиенильный радикал –
Неактивен в радикальных процессах
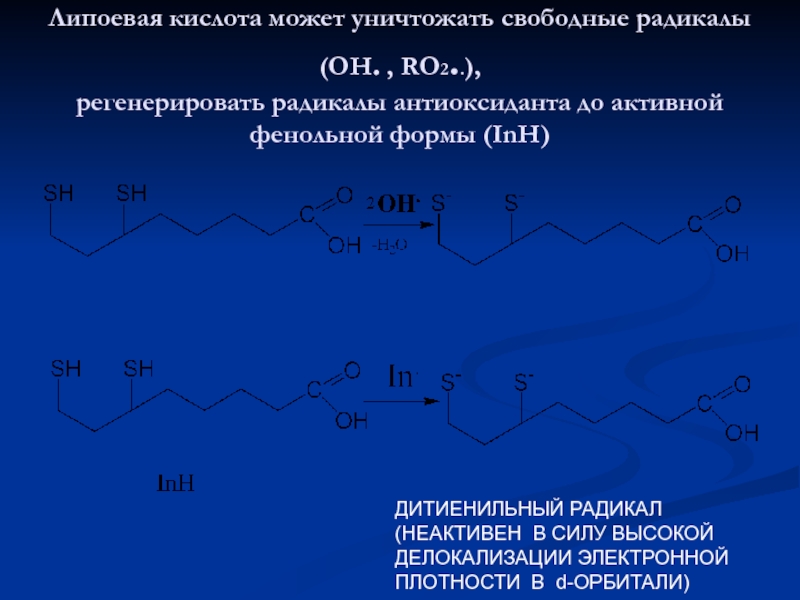
Слайд 22Липоевая кислота может уничтожать свободные радикалы (ОН. , RO2..), регенерировать
радикалы антиоксиданта до активной фенольной формы (InH)
ДИТИЕНИЛЬНЫЙ РАДИКАЛ
(НЕАКТИВЕН В СИЛУ
ВЫСОКОЙДЕЛОКАЛИЗАЦИИ ЭЛЕКТРОННОЙ
ПЛОТНОСТИ В d-ОРБИТАЛИ)



![Лекция 2 Кислотность и основность Копия .ppt [НСОО-]×[Н3О+] К= [НСООН]×[Н2О]Ка = К×[Н2О] [НСОО-]×[Н3О+] К= [НСООН] [НСОО-]×[Н3О+] К= [НСООН]×[Н2О]Ка = К×[Н2О] [НСОО-]×[Н3О+] К= [НСООН]](/img/thumbs/13e7ed189b19689e2fcb27ce5802b3de-800x.jpg)








![Лекция 2 Кислотность и основность Копия .ppt Основания образуют соли с кислотамиCH3→ NH2 + HCl → [CH3→ N+H3 Основания образуют соли с кислотамиCH3→ NH2 + HCl → [CH3→ N+H3 ] Cl-](/img/thumbs/c03240d67e09a86db4e4bc38d02f6d52-800x.jpg)